Документ втратив чинність
ПРО ЗАТВЕРДЖЕННЯ ЛІЦЕНЗІЙНИХ УМОВ ПРОВАДЖЕННЯ ГОСПОДАРСЬКОЇ ДІЯЛЬНОСТІ З ВИРОБНИЦТВА ЛІКАРСЬКИХ ЗАСОБІВ, ОПТОВОЇ, РОЗДРІБНОЇ ТОРГІВЛІ ЛІКАРСЬКИМИ ЗАСОБАМИ
| Зареєстровано в Міністерстві юстиції України 26 січня 2001 р. за № 80/5271 |
На виконання статті 8 закону України «Про ліцензування певних видів господарської діяльності» та постанови Кабінету Міністрів України від 14 листопада 2000 року № 1698 «Про затвердження переліку органів ліцензування» НАКАЗУЄМО:
1. Затвердити Ліцензійні умови провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами (додаються).
2. Управлінню ліцензування видів господарської діяльності Департаменту реєстрації та ліцензування Державного комітету України з питань регуляторної політики та підприємництва (Єфремов О.В.), управлінню акредитації та ліцензування Державного департаменту з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення (Зброжек С.І.) в установленому порядку забезпечити подання цього наказу на державну реєстрацію до Міністерства юстиції України.
3. Начальнику управління акредитації та ліцензування Державного департаменту з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення (Зброжек С.І.) забезпечити публікацію цього наказу в засобах масової інформації.
4. Визнати такими, що втратили чинність: наказ Ліцензійної палати при Міністерстві економіки України та Державного комітету України з медичної та мікробіологічної промисловості від 16 липня 1996 року № ЛП-19/69 «Про затвердження Інструкції про порядок видачі суб’єктам підприємницької діяльності спеціальних дозволів (ліцензій) на виготовлення і оптову реалізацію медикаментів, умови і правила здійснення цієї діяльності та контроль за їх дотриманням», зареєстрований в Міністерстві юстиції України 25 липня 1996 року за № 380/1405; наказ Ліцензійної палати при Міністерстві економіки України та Міністерства охорони здоров’я України від 22 березня 1996 року № ЛП-6/60 «Про затвердження Інструкцій про порядок видачі суб’єктам підприємницької діяльності спеціальних дозволів (ліцензій) на право здійснення медичної практики, проведення судово-медичної і судово-психіатричної експертизи, роздрібної реалізації медикаментів, умови і правила здійснення цієї діяльності та контролю за їх дотриманням», зареєстрований в Міністерстві юстиції України 6 травня 1996 року за № 218/1243, у частині, що стосується роздрібної реалізації медикаментів.
5. Контроль за виконанням цього наказу покласти на заступника Голови Держпідприємництва України Третьякова С.І. та першого заступника Голови Державного департаменту з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення Євтушенка О.І.
| Т.в.о. Голови Державного комітету України з питань регуляторної політики та підприємництва В.П. Загородній |
В.о. Міністра охорони здоров’я України О.О. Бобильова |
| ЗАТВЕРДЖЕНО Наказ Державного комітету України з питань регуляторної політики та підприємництва, Міністерства охорони здоров’я України від 12.01.2001 №3/8 ЗАРЕЄСТРОВАНО |
ЛІЦЕНЗІЙНІ УМОВИ
ПРОВАДЖЕННЯ ГОСПОДАРСЬКОЇ ДІЯЛЬНОСТІ З ВИРОБНИЦТВА ЛІКАРСЬКИХ ЗАСОБІВ, ОПТОВОЇ, РОЗДРІБНОЇ ТОРГІВЛІ ЛІКАРСЬКИМИ ЗАСОБАМИ
1. Загальні положення
1.1. Ліцензійні умови провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами (далі — Умови), розроблені відповідно до законів України «Про підприємництво», «Основи законодавства України про охорону здоров’я», «Про лікарські засоби», «Про підприємства в Україні», «Про ліцензування певних видів господарської діяльності», визначають Умови провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами.
1.2. Дія цих Умов поширюється на всіх суб’єктів господарювання — зареєстрованих в установленому законодавством порядку юридичних осіб незалежно від їх організаційно-правової форми та форми власності, які проводять господарську діяльність, пов’язану з виробництвом лікарських засобів, оптовою, роздрібною торгівлею лікарськими засобами, а також на фізичних осіб — суб’єктів підприємницької діяльності, які здійснюють діяльність у зазначеній галузі.
1.3. Відповідно до законодавства ліцензуванню підлягає:
• виробництво лікарських засобів;
• оптова торгівля лікарськими засобами;
• роздрібна торгівля лікарськими засобами.
1.4. Види діяльності, що підлягають ліцензуванню, повинні бути зазначені в установчих документах суб’єкта господарювання.
1.5. Ліцензування зазначеного виду господарської діяльності є засобом контролю держави за додержанням ліцензіатом вимог законодавства до фармацевтичної діяльності, пов’язаної з виробництвом лікарських засобів, оптовою, роздрібною торгівлею лікарськими засобами.
1.6. Приймання документів, що подаються для одержання ліцензії, видача, переоформлення й анулювання ліцензій, видача дублікатів ліцензій, ведення ліцензійних справ і ліцензійних реєстрів, контроль у межах своєї компетенції за додержанням ліцензіатами ліцензійних умов, видача розпоряджень про усунення порушень ліцензійних умов, а також розпоряджень про усунення порушень законодавства у сфері ліцензування проводиться Державним департаментом з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення (далі — Державний департамент).
1.7. Ліцензія Державного департаменту є єдиним документом дозвільного характеру, який дає право на здіснення діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами та дозволяє провадження зазначених видів діяльності на всій території України.
1.8. Для одержання ліцензії на діяльність, зазначену в пункті 1.3 цих Умов, у повному обсязі або частково суб’єкт господарювання подає до Державного департаменту заяву за встановленою формою (додаток 1). Зазначена заява подається особисто або через уповноважену особу.
У разі наявності в заявника відокремлених підрозділів, які провадитимуть господарську діяльність на підставі отриманої ліцензії, у заяві зазначається їх місцезнаходження.
1.9. До заяви додаються документи згідно з статтею 10 закону України «Про ліцензування певних видів господарської діяльності».
Заява про видачу ліцензії та документи, що додаються до неї, приймаються за описом (додаток 2), копія якого видається заявнику з відміткою про дату прийняття документів Державним департаментом та підписом відповідальної особи.
Усі подані заявником документи формуються в окрему справу.
1.10. Заява про видачу ліцензії залишається без розгляду, якщо:
1) заява подана (підписана) особою, яка не має на це повноважень;
2) документи оформлені з порушенням закону України «Про ліцензування певних видів господарської діяльності».
Про залишення заяви про видачу ліцензії без розгляду заявник повідомляється в письмовій формі.
1.11. Державний департамент для розгляду заяв про видачу ліцензій і відповідних документів створює Ліцензійну комісію. Положення про комісію та її склад затверджуються наказом Державного департаменту.
Рішення ліцензійної комісії оформлюється протоколом її засідання і затверджується наказом Державного департаменту.
1.12. Державний департамент приймає рішення про видачу ліцензії або про відмову в її видачі у строк не пізніше ніж десять робочих днів з дати надходження заяви про видачу ліцензії та документів, що додаються до заяви.
1.13. Повідомлення про прийняття рішення про видачу ліцензії або про відмову у видачі ліцензії надсилається (видається) заявникові в письмовій формі протягом трьох робочих днів з дати прийняття відповідного рішення.
1.14. Підставами для прийняття рішення про відмову у видачі ліцензії є:
• недостовірність даних у документах, поданих заявником для отримання ліцензії;
• невідповідність заявника згідно з поданими документами ліцензійним умовам, установленим для виду господарської діяльності, зазначеного в заяві про видачу ліцензії.
У разі відмови у видачі ліцензії на підставі виявлення недостовірних даних у документах, поданих заявником про видачу ліцензії, суб’єкт господарювання може подати до Державного департаменту нову заяву про видачу ліцензії не раніше ніж через три місяці з дати прийняття рішення про відмову у видачі ліцензії.
У разі відмови у видачі ліцензії на підставі невідповідності заявника ліцензійним умовам, установленим для виду господарської діяльності, указаного в заяві про видачу ліцензії, суб’єкт господарювання може подати до Державного департаменту нову заяву про видачу ліцензії після усунення причин, що стали підставою для відмови у видачі ліцензії.
1.15. Відповідність суб’єкта господарювання ліцензійним умовам установлюється на підставі висновку Державного департаменту або уповноваженої Державним департаментом установи про відповідність матеріально-технічної, нормативно-правової бази, кваліфікації персоналу вимогам до фармацевтичної діяльності.
1.16. Ліцензії на виробництво лікарських засобів, оптову, роздрібну торгівлю лікарськими засобами оформляються на бланках єдиного зразка, що затверджені Кабінетом Міністрів України.
Ліцензія підписується керівником Державного департаменту або його заступником та засвідчується печаткою цього органу.
1.17. Ліцензія видається заявнику особисто не пізніше ніж за три робочих дні після надходження документа, що підтверджує внесення плати за видачу ліцензії.
Якщо заявник протягом тридцяти календарних днів з дня направлення йому повідомлення про прийняття рішення про видачу ліцензії не подав документа, що підтверджує внесення плати за видачу ліцензії, або не звернувся до Державного департаменту для отримання оформленої ліцензії, то Державний департамент, який оформив ліцензію, має право скасувати рішення про видачу ліцензії або прийняти рішення про визнання такої ліцензії недійсною.
1.18. Видача ліцензії реєструється у пронумерованому, прошнурованому та опечатаному журналі обліку заяв та виданих ліцензій за встановленою формою (додаток 3). Журнал обліку заяв та виданих ліцензій ведеться окремо на кожний вид господарської діяльності, що підлягає ліцензуванню.
1.19. Для кожного відокремленого підрозділу ліцензіата, який провадитиме господарську діяльність на підставі отриманої ним ліцензії, Державний департамент видає ліцензіату засвідчену ним копію ліцензії, яка реєструється в журналі обліку заяв та виданих ліцензій. Засвідчена Державним департаментом копія ліцензії є документом, що підтверджує право підрозділу ліцензіата на провадження певного виду господарської діяльності на підставі отриманої ліцензії.
1.20. У разі створення ліцензіатом нового відокремленого підрозділу, який провадитиме певний вид господарської діяльності згідно з отриманою ліцензією, ліцензіат повинен подати до Державного департаменту заяву про видачу копії ліцензії (додаток 4), а також висновок Державного департаменту або уповноваженої Державним департаментом установи про відповідність матеріально-технічної, нормативно-правової бази, кваліфікації персоналу вимогам до фармацевтичної діяльності відокремленого підрозділу суб’єкта господарювання.
1.21. У разі ліквідації відокремленого підрозділу ліцензіата, який провадив господарську діяльність згідно з отриманою ліцензією, або в разі припинення провадження відокремленим підрозділом ліцензіата господарської діяльності згідно з отриманою ліцензією ліцензіат зобов’язаний протягом семи робочих днів з дати ліквідації такого відокремленого підрозділу або з дати припинення діяльності такого відокремленого підрозділу подати до Державного департаменту відповідне повідомлення в письмовій формі.
1.22. Ліцензіат не може передавати ліцензію або її копію іншій юридичній або фізичній особі для провадження господарської діяльності.
1.23. Ліцензія підлягає переоформленню у разі:
• зміни найменування юридичної особи (якщо зміна найменування не пов’язана з реорганізацією юридичної особи) або прізвища, ім’я, по батькові фізичної особи — суб’єкта підприємницької діяльності;
• зміни місцезнаходження юридичної особи або місця проживання фізичної особи — суб’єкта підприємницької діяльності;
• змін, пов’язаних з провадженням ліцензіатом певного виду господарської діяльності, указаного в пункті 1.3 цих Умов.
1.24. У разі виникнення підстав для переоформлення ліцензії ліцензіат зобов’язаний протягом десяти робочих днів подати до Державного департаменту заяву про переоформлення ліцензії (додаток 5) разом з ліцензією, що підлягає переоформленню, та відповідними документами або їх нотаріально засвідченими копіями, які підтверджують зазначені зміни.
1.25. Ліцензіат, який подав заяву та відповідні документи про переоформлення ліцензії, може провадити свою діяльність на підставі довідки про прийняття зазначених документів до розгляду, яка видається Державним департаментом.
1.26. У разі втрати або пошкодження ліцензії ліцензіат зобов’язаний звернутися до Державного департаменту із заявою про видачу дубліката ліцензії (додаток 6).
1.27. Ліцензіат, який подав заяву та відповідні документи для видачі дубліката ліцензії замість утраченої або пошкодженої, може провадити свою діяльність на підставі відповідної довідки Державного департаменту.
1.28. Державний департамент формує і веде ліцензійний реєстр з певного виду господарської діяльності.
2. Ліцензійні умови провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами
2.1. Загальноорганізаційні вимоги
2.1.1. Суб’єкт господарювання при здійсненні діяльності з виробництва лікарських засобів, оптової та роздрібної торгівлі лікарськими засобами повинен дотримуватись вимог:
а) законів України:
• «Про підприємництво»;
• «Про захист прав споживачів»;
• «Про підприємства в Україні»;
• «Про забезпечення санітарного та епідеміологічного благополуччя населення»;
• «Основи законодавства України про охорону здоров’я»;
• «Про лікарські засоби»;
• «Про обіг в Україні наркотичних засобів, психотропних речовин, їх аналогів і прекурсорів»;
• «Про ліцензування певних видів господарської діяльності»;
б) постанов Кабінету Міністрів України:
• від 08.02.95 № 108 «Про порядок заняття торговельною діяльністю і правила торговельного обслуговування населення»;
• від 03.01.96 № 6 «Про затвердження Положення про порядок здійснення діяльності у сфері обігу наркотичних засобів, психотропних речовин і прекурсорів»;
• від 15.01.96 № 73 «Про затвердження Положення про контроль за відповідністю імунобіологічних препаратів, що застосовуються в медичній практиці, вимогам державних та міжнародних стандартів»;
• від 12.05.97 № 447 «Про впорядкування діяльності аптечних закладів та затвердження Правил роздрібної реалізації лікарських засобів»;
• від 15.07.97 № 765 «Про порядок державної акредитації закладу охорони здоров’я»;
в) наказів Міністерства охорони здоров’я України:
• від 14.06.93 № 139 «Про затвердження Інструкції по санітарно-протиепідемічному режиму аптек», зареєстрованого в Міністерстві юстиції України 22 листопада 1995р. за № 420/956;
• від 30.06.94 № 117 «Про порядок виписування рецептів та відпуску лікарських засобів і виробів медичного призначення з аптек», зареєстрованого в Міністерстві юстиції України 28 липня 1994р. за № 171/380;
• від 22.06.95 № 114 «Про затвердження Переліку закладів охорони здоров’я, Переліку лікарських посад і Переліку посад фармацевтичних працівників», зареєстрованого в Міністерстві юстиції України 2 листопада 1995р. за № 399/935;
• від 08.07.96 № 199 «Про затвердження Правил проведення утилізації та знищення неякісних лікарських засобів», зареєстрованого в Міністерстві юстиції України 26 липня 1996р. за № 407/1432;
• від 10.06.97 № 177 «Про затвердження нормативних актів з питань реклами лікарських засобів», зареєстрованого в Міністерстві юстиції України 24 липня 1997р. за № 268/2072;
• від 25.07.97 № 233 «Про затвердження Переліків лікарських засобів, зареєстрованих в Україні», зареєстрованого в Міністерстві юстиції України 24 вересня 1997р. за № 444/2248;
• від 18.12.97 № 356 «Про затвердження Порядку обігу наркотичних засобів, психотропних речовин та прекурсорів в державних і комунальних закладах охорони здоров’я», зареєстрованого в Міністерстві юстиції України 3 лютого 1998р. за № 67/2507;
• від 31.07.98 № 231 «Про вдосконалення атестації провізорів та фармацевтів», зареєстрованого в Міністерстві юстиції України 17 серпня 1998р. за № 513/2953;
у частині, що регулює діяльність, пов’язану з реєстрацією, виробництвом, зберіганням, контролем якості, оптовою та роздрібною торгівлею лікарськими засобами.
2.1.2. Виробництво лікарських засобів, оптова, роздрібна торгівля лікарськими засобами здійснюються суб’єктами господарювання на підставі ліцензії на певний вид діяльності за умови виконання кваліфікаційних, організаційних, інших спеціальних вимог, установлених ліцензійними умовами.
2.1.3. До виробництва допускаються лікарські засоби після їх державної реєстрації, крім випадків, передбачених законом України «Про лікарські засоби». До оптової, роздрібної торгівлі лікарськими засобами допускаються лише зареєстровані в Україні лікарські засоби за наявності сертифіката якості, що видається виробником.
Торгівля неякісними лікарськими засобами або такими, термін придатності яких минув, або на які відсутній сертифікат якості, що видається виробником, забороняється.
Торгівля лікарськими засобами, виготовленими аптекою з порушеннями умов виробництва, заборонена.
2.1.4. Виробництво лікарських засобів здійснюється з додержанням вимог Державної Фармакопеї, інших нормативно-технічних документів, які встановлюють вимоги до лікарського засобу, його упаковки, умов і термінів зберігання та методів контролю якості лікарського засобу.
2.1.5. Торгівля лікарськими засобами здійснюється лише через аптеки, аптечні бази (склади).
Аптека, аптечна база (склад) належать до закладів охорони здоров’я, що функціонують з дозволу і під контролем державних органів.
2.1.6. Аптека, аптечна база (склад) повинні відповідно до постанови Кабінету Міністрів України від 15.07.97 № 765 «Про порядок державної акредитації закладу охорони здоров’я» пройти державну акредитацію протягом року з дати отримання ліцензії.
2.1.7. Суб’єкт господарювання повинен забезпечити:
• відповідність матеріально-технічної бази вимогам нормативних документів щодо виробництва, зберігання, контролю якості, торгівлі лікарськими засобами;
• дотримання вимог законодавства щодо якості лікарських засобів під час виробництва, транспортування, зберігання та торгівлі ними, а також наявності підрозділу чи фахівця з контролю якості лікарських засобів або наявності договору з акредитованою Державним департаментом лабораторією з аналізу якості лікарських засобів.
2.1.8. Суб’єкт господарювання зобов’язаний мати план термінових дій, які забезпечують виконання наказів, вимог Державного департаменту та Державної інспекції з контролю якості лікарських засобів МОЗ України щодо зупинення виробництва, торгівлі, вилучення із торгівлі лікарських засобів і вжиття відповідних заходів щодо повернення продавцю (виробнику) зазначених лікарських засобів або їх знищення та утилізації.
2.1.9. Суб’єкт господарювання повинен зберігати та надавати контрольним органам для перевірок документи, що фіксують: закупівлю, виробництво, зберігання, транспортування, знищення або утилізацію лікарських засобів — для виробництва лікарських засобів; закупівлю, зберігання, транспортування, торгівлю, знищення або утилізацію лікарських засобів — для оптової та роздрібної торгівлі лікарськими засобами.
2.2. Спеціальні вимоги
2.2.1. До виробництва лікарських засобів
2.2.1.1. Виробництво лікарських засобів здійснюється за наявності технічного та технологічного регламентів (далі — регламент) виробництва лікарських засобів, аналітичної нормативної документації (фармакопейна стаття, ТУ), розроблених у відповідності до нормативних документів, стандартів, діючих у медичній та мікробіологічній промисловості.
Регламент повинен містити вимоги до виробництва конкретного лікарського засобу та визначати рівень технології, технологічного обладнання, кваліфікації персоналу, проведення виробничого контролю якості лікарських засобів, а також вимоги щодо охорони навколишнього середовища, техніки безпеки виробництва, створення необхідних санітарно-гігієнічних умов виробництва, що гарантують виробництво лікарських засобів відповідно до вимог аналітичної нормативної документації.
2.2.1.2. Приміщення для виробництва лікарських засобів повинні бути розміщені та впорядковані відповідно до технологічних зон: виробничих, складських, зон контролю якості, допоміжних зон.
Виробничі зони (приміщення) — приміщення, у яких виробляються, контролюються, пакуються, етикетуються лікарські засоби.
Складські зони — приміщення для прийняття, складування та зберігання, відбору проб для контролю якості, відпуску сировини, допоміжних речовин, матеріалів та готових лікарських засобів.
Зони контролю якості — приміщення для контролю (фізико-хімічних показників та мікробіологічного, біологічного, клінічного) сировини, матеріалів, напівпродуктів, проміжного (міжопераційного) контролю виробництва та контролю якості готових лікарських засобів.
Допоміжні зони — приміщення, необхідні для обслуговування проведення технологічного процесу, які не входять у виробничі, складські зони і зони контролю якості та відокремлені від них (майстерні, кімнати відпочинку, їдальні, умивальні, туалети, приміщення для утримання тварин).
Загальні вимоги до виробничих зон
2.2.1.3. У виробничих приміщеннях і в зоні виконання технологічних операцій у відповідності до технологічного регламенту встановлюються класи чистоти повітряного середовища за вмістом механічних часток і мікроорганізмів.
2.2.1.4. Виробничі приміщення повинні бути обладнані системою вентиляції повітря, яка забезпечує відповідний клас чистоти навколишнього середовища для виконання стадій технологічного процесу відповідно до технологічного регламенту. Для досягнення певного класу чистоти система вентиляції повітря повинна враховувати розмір приміщення, обладнання і персонал, який у ньому перебуває, забезпечувати багатократний повітрообмін і мати відповідні фільтри.
2.2.1.5. Освітлення, температура, вологість і вентиляція повинні відповідати вимогам технологічного регламенту і не впливати ні на якість лікарського засобу під час його виробництва і зберігання, ні на точність функціонування обладнання.
2.2.1.6. Розташування приміщень має відповідати послідовності виконання операцій виробничого процесу і вимогам рівня чистоти, унеможливлювати перехрещення технологічних, матеріальних та людських потоків.
2.2.1.7. Повинні бути вжиті заходи до запобігання входу в приміщення сторонніх. Зони виробництва, зберігання і контролю якості не повинні використовуватись як прохідні для персоналу, який у них не працює.
2.2.1.8. Розміщення і робота обладнання повинні здійснюватися таким чином, щоб звести до мінімуму ризик помилок, а також забезпечити ефективне очищення та експлуатацію, які дадуть змогу уникнути контамінації та будь-якого шкідливого впливу на якість лікарського засобу.
2.2.1.9. Внутрішні поверхні приміщень (стіни, підлога, стеля) повинні бути гладкими, без щілин та тріщин, легко та ефективно очищуватися і при потребі дезінфікуватися; від них не повинні відокремлюватися частинки.
2.2.1.10. Виробниче обладнання повинно очищуватися у відповідності до затверджених керівником підприємства, організації чи установи методик і не впливати на якість лікарського засобу.
2.2.1.11. Робочі трубопроводи, освітлювальні прилади, вентиляційне устаткування та інші системи обслуговування повинні бути розташовані таким чином, щоб не було заглиблень, що ускладнюють очистку. Обладнання та трубопроводи повинні бути чітко промарковані.
2.2.1.12. На підприємстві має бути вся основна документація щодо виробництва та контролю якості лікарських засобів, що виробляються.
Основна документація: регламенти, фармакопейні статті, аналітична нормативна документація, стандарти, інструкції, виробничі реєстраційні записи (протоколи виробництва серій), результати контролю якості вихідної сировини, матеріалів, напівпродуктів, проміжних та нерозфасованих продуктів, готових лікарських засобів.
Загальні вимоги до складських зон
2.2.1.13. Складські зони повинні бути пристосовані для забезпечення умов зберігання вихідної сировини, матеріалів, нерозфасованої, готової продукції та продукції, що перебуває в процесі контролю (карантинна зона). Вони повинні бути чистими, сухими, у них мають підтримуватися визначені в технологічному регламенті температура та вологість. Температура та вологість контролюються та реєструються у журналах.
2.2.1.14. Для відбору проб вихідної сировини повинна бути відокремлена зона. Якщо відбір проб здійснюється в зоні зберігання, то він повинен проводитись таким чином, щоб запобігти контамінації та будь-якому шкідливому впливу на якість лікарського засобу.
2.2.1.15. Відбраковані, відкликані або повернені матеріали, вихідна сировина, пакувальні матеріали та готова продукція повинні зберігатися в ізольованих зонах.
2.2.1.16. Лікарські засоби та сировину потрібно зберігати у відповідності до токсикологічних груп, визначених у технологічному регламенті, та з урахуванням фізико-хімічних властивостей.
Загальні вимоги до зон контролю якості
2.2.1.17. Лабораторії з контролю за якістю лікарських засобів повинні мати місця для зберігання зразків і протоколів та відокремлюватись від виробничих зон.
2.2.1.18. Прилади, обладнання та апарати, які є в лабораторії, повинні мати технічні паспорти, а також підлягати своєчасному технічному обслуговуванню та перевірці.
2.2.1.19. Обладнання для контролю якості має забезпечувати необхідну точність та інші характеристики для контролю всіх показників якості продукції, що передбачені нормативно-технічною документацією.
2.2.1.20. Засоби вимірювання, що використовуються під час виробництва лікарських препаратів та контролю їх якості, повинні бути метрологічно атестовані, мати державне повірочне тавро і проходити повірку в установленому порядку.
Загальні вимоги до допоміжних зон
2.2.1.21. Кімнати відпочинку і їдальні повинні бути відокремлені від інших зон.
2.2.1.22. Гардеробні, умивальні (душові) та туалети повинні бути доступні і за кількістю відповідати вимогам норм до санітарно-технічного обладнання. Туалети не повинні безпосередньо сполучатись з виробничими, складськими зонами та зонами контролю якості.
2.2.1.23. Майстерні повинні бути відокремлені від виробничих зон. Якщо запасні частини та інструменти зберігаються у виробничій зоні, то вони повинні зберігатися в спеціально передбачених для цього кімнатах чи місцях.
2.2.1.24. Приміщення, у яких перебувають тварини, повинні бути ізольованими від інших зон, мати окремий вхід і систему підготовки (обробки) повітря.
Спеціальні вимоги до стерильного виробництва
2.2.1.25. Стерильну продукцію дозволяється виробляти тільки в чистих зонах (приміщеннях), доступ у які персоналу, подача сировини і матеріалів повинні здійснюватись через повітряні шлюзи.
2.2.1.26. Чисті зони для виробництва стерильних лікарських засобів класифікуються за класами чистоти у відповідності до вимог технологічного регламенту. Кожна технологічна операція вимагає рівня чистоти навколишнього середовища, визначеного в технологічному регламенті.
2.2.1.27. У чисті зони повинно подаватися підготовлене повітря для забезпечення необхідних класів чистоти, що передбачено нормативно-технічною документацією (технологічним регламентом). Контроль ефективності очистки повітря та ефективності використаних фільтрів є систематичним і обов’язковим.
2.2.1.28. У чистих зонах має перебувати кількість персоналу згідно з штатним розкладом, затвердженим керівником підприємства, організації, установи.
2.2.1.29. Персонал, що працює в чистих зонах виробництва стерильних лікарських засобів, повинен володіти знанням і досвідом практичної роботи, що необхідно для виробництва стерильних лікарських засобів, регулярно підвищувати кваліфікацію.
2.2.1.30. До персоналу висуваються вимоги щодо особистої гігієни та чистоти відповідно до вимог технологічного регламенту. Перевдягатися та митися слід у спеціально відведених і опоряджених приміщеннях, розташованих безпосередньо біля чистої зони, щоб звести до мінімуму ризик контамінації спеціального технологічного одягу для роботи в чистих зонах і не внести забруднення в чисті зони. Розміщення приміщень визначається технологічним регламентом.
2.2.1.31. Під час проведення технологічного процесу персонал повинен бути одягнутий в спеціальний технологічний одяг з безворсової тканини, що відповідає виконуваним технологічним операціям, і має дотримуватись вимог, які регламентують виробництво стерильних лікарських засобів, технологічних регламентів, затверджених керівником підприємства, організації, установи, технологічних інструкцій.
2.2.1.32. Підготовка спеціального технологічного одягу здійснюється в окремій чистій зоні виробничого приміщення відповідно до вимог технологічного регламенту.
Спеціальні вимоги до виробництва імунобіологічних препаратів
2.2.1.33. Роботу із стерильними імунобіологічними препаратами слід проводити в зонах з підвищеним тиском, але в особливих зонах у точках локалізації патогенних мікроорганізмів повинен бути знижений тиск, що використовується з метою ізоляції. Якщо для роботи в асептичних умовах з патогенними мікроорганізмами використовуються зони зі зниженим тиском або безпечні бокси, то вони повинні бути розташовані в середині стерильної зони з підвищеним тиском.
2.2.1.34. У виробничих зонах повинні бути спеціальні установки для фільтрації повітря; не допускається рециркуляція повітря із зон, де працюють з живими патогенними організмами.
2.2.2. До оптової торгівлі лікарськими засобами
2.2.2.1. Оптова торгівля лікарськими засобами здійснюється лише через аптечні бази (склади).
2.2.2.2. Аптечна база (склад) повинна бути розміщена в капітальній споруді і займати ізольовані приміщення з окремим входом.
Не допускається розміщення аптечної бази (складу) в житлових будинках, спортивних спорудах, школах, учбових і дитячих дошкільних закладах, закладах культури, спорту, освіти та соціального забезпечення, лікувально-профілактичних установах, магазинах.
2.2.2.3. Аптечна база (склад) обов’язково повинна мати:
• виробничі приміщення (для приймання, зберігання різних груп лікарських засобів з урахуванням їх фізико-хімічних властивостей та дії на них різноманітних факторів зовнішнього середовища, тари, комплектації і відпуску продукції /експедиційна/);
• службово-побутові приміщення (кімната персоналу, обладнана рукомийником, приміщення для зберігання господарського інвентарю, туалет).
2.2.2.4. Площа виробничих приміщень повинна становити не менше ніж 100 кв.м.
При здійсненні торговельних операцій з лікарськими засобами специфічних груп, що вимагають особливих умов зберігання (отруйні та наркотичні, імунобіологічні та бактерійні препарати, препарати, що вимагають захисту від дії підвищеної температури, вогненебезпечні та вибухонебезпечні, лікарська рослинна сировина, дезінфекційні засоби), суб’єкт господарювання повинен забезпечити наявність окремих приміщень для їх зберігання.
2.2.2.5. Склад, площі, розміщення виробничих приміщень, їх упорядкування, обладнання та експлуатація повинні:
• відповідати вимогам Державних будівельних норм, санітарних норм і правил, інших нормативних документів;
• забезпечувати послідовність технологічного процесу, що включає такі етапи: приймання, зберігання, контроль якості, комплектацію, відпуск (відвантаження) лікарських засобів та їх схоронність.
2.2.2.6. Електрозабезпечення, опалення, освітлення, вентиляція, температура і вологість повітря у складських приміщеннях повинні відповідати нормативним вимогам щодо будівельних і санітарних норм і правил та не впливати негативно (прямо чи опосередковано) на діючу речовину (субстанції), готові лікарські засоби.
2.2.2.7. Аптечні бази (склади) повинні бути обладнані приладами центрального опалення або іншими автономними системами опалення, які відповідають нормам пожежної безпеки. Не допускається опалення приміщень газовими приладами з відкритим полум’ям або електронагрівальними приладами з відкритою електроспіраллю.
2.2.2.8. Лікарські засоби у виробничих складських приміщеннях повинні зберігатися на стелажах, піддонах, підтоварниках, у шафах, у холодильному та іншому спеціальному обладнанні для забезпечення умов зберігання лікарських засобів відповідно до діючих вимог.
Установлення стелажів здійснюється таким чином, щоб вони розміщувалися на відстані 0,6–0,7 м від зовнішніх стін, не менше ніж 0,5 м від стелі та не менше ніж 0,25 м від підлоги. Стелажі щодо вікон повинні бути розташовані так, щоб проходи були освітлені, а відстань між стелажами становила не менше 0,75 м для забезпечення вільного доступу до товару.
2.2.2.9. Для підтримання чистоти повітря приміщення для зберігання повинні бути обладнані припливно-витяжною вентиляцією з механічним спонуканням.
2.2.2.10. Складські приміщення повинні бути забезпечені термометрами і гігрометрами, які кріпляться на внутрішніх стінах сховища віддалік від нагрівальних приладів, на висоті 1,5–1,7 м від підлоги та віддалі не менш 3 м від дверей. У кожному приміщенні (кімнаті) має бути заведена карта обліку температури та відносної вологості.
2.2.2.11. Складські приміщення для зберігання вогненебезпечних та вибухонебезпечних речовин повинні бути ізольовані, захищені від прямих сонячних променів, атмосферних опадів та грунтових вод.
2.2.2.12. При відсутності окремих сховищ для легкозаймистих речовин допускається зберігання їх у загальних вогнетривких будівлях, а також у будівлях, поділених на секції при обов’язковій ізоляції приміщень, виділених для зберігання речовин від сусідніх приміщень вогнетривкими стінами, які відповідають вимогам пожежної безпеки та узгоджені з органами Державного пожежного нагляду. Такі приміщення повинні мати вентиляцію.
2.2.2.13. За наявності на аптечній базі (складі) імунобіологічних препаратів загальний об’єм холодильного обладнання повинен забезпечувати відповідно до діючих вимог зберігання всієї кількості зазначених ліків, що містяться на базі (складі).
2.2.2.14. Матеріали для обробки стін, стелі, підлоги виробничих приміщень аптечної бази (складу) повинні допускати вологе прибирання з використанням дезінфікувальних засобів.
Поверхня виробничого устаткування, як ззовні, так і всередині, повинна бути гладкою, виготовленою із матеріалів, стійких до дії лікарських засобів, витримувати обробку дезінфікувальними розчинами.
Устаткування виробничих приміщень повинно розташуватися таким чином, щоб не залишалися місця, недоступні для прибирання.
2.2.2.15. Санітарний стан приміщень та устаткування аптечної бази (складу) повинен відповідати діючим вимогам.
Підлога миється не рідше 1 разу на день, стіни і двері — не рідше 1 разу на тиждень із застосуванням дезінфікувальних засобів, стеля — 1 раз на місяць очищається від пилу.
Устаткування підлягає прибиранню кожного дня.
Раковини для миття рук та санітарні вузли чистяться і дезінфікуються кожного дня.
2.2.2.16. Для прибирання різних приміщень (виробничі приміщення, санітарний вузол) повинен бути виділений інвентар (відра, тази, щітки, ганчір’я), який маркується. Зберігання його здійснюється в спеціально визначеному місці (кімната, шафа) окремо за призначенням.
2.2.2.17. Приміщення та устаткування кімнати персоналу аптечної бази (складу) повинні забезпечити утримання та схоронність особистого та спеціального одягу відповідно до вимог санітарно-епідемічного режиму, а також можливість уживання їжі та відпочинку (обладнані шафами для одягу, холодильником, меблями).
2.2.2.18. Обов’язковим для аптечної бази (складу) є наявність Державної Фармакопеї України, нормативно-технічних та нормативно-правових документів, спеціальної довідкової літератури з питань приймання, контролю якості, зберігання, порядку відпуску (відвантаження) лікарських засобів.
2.2.3. До роздрібної торгівлі лікарськими засобами
2.2.3.1. Роздрібна торгівля лікарськими засобами здійснюється лише через аптеки та їх структурні підрозділи (аптечні пункти й аптечні кіоски).
За погодженням з районними державними адміністраціями роздрібна торгівля лікарськими засобами може здійснюватися через фельдшерсько-акушерські пункти, що організовані в сільських населених пунктах за умови, якщо аптека створить у цьому закладі охорони здоров’я відокремлений структурний підрозділ (аптечний пункт чи аптечний кіоск).
2.2.3.2. Аптека повинна бути розміщена в окремому ізольованому приміщенні, що розташоване в капітальній споруді з окремим входом, і мати торговельний зал для обслуговування населення.
Аптечні пункти та аптечні кіоски повинні займати відокремлені приміщення тільки в капітальних спорудах.
Мінімальна площа: аптечного пункту — 18 кв. м, аптечного кіоску — 8 кв. м.
Аптечні пункти створюються лише в приміщеннях лікувально-профілактичних закладів.
Не допускається розміщення аптечних кіосків на територіях пішохідних переходів (надземних, підземних), транспортних зупинок, ринків (ярмарків), ринкових майданчиків, станціях метрополітену та в продовольчих магазинах.
2.2.3.3. Склад та площі виробничих і допоміжних приміщень аптеки повинні відповідати вимогам Правил роздрібної реалізації лікарських засобів (додаток 1), затверджених постановою Кабінету Міністрів України від 12 травня 1997 р. № 447.
У разі виробництва аптекою лікарських засобів склад та площі приміщень повинні відповідати вимогам Правил роздрібної реалізації лікарських засобів, затверджених постановою Кабінету Міністрів України від 12 травня 1997 р. № 447, а умови виробництва лікарських засобів — вимогам до виробництва.
2.2.3.4. Приміщення для зберігання запасів лікарських засобів повинні бути обладнані стелажами, шафами, холодильним та іншим устаткуванням для забезпечення умов зберігання отруйних, наркотичних, сильнодіючих, вогненебезпечних та вибухонебезпечних, термолабільних та інших лікарських засобів, лікарської рослинної сировини відповідно до діючих вимог.
Для контролю за температурою і вологістю приміщення для зберігання повинні бути забезпечені термометрами і гігрометрами.
2.2.3.5. Кімната персоналу аптеки повинна бути обладнана холодильником, меблями для організації вживання їжі.
2.2.3.6. Обробка стін та стель виробничих приміщень повинна допускати вологе прибирання з використанням дезінфікувальних засобів.
Усі матеріали для покриття стін, стелі, підлоги повинні застосовуватися тільки за наявності відповідних рекомендацій МОЗ.
2.2.3.7. Приміщення аптек повинні підлягати вологому прибиранню з застосуванням мийних і дезінфікувальних засобів. Сухе прибирання забороняється.
2.2.3.8. Приміщення та устаткування гардеробної повинні забезпечити утримування та схоронність спецодягу працівників відповідно до вимог санітарно-протиепідемічного режиму аптек.
2.2.3.9. Приміщення аптечного пункту обладнується стелажами, шафами, холодильником, сейфом для збереження отруйних лікарських засобів, рукомийником; аптечного кіоску — стелажами, шафами, холодильником.
У приміщенні аптечного пункту та аптечного кіоску забороняється зберігання та вживання їжі.
2.2.3.10. Прилади, апарати, які є в аптеці, повинні мати технічні паспорти, а також підлягати своєчасному технічному обслуговуванню та перевірці.
Засоби вимірювання, що використовуються, повинні бути метрологічно атестовані, мати державне повірочне тавро і проходити повірку в установленому порядку.
2.2.3.11. Приміщення, у яких зберігаються наркотичні засоби, психотропні речовини та прекурсори, повинні бути обладнані засобами охоронно-пожежної сигналізації. Обладнання цих приміщень, умови зберігання зазначених лікарських засобів повинні відповідати вимогам законодавства про обіг в Україні наркотичних засобів, психотропних речовин, їх аналогів і прекурсорів.
2.2.3.12. Стан приміщень аптек та їх відокремлених структурних підрозділів, технічного оснащення повинен відповідати санітарно-гігієнічним умовам, установленим для аптек.
2.2.3.13. Аптека повинна бути забезпечена Державною Фармакопеєю України, нормативно-технічними та нормативно-правовими документами, спеціальною довідковою літературою з питань приймання, контролю якості, зберігання, торгівлі лікарськими засобами.
2.2.3.14. Аптека повинна мати лікарські та інші засоби для надання долікарської медичної допомоги.
2.2.3.15. На фасаді аптеки та її відокремленого структурного підрозділу повинна бути відповідна вивіска із зазначенням назви суб’єкта господарювання та власника або уповноваженого ним органу. Біля входу до цього приміщення на видному місці розміщується інформація про режим роботи, адреса чергової та найближчої аптеки (структурного підрозділу).
У залі обслуговування населення повинна бути інформація про встановлений порядок лікарського забезпечення, додаткові послуги, що надаються аптекою.
2.3. Кваліфікаційні та інші вимоги до персоналу
2.3.1. Особи, які безпосередньо займаються виробництвом, оптовою і роздрібною торгівлею лікарськими засобами, повинні мати відповідну спеціальну освіту і відповідати єдиним кваліфікаційним вимогам.
Зазначені особи повинні мати:
а) диплом державного зразка про фармацевтичну освіту;
б) сертифікат про присвоєння (підтвердження) звання провізора загального профілю (для фахівців, які закінчили вищий учбовий заклад після 1992 року).
Особи з медичною освітою можуть займатися роздрібною торгівлею лікарськими засобами лише в аптечному пункті чи аптечному кіоску, які створені при фельдшерсько-акушерських пунктах у сільських населених пунктах.
2.3.2.Фахівці, які пройшли спеціальну підготовку в навчальних закладах іноземних країн, допускаються до професійної діяльності після перевірки їх кваліфікації.
2.3.3. Спеціалісти, які не працюють понад три роки за зазначеною у дипломі, сертифікаті (посвідченні) спеціальністю, можуть бути допущені до діяльності з виробництва лікарських засобів, оптової або роздрібної торгівлі лікарськими засобами тільки після проходження перепідготовки.
2.3.4. Аптека, аптечна база (склад) повинні бути вкомплектовані не менше ніж двома штатними спеціалістами, які мають відповідну спеціальну освіту і відповідають єдиним кваліфікаційним вимогам. Якщо аптеки здійснюють виробництво лікарських засобів, кількість зазначених штатних спеціалістів не може бути меншою трьох.
Посади завідувачів, заступників завідувачів аптеки, аптечної бази (складу) можуть заміщатися лише фахівцями з вищою фармацевтичною освітою (провізорами).
Не допускається займання посади завідувача аптеки, аптечної бази (складу) за сумісництвом.
2.3.5. Працівники аптек, аптечних баз (складів), підприємств — виробників лікарських засобів при прийманні на роботу проходять медичне обстеження, а надалі — періодичний медичний огляд згідно з діючими вимогами.
2.3.6. У суб’єкта господарювання повинні бути затверджені посадові інструкції для спеціалістів, діяльність яких безпосередньо пов’язана з виробництвом лікарських засобів, оптовою, роздрібною торгівлею лікарськими засобами, у яких викладені основні функції, професійні знання, компетенція та інші вимоги до працівників.
| Начальник управління ліцензування видів господарської діяльності Державного комітету України з питань регуляторної політики та підприємництва О.В. Єфремов |
Начальник управління акредитації та ліцензування Державного департаменту з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення С.І. Зброжек |
| Додаток 1 до пункту 1.8. Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами Державний департамент з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення |
ЗАЯВА
ПРО ВИДАЧУ ЛІЦЕНЗІЇ
Заявник _________________________________________________________
(найменування, місцезнаходження юридичної особи)
_________________________________________________________________
(прізвище, ім’я, по батькові керівника юридичної особи)
_________________________________________________________________
(прізвище, ім’я, по батькові громадянина-підприємця)
_________________________________________________________________
(серія, номер паспорта, ким і коли виданий, місце проживання)
номер телефону ____________________________________________________,
організаційно-правова форма _________________________________________,
ідентифікаційний код юридичної особи _________________________________,
ідентифікаційний номер фізичної особи – платника податків та інших обов’язкових платежів
___________________________________________________________________,
розрахунковий рахунок №_________________________ у __________________,
валютний рахунок № ____________________________ у___________________ .
Прошу видати ліцензію на провадження такого виду діяльності (потрібне підкреслити):
• виробництво лікарських засобів;
• оптова торгівля лікарськими засобами;
• роздрібна торгівля лікарськими засобами.
Місце провадження діяльності:
Аптечний склад __________________________________________________
(адреса місця провадження діяльності)
Аптека __________________________________________________________
(адреса місця провадження діяльності)
Аптечний пункт __________________________________________________
(адреса місця провадження діяльності)
Аптечний кіоск __________________________________________________
(адреса місця провадження діяльності)
З порядком отримання ліцензії ознайомлений. Ліцензійним умовам провадження господарської діяльності відповідаю і зобов’язуюсь їх виконувати.
| Підпис заявника | ____________________________________ | Розшифрування підпису |
«____»_____________200__ р.
М.П.
| Дата і номер реєстрації заяви «____» ______ 200__р. №___________ _____________________________ ________________ _____________ (посада особи, яка прийняла заяву) (підпис) (прізвище) |
| Додаток 2 до пункту 1.9. Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами Державний департамент з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення |
ОПИС №_____
ДОКУМЕНТІВ, ЩО ДОДАЮТЬСЯ ДО ЗАЯВИ НА ОДЕРЖАННЯ ЛІЦЕНЗІЇ
на провадження ____________________________________________________
(вид діяльності)
від _______________________________________________________________
(назва суб’єкта господарювання)
Дата і номер реєстрації заяви «_____»____________200__р. №_____________
| № з/п | Найменування документа | Кількість аркушів у документі | Відмітки про наявність документів (наявні, відсутні) |
Примітки |
| 1 | 2 | 3 | 4 | 5 |
Прийняв ____________________ документів
(цифрами і літерами)
| Дата «____»__________ 200__р. | Підпис відповідальної особи | Розшифрування підпису |
Копію опису отримав
| Дата «____»__________ 200__р. | Підпис представника суб’єкта | Розшифрування підпису |
| Відмітка про дату прийняття документів, що підтверджують унесення заявником плати за видачу ліцензії
|
| Додаток 3 до пункту 1.18. Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами |
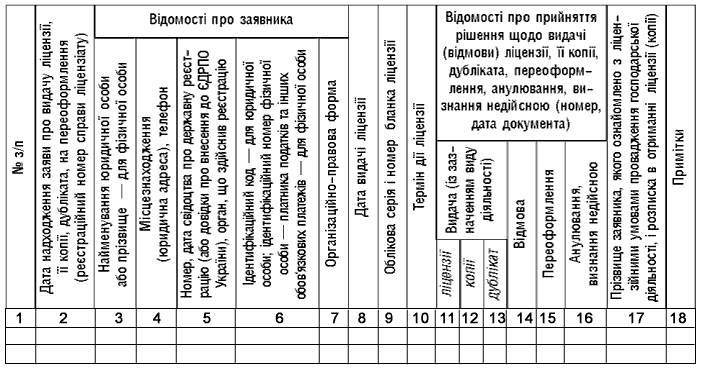
ЖУРНАЛ
ОБЛІКУ ЗАЯВ ТА ВИДАНИХ ЛІЦЕНЗІЙ СУБ‘ЄКТАМ ГОСПОДАРЮВАННЯ
на провадження ____________________________________________________
(вид діяльності, на який видається ліцензія)
| Додаток 4 до пункту 1.20. Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами Державний департамент з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення |
ЗАЯВА
ПРО ВИДАЧУ КОПІЇ ЛІЦЕНЗІЇ
____________________________________________________________________
(найменування, ідентифікаційний код органу, який видав ліцензію)
Заявник _____________________________________________________________
(найменування, місцезнаходження юридичної особи)
____________________________________________________________________
(прізвище, ім’я та по батькові керівника юридичної особи)
____________________________________________________________________
(прізвище, ім’я та по батькові громадянина-підприємця, місце проживання)
____________________________________________________________________,
ідентифікаційний номер фізичної особи — платника податків та інших обов’язкових платежів
____________________________________________________________________,
ідентифікаційний код __________________________________________________,
вид підприємницької діяльності, на яку було видано ліцензію,_________________
____________________________________________________________________,
реєстраційний номер ліцензії___________________________________________,
термін дії ліцензії _____________________________________________________.
Прошу видати копію ліцензії у зв’язку зі створенням нового (их) відокремленого (их) підрозділу (ів), а саме:
| Назва відокремленого (их) підрозділу (ів) /аптечна база (склад), аптека, апт. пункт чи апт. кіоск із зазначенням аптеки, якій вони підпорядковуються/ | Адреса, місця провадження діяльності |
Перелік документів, що підтверджують створення нового (их) відокремленого (их) підрозділу (ів) (додається): __________________________________________________________________________
| Підпис заявника | ____________________________________ | Розшифрування підпису |
«____»_____________200_ р.
М.П.
| Дата і номер реєстрації заяви «____» ______ 200__р. №___________ _____________________________ ________________ _____________ (посада особи, яка прийняла заяву) (підпис) (прізвище) |
| Додаток 5 до пункту 1.24. Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами Державний департамент з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення |
ЗАЯВА
ПРО ПЕРЕОФОРМЛЕННЯ ЛІЦЕНЗІЇ
__________________________________________________________________________
(найменування, ідентифікаційний код органу, який видав ліцензію)
Заявник__________________________________________________________________
(найменування, місцезнаходження юридичної особи)
__________________________________________________________________________
(прізвище, ім’я та по батькові керівника юридичної особи)
__________________________________________________________________________
(прізвище, ім’я та по батькові громадянина-підприємця, місце проживання)
__________________________________________________________________________,
ідентифікаційний номер фізичної особи — платника податків та інших обов’язкових платежів ,
ідентифікаційний код ________________________________________________________,
вид підприємницької діяльності, на яку було видано ліцензію,_______________________
___________________________________________________________________________,
реєстраційний номер ліцензії __________________________________________________,
термін дії ліцензії _____________________________________________________________.
Прошу переоформити ліцензію у зв’язку з _____________________________________
(зазначити причини)
Перелік документів, що підтверджують зміни, які підлягають унесенню до ліцензії (додається): __________________________________________________________________________
| Підпис заявника | ____________________________________ | Розшифрування підпису |
«____»_____________200_ р.
М.П.
| Дата і номер реєстрації заяви «____» ______ 200__р. №___________ _____________________________ ________________ _____________ (посада особи, яка прийняла заяву) (підпис) (прізвище) |
| Додаток 6 до пункту 1.26. Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами Державний департамент з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення |
ЗАЯВА
ПРО ВИДАЧУ ДУБЛІКА ТА ЛІЦЕНЗІЇ
__________________________________________________________________________
(найменування, ідентифікаційний код органу, який видав ліцензію)
Заявник__________________________________________________________________
(найменування, місцезнаходження юридичної особи)
__________________________________________________________________________
(прізвище, ім’я та по батькові керівника юридичної особи)
__________________________________________________________________________
(прізвище, ім’я та по батькові громадянина-підприємця, місце проживання)
__________________________________________________________________________,
ідентифікаційний номер фізичної особи — платника податків та інших обов’язкових платежів ,
ідентифікаційний код ________________________________________________________,
вид підприємницької діяльності, на яку було видано ліцензію,_______________________
___________________________________________________________________________,
реєстраційний номер ліцензії __________________________________________________,
термін дії ліцензії _____________________________________________________________.
Прошу видати дублікат ліцензії у зв’язку з ______________________________________
(зазначити причину: втрата ліцензії або пошкодження ліцензії)
До заяви додаються: __________________________________________________________
(указати: документ, що підтверджує внесення плати
___________________________________________________________________________
за видачу дубліката ліцензії, не придатна для користування ліцензія)
| Підпис заявника | ____________________________________ | Розшифрування підпису |
«____»_____________200_ р.
М.П.
| Дата і номер реєстрації заяви «____» ______200__р. №___________ _____________________________ ________________ _____________ (посада особи, яка прийняла заяву) (підпис) (прізвище) |

Коментарі