26 січня 2001 року в Міністерстві охорони здоров’я (МОЗ) України відбулась підсумкова колегія Державного департаменту з контролю за якістю, безпекою і виробництвом лікарських засобів та виробів медичного призначення (Державного департаменту), присвячена діяльності фармацевтичного сектора в Україні. У роботі колегії брали участь віце-прем’єр-міністр України Микола Жулинський, міністр охорони здоров’я Віталій Москаленко, заступник міністра охорони здоров’я, голова Державного департаменту Олександр Коротко. З доповідями про стан справ у фармацевтичній промисловості і на вітчизняному ринку лікарських засобів виступили відповідальні працівники та провідні спеціалісти МОЗ.
Нижче наведені основні положення доповіді Олександра Коротка.
УТВОРЕННЯ ДЕРЖАВНОГО ДЕПАРТАМЕНТУ МАЛО СЕРЙОЗНІ ПІДСТАВИ
На початку своєї доповіді О. Коротко зазначив, що створення Державного департаменту було зумовлене дією відцентрових сил, що розривали фармацевтичну сферу.
|
Перш за все, давалася взнаки невідповідність сучасним вимогам законодавчої та нормативної бази. Функції контролю за виробництвом лікарських засобів, медичної техніки та виробів медичного призначення були розпорошені і дублювалися, стосунки між державою і виробником, державою і ринком залишалися не врегульованими. Не було чіткої, послідовної, прозорої системи реєстрації лікарських засобів. Органи реєстрації багаторазово змінювалися, експертні установи здійснювали як науково-експертні, так і контрольно-дозвільні функції, не існувало єдиних вимог до атестації та акредитації уповноважених лабораторій. Підприємці не встигали відслідковувати, яких стандартів слід дотримуватися, щоб бути атестованими та акредитованими, не реалізовувався принцип державної підтримки вітчизняного виробника, недостатньо жорстко ставилося питання про раціональне використання бюджетних коштів, спрямування їх на закупівлю української продукції, наприклад у ситуації з вітчизняним інсуліном, вакцинами, протитуберкульозими препаратами.
Експертні установи діяли з порушенням основних положень закону України «Про наукову та науково-технічну експертизу», в тому числі принципу незалежності та об’єктивності. Заявники змушені були самостійно вирішувати питання, пов’язані з організацією випробувань, домовлятися з базами та екпертами. Існували умови для протизаконної діяльності щодо надання одноразових дозволів не лише на ввезення на митну територію України незареєстрованої медичної техніки та виробів медичного призначення, а й їх застосування в медичній практиці. Широко практикувалося внесення до Державного реєстру медичної техніки цілих груп виробів медичного призначення, що сприяло надходженню в країну під однією загальною назвою незареєстрованих виробів, їх модифікацій тощо, а Комітет з нової медичної техніки, виконуючи функції, покладені на центральний орган виконавчої влади — МОЗ, фактично займався підприємницькою діяльністю.
Не виконувалася норма закону України «Про лікарські засоби», згідно з якою забороняється ввезення в країну незареєстрованих ліків. Це підривало внутрішній ринок, фінансовий стан вітчизняних фармацевтичних підприємств, завдавало збитків державі, а головне — не забезпечувало безпеку здоров’я громадян, що є порушенням конституційного права на охорону здоров’я.
Внаслідок відсутності державного контролю, невпорядкованості нормативної бази, формального підходу до ліцензування почалося стихійне формування аптечної мережі. Поряд з цим до сьогодні існує тенденція до посилення регулювання продажу лікарських засобів і виробів медичного призначення на регіональному рівні з боку місцевих органів управління. Це відбувається шляхом створення структур, подібних до обласних фармацевтичних управлінь, що існували раніше. По суті, ці структури відповідно до чинного законодавства є такими ж суб’єктами господарської діяльності, як і аптеки. Водночас фармацевтичні управління та подібні їм створені в регіонах інституції наділяються контролюючими та дозвільними функціями, визначають відповідні правила ціноутворення на продукцію, яка реалізується через аптеки, що суперечить чинному законодавству. Всі аптеки створюються з метою надання відповідних специфічних послуг населенню, отримання прибутку та введення додаткових робочих місць. Ціноутворення в ринкових умовах залежить не від форми власності підприємства, а від державної політики в сфері забезпечення лікарськими засобами та виробами медичного призначення. Отже, на регіональному рівні ця політика має не визначатися, а реалізовуватися.
Зазначені проблеми не мали можливості самостійно вирішити ні Нацагентство, ні Держкоммедбіопром, ні Комітет з нової медичної техніки. Причина ясна — при визначенні їх статусу не був закладений системний підхід до формування та подальшого цивілізованого розвитку фармацевтичного сектора. Вперше він був викладений в Положенні про Державний департамент.
ІНФОРМАЦІЯ ПОТРІБНА ВСІМ
О. Коротко відзначив, що налагодження інформаційного забезпечення дозволить вирішувати назрілі проблеми на зовсім іншому рівні. І не в останню чергу — проблеми молодих кадрів. Перший крок в цьому напрямі вже зроблено: міністр охорони здоров’я підписав наказ «Про інформаційно-аналітичне забезпечення фармацевтичної діяльності в Україні», в якому чітко окреслені завдання на поточний і наступні роки. Наказ «Про створення єдиної бази даних зареєстрованих в Україні лікарських засобів» став логічним продовженням відміни подвійного ліцензування імпорту лікарських засобів. Йдеться про створення прозорої, зрозумілої, зручної для наших та іноземних підприємців процедури ввезення імпортних ліків, що передбачає надання дозволу безпосередньо на митниці, в режимі on-line.
З метою створення єдиної міжвідомчої бази даних, інтегрованої в систему митного оформлення вантажів наказом міністра охорони здоров’я створено робочу групу, до складу якої увійшли представники міністерств, державних комітетів, експертних установ, фармацевтичних асоціацій, співробітники МОЗ та Державного департаменту. Окремо працює і група фахівців Державного департаменту та Державної митної служби. На виконання наказу міністра Державний департамент розробив пропозиції щодо створення Інформаційного центру.
Для успішного завершення цього процесу необхідна організаційна та матеріально-технічна підтримка. Організаційна підтримка — це створення окремої структури в Державному департаменті — відділу державних реєстрів, інформаційного забезпечення та прогнозування ринку, матеріально-технічна — оснащення департаменту сучасними засобами зв’язку, відповідною технікою, ліцензованим програмним забезпеченням.
На черзі — подальша гармонізація національної нормативної бази у сфері фармацевтичного сектора з вимогами Європейського Союзу (ЄС).
Як стверджує О. Коротко, найголовніші зусилля Державного департаменту були спрямовані на приведення нормативної бази фармацевтичного сектора у відповідність з такою ЄС.
Кабінет Міністрів і Міністерство охорони здоров’я України видали низку постанов та наказів, в результаті чого створені умови для:
— відміни подвійного ліцензування імпорту лікарських засобів та ліцензування вантажів;
— спрощення порядку ввезення лікарських засобів;
— визначення переліку підприємств, які мають стратегічне значення для економіки та безпеки держави, започатковано моніторинг результатів фінансово-господарської діяльності кожного з них незалежно від форми власності, який проводиться в автоматизованному режимі;
— розроблення Державної Фармакопеї України;
— внесення змін до переліку лікарських засобів, які можна закуповувати за бюджетні кошти;
— створення інспекції з належної виробничої практики, яка виконуватиме на території України ті ж функції, що й GMP-інспекції у країнах ЄС.
Внесено зміни та доповнення до Галузевого стандарту України «Графічне оформлення лікарських засобів. Загальні вимоги».
ПРИРІСТ ВИРОБНИЦТВА ЛІКІВ Є, АЛЕ ВІН НЕДОСТАТНІЙ
За оцінкою ВООЗ, у країні з населенням 50 млн чоловік обсяг фармацевтичного ринку повинен становити 3 млрд доларів США. За словами ж О. Коротка, обсяг українського ринку ліків нині складає 490 млн доларів. Це є свідченням як низької платоспроможності населення, так і недостатньої бюджетної підтримки закупівель лікарських засобів, тобто відсутності замовлення на ліки для державних потреб.
На сьогодні частка вітчизняних медикаментів на фармацевтичному ринку України у вартісному виразі перевищує 40% (у 1991 році — 20%).
Готові лікарські засоби виробляють 180 українських підприємств, з них 22 є традиційними виробниками і Постановою Кабінету Міністрів визнані як такі, що мають стратегічне значення для економіки та безпеки держави. Частка виробленої ними продукції на внутрішньому ринку сягає 85%, а питома вага 5 виробників («Фармацевтична фірма «Дарниця», «Фармак», «Київмедпрепарат», «Борщагівський хіміко-фармацевтичний завод», «Здоров’я») перевищує 56,5%.
Особливої уваги заслуговують підсумки роботи новоствореного підприємства «Індар», де за 2000 рік вироблено продукції на суму більше 82 млн грн. За цим показником завод посідає 6-те місце в галузі.
Між тим, практика закупівель імпортних ліків за державні кошти зводить нанівець всі зусилля вітчизняних виробників. Тому життєво необхідним як для «Індару», так і для інших українських підприємств є запровадження системи державного замовлення!
Слід відзначити позитивну динаміку розвитку хіміко-фармацевтичної промисловості за роки існування незалежної України. Так, якщо у 1999 році у вартісному виразі було відновлено рівень виробництва 1991 року, то у 2000 — його перевищено на 30% (малюнок).
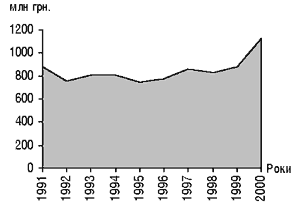
Малюнок. Динаміка обсягів виробництва підприємств хіміко-фармацевтичної промисловості у 1991–2000 рр. за даними Державного департаменту
За даними Держкомстату, на кінець 2000 року частка медичної і мікробіологічної промисловості в загальнодержавному обсязі промислового виробництва збільшилася з 0,8 до 1,1% (таблиця). Якщо обсяг промислового виробництва в країні в цілому (в порівняних цінах) збільшився на 13%, то у медичній промисловості — на 29%.
Таблиця 1
Частка медичної та мікробіологічної промисловості в загальнодержавному обсязі промислового виробництва в 2000 р. за даними Державного департаменту (%)
|
Частка у загальнодержавному промисловому виробництві за станом на 01.01.2001 р. |
Темпи приросту/зниження (-) (у порівняних цінах), з 2000 р. до 1999 р. |
|
| Промисловість України |
100 |
12,9 |
| Медична промисловість
в тому числі:
|
1,1 1,0 0,01 0,1 |
28,8 28,9 52,9 23,7 |
| Мікробіологічна промисловість |
0,03 |
-17,5 |
НЕОБХІДНА ПІДТРИМКА ВІТЧИЗНЯНОЇ НАУКИ ТА ВІТЧИЗНЯНОГО ВИРОБНИКА
Запорукою успішного розвитку фармацевтичної галузі є наукоємні технології та фінансові інвестиції.
В Україні є унікальний науковий заклад, єдиний на теренах колишнього Радянського Союзу, який спеціалізується на розробці лікарських препаратів: Державний науковий центр лікарських засобів. Не слід нехтувати тим, що саме в Харкові вперше в Україні була розроблена система контролю імпортних субстанцій, яка й досі є найкращою в Україні, гармонізовані з країнами СНД вимоги до якості ліків, розроблена нормативна база для прискореного створення генеричних препаратів. Тобто Україна має винятковий науковий потенціал, треба лише навчитися раціонально його використовувати в умовах ринкової економіки.
Як відомо, нестабільність економічної політики негативно відбивається на стані науки в державі. Проблеми з фінансуванням наукових досліджень добре відомі. Необхідно зазначити, що не останню роль в цьому відіграють самі ж вітчизняні виробники. Відсутня спільна мотивація науковців і виробничників, і тут першим кроком може бути віднесення видатків на наукові дослідження до собівартості ліків, що значно спростило б проблеми фінансування та впровадження наукових розробок.
Треба раціонально використовувати існуючі кошти для вдосконалення організації наукових досліджень, запобігання їх дублювання. Корисною була б і міжвідомча координація дій на основі угоди між Національною академією наук, Міністерством у справах науки і технологій та МОЗ про єдину державну науково-технічну політику в сфері розробки нових лікарських засобів.
До речі, в розвинених країнах створення оригінального препарату коштує 250–300 млн доларів США. Свідоцтвом дефіциту впровадження інновацій у вітчизняну фармацевтичну та медичну промисловість є те, що в останні 2 роки у виробництво впроваджено лише 10 оригінальних препаратів.
Корінна вада взаємодії науки та виробництва полягає в розрізненості зусиль не тільки на стадії вирішення завдань, але й на етапі формулювання проблеми. Спільна діяльність позначена відсутністю системного підходу до розкриття проблем, що завжди було притаманно науці. На сьогодні наука працює сама по собі, лікарі — самі по собі, підприємства — на кінцевий результат. Відсутній прогностичний підхід, розрахунок очікувань ринку. І подібний стан вже стає загрозливим.
Систематичне недофінансування наукових розробок, нераціональний розподіл бюджетних коштів фактично призвели до паралічу мікробіологічної науки.
Україна сьогодні практично втратила технології використання мікробіологічного синтезу субстанцій для виробництва протипухлинних та противірусних препаратів. На цьому фоні вражає стан справ в Інституті мікробіології і вірусології ім. Д.К. Заболотного. Завдяки вченим цього закладу Україна є одним із лідерів у світі з розробки та вивчення механізму дії і впровадження принципово нових пробіотиків на основі аеробних спороутворювальних бактерій. За останні роки інститут продав зарубіжним компаніям (Данія, Нідерланди, Південно-Африканська Республіка, Росія) 5 ліцензій на загальну суму близько 2 млн доларів США. Серед них ліцензія на виробництво пробіотика Біоспорин, геролакту, препаратів бета-каротину та інших. Лише одна фірма, що випускає за ліцензією інституту геролакт, виробила його на суму більше 500 млн доларів. Надзвичайно прикро, що такі пріоритетні розробки проходять повз вітчизняного виробника, а прибутки від їх впровадження оминають Україну, не кажучи вже про недоотримані робочі місця і втрачений ресурс поліпшення здоров’я населення. Тому так потрібна державна програма реальної підтримки вітчизняної науки.
Між іншим, Комплексною програмою розвитку медичної промисловості на 1997–2003 роки було передбачено освоєння виробництва 233 найменувань лікарських засобів майже всіх фармакологічних груп, що вимагало фінансування в обсязі 49,7 млн грн. Всього ж за 4 роки з бюджету отримано 5,3 млн грн., або лише 10,7 % від запланованого.
Та й за відсутності бюджетних коштів деякі підприємства: БХФЗ, «Інтерхім», «Фармак», «Концерн «Стирол» все ж організували наукові центри з розробки та впровадження лікарських препаратів.
Так, в минулому році за власні кошти підприємств розроблено та налагоджено випуск 90 препаратів, з яких 37 — вперше в Україні. Переважна їх більшість — генеричні, які коштують дешевше, ніж імпортні аналоги. До речі, не слід забувати, що освоєння нових для України ефективних генериків є безсумнівно перспективним з точки зору довготривалого розвитку галузі. Про це свідчить і світова тенденція до збільшення їх частки в асортименті продукції провідних концернів — основних виробників оригінальних патентованих препаратів. Якщо обсяг світового ринку генериків у 1998 році становив 27 млрд доларів США, то в 2003 році, за прогнозами фахівців, він сягне 43,5 млрд доларів.
Життєво необхідні ліки потребують особливої уваги, що в даному випадку передбачає обов’язкове державне замовлення, якого, на жаль, на сьогодні немає. Тут не завадило б повчитися у російських колег. Наприклад, корпорація «ICN Октябрь», впровадивши у виробництво в 2000 році 30 нових генериків, 8 з них постачає за держзамовленням.
Ще один ефективний шлях піднесення економіки фармацевтичної галузі — стимулювання виробництва, орієнтованого на експорт. У минулому році обсяг експорту збільшився майже на 22%, сягнувши 40 млн доларів США. Але досягнуті результати нас не можуть задовольнити. Тому завдання на 2001 рік — досягнення обсягів експорту української фармацевтичної продукції рівня 1998 року, а це — 60,5 млн доларів США.
В свою чергу, розвиток експорту стане можливим лише за умови відповідності виробничих потужностей міжнародним стандартам. Для цього необхідно, по-перше, привести виробництво у відповідність до стандартів GMP, що вимагає значних матеріальних витрат (в розрахунку на 1 виробництво в середньому від 10 до 100 млн доларів). На сьогодні джерелом фінансування технічного переоснащення залишається власний прибуток підприємств. Наприклад, уряд Російської Федерації вжив певних заходів для підтримки свого внутрішнього ринку ще в 1996 році, звільнивши російських виробників від сплати податку на прибуток від реалізованих життєво необхідних ліків, які складають 60% від загального обсягу виробництва; податку на додану вартість на сировину, комплектуючі тощо; від штрафних санкцій за неповернення валюти у термін до 120 днів; ввів державну реєстрацію цін на лікарські засоби.
Держдепартамент вже розробив аналогічні пропозиції для внесення їх до Податкового кодексу України.
По-друге, важливим фактором відповідності міжнародним стандартам є фахова підготовка кадрів. У рамках програми TACIS створено та обладнано за європейським рівнем навчальний центр GMP/GDP, в якому фахову підготовку з норм Належної виробничої практики пройшли спеціалісти Державного департаменту та експертних установ.
Наступний щабель — створення компетентної уповноваженої установи, яка б займалася сертифікацією виробників та дистриб’юторів на відповідність нормам забезпечення якості фармацевтичної продукції. І в цьому ми знаходимо розуміння з боку ЄС. Надзвичайно жорстка конкуренція на фармацевтичних ринках країн ЄС, наявність технічних бар’єрів, висока вартість реєстрації препаратів (в Росії — до 40 тис. доларів США), витрати на просування ліків на ринок — все це в найближчі 4–5 років створюватиме значні труднощі щодо експорту вітчизняної фармацевтичної продукції. Для їх подолання, зокрема, потрібна професійно організована, міцна дистриб’юторська мережа з чітко встановленими стандартами діяльності.
ДЕПАРТАМЕНТ БУДЕ РОЗВИВАТИСЬ
На закінчення своєї доповіді О. Коротко відзначив, що успішне вирішення завдань, які стоять перед Державним департаментом, багато в чому залежить від його структурування. Організаційна структура повинна забезпечувати виконання покладених на департамент функцій, а отже, відповідати сучасним вимогам щодо інформаційного забезпечення, зокрема організовувати чітко спрямовані інформаційні потоки. Тож відсутність в організаційній структурі департаменту таких підрозділів, як економічний, інформаційно-прогностичний та юридичний, обумовлює недостатню функціональну впорядкованість процесу державного управління фармацевтичною галуззю.
З метою вирішення цієї проблеми в межах загальної штатної чисельності було б доцільно внести наступні зміни до структури Державного департаменту: створити юридичний відділ, відділ економіки, відділ державних реєстрів, а також відділ інформаційного забезпечення та прогнозування ринку.
Внаслідок прийняття таких управлінських рішень буде систематизовано інформаційні потоки, а це, у свою чергу, дозволить запровадити сучасну автоматизовану систему інформаційного забезпечення на кожному робочому місці з нормальним виходом на зовнішні інформаційні зв’язки з експертними та регіональними структурами.
Тарас Махринський
Фото Євгена Кривші
ДОДАТКОВА ІНФОРМАЦІЯ
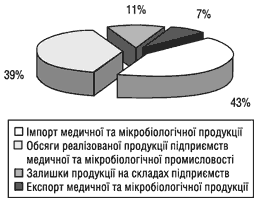
Розподіл ринку медичної та мікробіологічної промисловості в 2000 р. за даними Державного департаменту
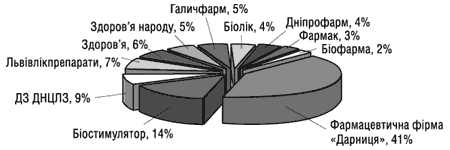
Частка українських підприємств у обсязі виробництва лікарських засобів в ампулах за даними Державного департаменту
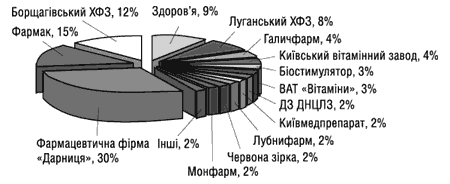
Частка українських підприємств у обсязі виробництва лікарських засобів у формі таблеток в упаковках за даними Державного департаменту
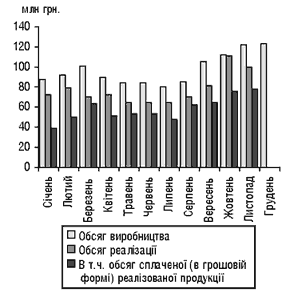
Помісячна динаміка обсягів виробництва та реалізації продукції хіміко-фармацевтичних підприємств за 2000 р. за даними Державного департаменту
Таблиця
Кількість ліцензій на провадження господарської діяльності з виробництва лікарських засобів, оптової та роздрібної торгівлі лікарськими засобами, які діють в Україні, за станом на 31.12.2000 р. за даними Державного департаменту
|
№ з/п |
Регіон |
Кількість ліцензій на |
Всього |
||
|
оптову реалізацію |
роздрібну реалізацію |
виготовлення ліків в умовах аптеки |
|||
|
1 |
Вінницька |
27 |
152 |
21 |
200 |
|
2 |
Волинська |
13 |
69 |
15 |
97 |
|
3 |
Дніпропетровська |
181 |
432 |
39 |
652 |
|
4 |
Донецька |
146 |
469 |
69 |
684 |
|
5 |
Житомирська |
36 |
85 |
34 |
155 |
|
6 |
Закарпатська |
14 |
59 |
11 |
84 |
|
7 |
Запорізька |
55 |
141 |
39 |
235 |
|
8 |
Івано-Франківська |
27 |
88 |
18 |
133 |
|
9 |
Київська |
188 |
179 |
44 |
411 |
|
10 |
Кіровоградська |
26 |
76 |
20 |
122 |
|
11 |
Кримська |
79 |
123 |
12 |
214 |
|
12 |
Луганська |
44 |
97 |
1 |
142 |
|
13 |
Львівська |
105 |
263 |
79 |
447 |
|
14 |
Миколаївська |
16 |
69 |
42 |
127 |
|
15 |
Одеська |
81 |
139 |
9 |
229 |
|
16 |
Полтавська |
36 |
142 |
46 |
224 |
|
17 |
Рівненська |
18 |
40 |
14 |
72 |
|
18 |
Сумська |
32 |
51 |
34 |
117 |
|
19 |
Тернопільська |
17 |
87 |
26 |
130 |
|
20 |
Харківська |
240 |
472 |
52 |
764 |
|
21 |
Херсонська |
36 |
63 |
31 |
130 |
|
22 |
Хмельницька |
19 |
103 |
14 |
136 |
|
23 |
Черкаська |
29 |
98 |
35 |
162 |
|
24 |
Чернівецька |
7 |
99 |
14 |
120 |
|
25 |
Чернігівська |
17 |
34 |
14 |
65 |
|
26 |
м. Київ |
532 |
801 |
85 |
1418 |
|
27 |
м. Севастополь |
13 |
24 |
0 |
37 |
| Всього |
2034 |
4455 |
818 |
7307 |
|


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим