Проведение клинических испытаний принципиально новых, ранее не применявшихся лекарственных средств, а также генерических препаратов сопряжено с рядом вопросов этического характера. Они обусловлены тем, что субъектом изучения является человек. Допустимы ли клинические эксперименты на людях, и если да, то каковы должны быть ограничения и условия для их проведения? Что следует считать экспериментом в клинике? Как снизить возможный риск для пациента, обеспечить условия конфиденциальности? Как проводить испытания генерических препаратов на здоровых добровольцах? Как избежать возможных злоупотреблений при проведении научных исследований?
Проведение испытаний нового лекарственного средства или метода лечения на людях необходимо для предотвращения развития возможных опасных побочных реакций в процессе применения препарата. Для этого проводят многоцентровые клинические испытания, а в ряде случаев и межнациональные исследования. При этом также возникают проблемы этического характера, например, как правильно организовать рандомизированные исследования с учетом особенностей законодательства и социальных условий разных стран, а также соблюсти и защитить права лиц, принимавших в них участие? Эти и многие другие этические, юридические и социальные проблемы требуют внимания и обсуждаются во всем мире.
Предлагаем вниманию читателей материалы доклада члена-корреспондента АМН Украины, профессора, доктора биологических наук Александра Стефанова и профессора, доктора медицинских наук Владимира Мальцева, который прозвучал на I Национальном конгрессе по биоэтике, состоявшемся 17 – 20 сентября текущего в Киеве.
ЭТИЧЕСКИЕ КОМИТЕТЫ — ЧТО ЭТО ТАКОЕ?
По определению, принятому в Европе (Good Clinical Practice for trials on medical products in European Community (III/3976/-EN, July 1991), этические комитеты (ЭК) — это независимые организации, в состав которых входят профессиональные медики и лица немедицинских специальностей, несущие ответственность за обеспечение защиты прав и здоровья людей, участвующие в исследовании, и гарантирующие такую защиту для общества в целом.
В Украине за последние 5 лет проведено более 900 клинических испытаний (рис. 1), их количество за последние два года представлено на рис. 2. Клинические исследования проводили по сокращенной и полной программам. Постоянно увеличивается количество проводимых международных многоцентровых исследований, в связи с чем появляется все больше проблем биоэтического характера. Для участия в многоцентровых исследованиях необходима гармонизация регуляторных, в том числе этических, требований с международными стандартами.
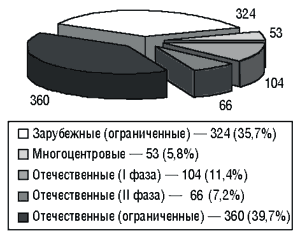
Рис. 1. Количество рассмотренных материалов клинических исследований за период 1996–2000 гг. (всего 907)
 ?
? 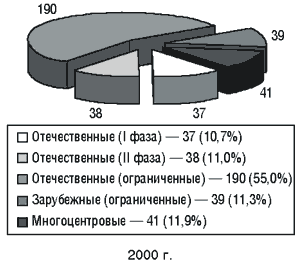
Рис. 2. Количество рассмотренных материалов клинических исследований за 1999–2000 гг.
Деятельность по контролю за соблюдением прав человека при проведении клинических исследований осуществляют независимые ЭК (НЭК). Их участие в подготовке и проведении клинических исследований — непременное условие, которое следует строго выполнять.
Регламенту работы НЭК и вопросам, решение которых находится в их компетенции, уделяют большое внимание многие международные и общественные организации. Базовым документом для создания и функционирования НЭК признан ICH (International Conference on Harmonisation — Международная конференция по гармонизации) — GCP (Good Clinical Practice — Надлежащая клиническая практика), в котором определены основные направления работы ЭК, включающие выполнение следующих процедур:
-
учреждение ЭК;
-
предоставление заявок на рассмотрение;
-
экспертиза;
-
принятие решения о проведении клинического исследования;
-
контроль проведения клинического исследования.
Законодательство и социальные условия в разных странах постоянно изменяются, вводится в действие ряд новых законов. В основном это касается стран Центральной и Восточной Европы. Для участия в международных кооперативных клинических исследованиях местные регуляторные требования необходимо привести в соответствие с регламентом Международной конференции по гармонизации, учесть рекомендации ВОЗ, Европейского этического комитета и рабочей группы по этике Европейского форума по GCP.
БИОЭТИКА И ПРАВО
Вопросы этики и права при проведении биомедицинских исследований взаимосвязаны и их следует рассматривать совместно. Этика распространяется не только на совокупность всех прав пациента, но само понятие «этика» намного шире понятия «право». Если для соблюдения права достаточно строго следовать определенным правилам, то этика требует от врача порядочности, честности, бескорыстия в самом широком смысле слова, а это не может быть регламентировано никаким законом. Этика накладывает определенные обязательства на врача, а пациентам предоставляет гарантии безопасности еще до того, как они будут юридически сформулированы и закреплены законом. Путь развития международного права в области защиты прав человека вообще и в медицинской сфере в частности достаточно долгий. Существует ряд аспектов взаимоотношения врач — пациент, правовая регуляция которых еще не разработана. В этом случае высокие этические принципы, лежащие в основе действий врача, который участвует в проведении клинических испытаний, должны сыграть решающую роль.
Основные этические и правовые принципы сформулированы в Хельсинской декларации Всемирной ассоциации врачей (принятой 18-й Генеральной Ассамблеей Всемирной ассоциации врачей, Хельсинки, Финляндия, июнь 1964 г.).
|
Хельсинская декларация Всемирной ассоциации врачей легла в основу всех последующих рекомендаций и законодательных актов, определяющих права человека и этические обязательства, которые принимают на себя врачи при проведении клинических исследований. Следует подчеркнуть, что изложенные в Хельсинской декларации принципы являются только рекомендательными положениями, но не освобождают врачей от уголовной и гражданской ответственности, предусмотренной национальным законодательством. Все основные документы, разрабатываемые на основе Хельсинской декларации авторитетными международными организациями, должны быть отражены в национальном законодательстве, которое в свою очередь должно предусматривать возможность независимого общественного контроля за соблюдением прав человека при планировании и проведении клинических испытаний.
|
НАЦИОНАЛЬНОЕ ЗАКОНОДАТЕЛЬСТВО О КЛИНИЧЕСКИХ ИСПЫТАНИЯХ
В украинском законодательстве правовые и этические вопросы при проведении клинических испытаний рассматриваются в статьях 7 и 8 закона Украины «О лекарственных средствах»; в «Инструкции о проведении клинических испытаний лекарственных средств и экспертизе материалов клинических исследований», утвержденной МЗ Украины (приказ № 281 от 01.11.2000 г.); в «Типовом положении о комиссии по вопросам этики», утвержденном МЗ Украины (приказ № 281 от 01.11.2000 г.); в «Методических рекомендациях по клиническому испытанию лекарственных средств в Украине» (1999 г.). Так, в статье 7 закона Украины «О лекарственных средствах», в частности, говорится, что клинические исследования лекарственных средств проводятся после обязательной оценки этических и морально-правовых аспектов программы клинического исследования комиссиями по вопросам этики, которые созданы и действуют при лечебно-профилактических учреждениях, проводящих клинические испытания. Положение о комиссии по вопросам этики утверждается МЗ Украины или уполномоченным им органом.
|
Статья 8 закона Украины «О лекарственных средствах» полностью посвящена защите прав пациента (добровольца). В ней отмечено, что клинические исследования лекарственных средств проводятся при наличии письменного согласия пациента (добровольца) на участие в проведении клинического исследования или письменного согласия его законного представителя на проведение клинического исследования с участием несовершеннолетнего или недееспособного пациента. Пациент (доброволец) или его законный представитель должен получить информацию о сути и возможных последствиях исследования, о свойствах лекарственного средства, ожидаемой эффективности, степени риска. Заказчик клинического исследования лекарственного средства обязан составить договор о страховании жизни и здоровья пациента (добровольца) в порядке, предусмотренном действующим в данной стране законодательством. Руководитель клинического исследования обязан остановить проведение клинического исследования или отдельные его этапы в случае возникновения угрозы здоровью или жизни пациента (добровольца) вследствие проведения исследования, а также по желанию пациента (добровольца) или его законного представителя. Решение о приостановке клинического испытания лекарственного средства или отдельных его этапов в случае возникновения угрозы здоровью или жизни пациента (добровольца) вследствие проведения исследования, а также в случае отсутствия или недостаточной эффективности действия лекарственного средства, нарушения этических норм принимает МЗ Украины или уполномоченный им орган.
В Украине в 1995 г. при Государственном фармакологическом комитете МЗ (далее — ГФЦ) была создана Этическая комиссия (далее — Комиссия). Ее работа регламентируется Положением о комиссии по вопросам этики. Однако данная Комиссия не смогла проконтролировать соблюдение прав участвующих в клинических испытаниях пациентов непосредственно в клиниках. Для решения комплекса биомедицинских проблем ГФЦ в 2000 г. были разработаны и утверждены Министерством здравоохранения Украины (приказ № 281 от 01.11.2000 г.) «Инструкция о проведении клинических исследований лекарственных средств и экспертизы материалов клинических испытаний», а также «Типовое положение о комиссии по вопросам этики» («Еженедельник АПТЕКА», № 46 (267) от 27.11.2000 г. — Прим. ред.), которое соответствует статье 8 закона Украины «О лекарственных средствах» с учетом международных норм — правил ICH—GCP и Хельсинской декларации (1964).
ТРЕБОВАНИЯ ICH—GCP К ЭК
Европейский форум GCP разработал рекомендации относительно состава ЭК. Они включают требование, чтобы в их состав входили не менее 5 человек (рекомендуемый максимум составляет 12 человек). Среди них должны быть как минимум 2 врача, имеющих опыт проведения исследований в соответствии с GCP и независимых от учреждения, в котором проводится испытание. В состав ЭК должны быть включены также юрист, парамедик и хотя бы один человек, который не занимается научной деятельностью. В ЭК должны быть лица обоего пола, разного возраста. Члены ЭК должны быть хорошо ознакомлены с культурными и этническими традициями региона, население которого предполагается привлекать к участию в исследовании.
Основными задачами Комиссии по вопросам этики (далее — Комиссии) являются:
-
защита прав и интересов исследуемых, привлеченных к клиническому испытанию лекарственных средств;
-
защита прав и интересов исследователей;
-
обеспечение этической и нравственно-правовой оценки материалов клинического испытания.
До начала проведения клинического испытания лекарственного средства ЭК оценивает этические и нравственно-правовые аспекты программы (протокола) клинического испытания. При обсуждении материалов клинического испытания члены ЭК рассматривают следующие вопросы:
•?соответствие представленного протокола целям и задачам исследования, возможность получения обоснованного результата при минимальной степени риска для субъектов исследования, оправданность возможного риска и неудобств для субъекта в сравнении с ожидаемой пользой для субъекта и других лиц;
-
пригодность исследователя(лей) для проведения предложенного клинического испытания;
-
соответствие исследовательского центра целям и задачам исследования;
-
процедуру привлечения потенциальных субъектов к исследованию;
-
порядок страхования пациентов и выплаты компенсации (если таковая предполагается);
-
содержание информации об исследовании, предоставляемой пациенту;
-
процедуру получения согласия пациента на участие в исследовании.
Во время проведения клинического испытания лекарственного средства Комиссия осуществляет контроль по защите прав и здоровья исследуемых, является гарантом их безопасности, действует в соответствии с разработанными письменными стандартными процедурами, утвержденными на своих заседаниях Комиссии. Деятельность Комиссии должна отвечать требованиям ICH — GCP и законодательству Украины.
Варианты заключений Комиссии по рассмотренным материалам клинических исследований:
-
Одобренное мнение (в странах ЕС используется термин «благоприятная оценка» — favorable opinion, в США — «утвердить» — approve).
-
Для благоприятного решения требуется внесение изменений.
-
Отрицательное решение.
-
Отмена любого ранее принятого решения.
В процессе проведения клинических испытаний исследователь информирует Комиссию в следующих случаях:
-
При внесении любых изменений и дополнений к протоколу клинических исследований.
-
При внесении любых изменений и дополнений к информации, предоставляемой субъектам клинических исследований.
-
При возникновении тяжелых и/или неожиданных побочных эффектов или побочных явлений.
-
При появлении любых новых данных о возможном влиянии исследуемого препарата на человека.
По нашему мнению, возможным путем решения проблемы могло бы стать участие заказчика в финансировании экспертных работ. Ведь не секрет, что в нынешнее непростое время высокообразованные специалисты не будут бесплатно изучать этические вопросы защиты прав пациентов. И поэтому одной из важнейших задач, стоящих перед нами, является внесение соответствующей статьи в новую редакцию закона «О лекарственных средствах».
В Украине в настоящее время проводится активная работа по созданию местных этических комиссий. Сейчас при лечебно-профилактических учреждениях и высших медицинских учебных заведениях созданы 50 Комиссий, которые разрабатывают регламенты своей работы и стандартные операционные процедуры на основании утвержденного Типового положения.
В состав созданных при медицинских учреждениях Комиссий включают от 5 до 11 человек.
ЭТИЧЕСКИЕ КОМИССИИ В УКРАИНЕ
К работе местных Комиссий привлечены 308 человек. Среди них: академиков и член-корреспондентов АМН — 10 человек; профессоров, докторов медицинских наук — 114; доцентов кафедр, кандидатов медицинских наук — 94; докторов и кандидатов биологических наук — 8; врачей — 52; фармацевтов — 3; лаборантов, медицинских сестер — 7; юристов, священников и представителей немедицинских специальностей — 20.
Следует отметить, что в Украине среди вышеперечисленных специалистов — 63 женщины.
|
В каждом конкретном учреждении не все лица, ответственные за проведение клинических испытаний, понимают важность этических вопросов, о чем свидетельствуют составы местных Комиссий. Фактически в 50 местных Комиссиях работают только 20 представителей немедицинских специальностей: юристов — 8, священнослужителей — 5, инженеров — 3, экономистов — 2, библиотекарь — 1 и патентовед — 1. Как правило, директора институтов являются и председателями Комиссий. Большинство Комиссий сформированы не в соответствии с «Типовым положением», что создает возможность для протекционизма при рассмотрении протоколов клинических испытаний.
Разработка и внедрение положений о работе местных Комиссий не одномоментный процесс, этому необходимо постоянно учиться. В «Типовом положении о комиссии по вопросам этики» не могут быть предусмотрены все нюансы, возникающие при работе Комиссий. Поэтому стандартные операционные процедуры для каждой Комиссии могут отличаться в зависимости от специфики работы клинической базы, контингента пациентов, местных условий и т.д. Безоговорочным для местных Комиссии должен оставаться принцип работы в системе GCP.
Таким образом, в Украине уделяется большое внимание этическим и правовым аспектам клинических исследований, в дополнение к уже существующим вносятся новые нормы. Основные положения международного законодательства, в частности ICH — GCP, находят отражение в нормативных документах, разрабатываемых ГП «Государственный фармакологический центр». Происходит процесс планомерного и последовательного внедрения принципов GCP в практику организации и проведения клинических исследований лекарственных средств. Актуальной задачей в настоящее время является создание в Украине территориальных Комиссий, а также Комиссий при медицинских учреждениях. Организация таких независимых комитетов, наделенных соответствующими полномочиями, будет способствовать активному участию клиник Украины в многоцентровых международных исследованиях, позволит контролировать соблюдение прав и безопасности участников испытания не только на этапе организации, но и в процессе непосредственного его проведения.
Для работы в местных Комиссиях требуется специальная подготовка сотрудников. В этом году ГФЦ провел семинар для руководителей клинических баз, на котором большое внимание уделялось этическим аспектам клинических испытаний. На проходящем в настоящее время (1–4 октября 2001 г.) Национальном съезде фармакологов Украины работа одной из секций посвящена клиническим испытаниям, а подготовленное к съезду «Руководство по клиническим испытаниям лекарственных средств» включает отдельную главу, в которой рассматриваются этические вопросы. Особого внимания заслуживает решение биоэтических проблем клинических испытаний с участием особых групп пациентов. К ним относятся дети и люди пожилого возраста, женщины, кормящие грудью. Также требуют решения этические проблемы, возникающие при проведении клинических исследований с участием тяжело и неизлечимо больных людей.
ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ
Необходимо более подробно остановить на этических проблемах клинических испытаний лекарственных средств с участием детей. Согласно существующей в Украине практике, клинические испытания лекарственных средств на детях, за редким исключением, когда препараты предназначены исключительно для применения в педиатрии, проводятся по завершению аналогичных испытаний лекарственных средств на эффективность и безопасность у взрослых. Фармакокинетические исследования оригинальных или генерических лекарственных средств на здоровых детях не проводятся ввиду их сложности. С созданием более совершенных неинвазивных и безопасных методов анализа может появиться возможность проведения фармакокинетических исследований. Изучение фармакокинетики оригинальных или сравнительной фармакокинетики генерических лекарств следует проводить лишь у тех детей, заболевание которых служит показанием к применению данного лекарственного средства.
При таком подходе выясняется, что количество исследований с участием детей, которые проведены в соответствии с требованиями GCP, оказалось минимальным.
Между тем, в некоторых странах проводят клинические исследования с участием детей с онкозаболеваниями (например, в Англии большинство детей с диагнозом лейкемии включены в исследовательские проекты). В перинатальной медицине накоплен значительный опыт использования многоцентровых рандомизированных исследований для решения важных научных проблем.
Известно, что эффект различных лекарственных средств у детей может кардинально отличается от такового у взрослых. Фармакокинетика многих лекарственных препаратов изменяется в зависимости от возраста пациента, а их желательные и побочные эффекты могут быть разными у детей и у взрослых. Например, фенобарбитал оказывает седативный эффект у взрослых, при этом у детей он может вызывать возбуждение.
С точки зрения философии этично разрешить ребенку принять участие в исследовании только в том случае, если в процессе его проведения предполагается минимальный риск — не выше, чем ожидаемый в обычных условиях.
Прежде чем приступить к исследованию с привлечением детей, мы рекомендуем исследователям и ЭК ответить на четыре вопроса:
-
Обосновано ли клиническое исследование, важны ли предполагаемые результаты и будут ли в результате получены ответы на поставленные вопросы?
-
Не являются ли достаточными результаты, полученные при проведении исследований на взрослых пациентах?
-
Допустимы ли риск и нагрузки, которым будут подвергнуты субъекты исследования?
-
Не нарушаются ли права субъектов исследования при получении согласия?
Клинические исследования на детях следует инициировать лишь в тех случаях, когда необходимые данные невозможно получить при проведении исследований на пациентах других возрастных групп. Тем не менее, запрещается убеждать родителей(я) и ребенка в том, чтобы они приняли решение об участии в исследовании, с помощью финансовых или иных материальных механизмов. Не следует привлекать к клиническим исследованиям детей, содержащихся в домах для сирот, исправительных учреждениях, а также необходимо резко ограничить участие детей из социально неблагополучных семей (родители-алкоголики, наркоманы, безработные, неоднократно судимые и т.д.). ЭК может потребовать привлечения для каждого ребенка, находящегося на попечении государства, адвоката в дополнение к любому частному лицу, действующему от имени ребенка в качестве попечителя или приемного родителя.
Хельсинская декларация гласит, что согласие ребенка должно быть получено в дополнение к разрешению его родителей. При проведении клинических исследований так же, как и в ходе медицинского лечения, основополагающими принципами являются максимально возможное вовлечение и активное участие ребенка в процессе принятия решения.
Спорным вопросом пока остается степень риска, допустимая в проведении исследований на детях. Вопрос о I фазе клинических испытаний лекарственных средств у детей заслуживает особого рассмотрения. Обычный подход к проведению исследований лекарственных средств заключается в том, что вначале исследования осуществляются на животных, затем на взрослых, детях старшего возраста и только затем на детях младшего возраста. Однако в некоторых случаях невозможно получить необходимую информацию, основываясь на результатах исследований, проведенных на детях старших возрастных групп. Более того, при некоторых заболеваниях, характерных только для пациентов детского возраста, может потребоваться проведение исследований с привлечением детей младшего возраста, без предварительного получения информации больных старших возрастных групп.
Если ЭК одобряет проведение I фазы клинических испытаний лекарственных средств на детях, то в документе об информированном согласии пациента должна содержаться информация о том, что известно относительно вероятности и степени возможной пользы и риска, которую может принести новый метод лечения.
Таким образом, клиническое исследование на детях ЭК может рассматривать как этически приемлемое, если:
-
Необходимые данные не могут быть получены на взрослых пациентах.
-
Исследование рационально спланировано с учетом минимизации как неблагоприятных последствий применения препарата, так и проведения инвазивных процедур.
-
Исследование изучаемого лекарственного средства направлено на получение важных результатов для совершенствования диагностики и лечения заболевания.
А.В. Стефанов, чл.-кор. АМН Украины, проф., д-р биол. наук
В.И. Мальцев, проф., д-р мед. наук,
ГП «Государственный фармакологический центр»



Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим