|
На встрече руководителей регуляторных органов и отечественных фармацевтических предприятий, состоявшейся в МЗ Украины 14 мая 2002 г. («Еженедельник АПТЕКА», № 20 (341) от 20 мая 2002 г.), обсуждались проблемы, существующие в системе обеспечения качества лекарственных средств (ЛС) в Украине на этапах разработки, производства и распространения. Заведующий сектором координации и контроля клинических испытаний лекарственных средств ГП «Государственный фармакологический центр» МЗ Украины (Сектором), доктор медицинских наук, профессор Владимир Мальцев уделил внимание проблемам, которые возникают при проведении клинических испытаний ЛС в Украине.
По статистическим данным ВОЗ, летальность от побочного действия ЛС занимает 5-е место в мире после сердечно-сосудистых заболеваний, заболеваний легких, онкологических заболеваний и травм (Dormann H., 2000). При этом не учитываются данные о врачебных ошибках и случаях злоупотребления ЛС. Побочные реакции при применении ЛС составляют 4,2–6% всех случаев госпитализации (Drug Safety, 6, 1997). Затраты, связанные с осложнениями, вызываемыми ЛС, в США составляют около 76,6 млрд долл. США (Johnson J., Bootman J., 1995), в Германии — около 588 млн долл. США (Drug Safety, 6, 1997).
Нормативной базой для осуществления клинических испытаний (КИ) в настоящее время являются закон Украины «О лекарственных средствах», ст. 7, 8, 12, и Инструкции, утвержденные приказами МЗ Украины № 347 от 19.12.2000 г. «Об утверждении Инструкции относительно осуществления надзора за побочными реакциями/действиями лекарственных средств», № 51 от 08.02.2001 г. «Об организации предоставления информации о побочных действиях лекарственных средств», № 292 от 16.07.2001 г. «Об усовершенствовании организации предоставления информации о побочных реакциях лекарственных средств», а также № 281 от 01.11.2000 г. Согласно последнему приказу утверждены Инструкции о проведении КИ ЛС и экспертизы материалов КИ и «Типовое положение о комиссиях по вопросам этики». Кроме того, Сектор руководствуется Инструкцией ГП «Государственный фармацевтический центр» МЗ Украины (ГФЦ) «О проведении инспекционных проверок клинических испытаний лекарственных средств».
На протяжении 1996–2001 г. в Украине было проведено 1088 КИ (рис. 1).
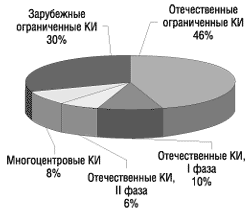 |
Рис. 1. Клинические испытания, проведенные в Украине в 1996–2001 гг.
По мнению Владимира Мальцева, проведение в Украине многоцентровых КИ свидетельствует о том, что украинские врачи методологически верно выполняют соответствующие КИ, а также о том, что нормативная база, создающая условия для этого, и система надзора КИ не противоречат международным требованиям.
В 2001 г. наибольшее количество КИ проведено по препаратам для лечения инфекционных заболеваний и патологии сердечно-сосудистой системы (рис. 2).
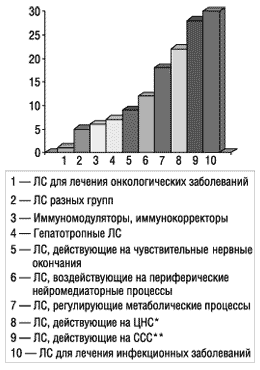 |
* Центральная нервная система.
** Сердечно-сосудистая система.
Рис. 2. Количество проведенных в Украине клинических испытаний ЛС по фармакотерапевтическим группам
В последние несколько лет среди отечественных фармацевтических предприятий выделилась группа лидеров, непрерывно обновляющих ассортимент производимых ЛС: такие, как «Фармацевтическая фирма «Дарница», ОАО «Фармак», компания «Стиролбиофарм», ЗАО «Борщаговский ХФЗ». Именно эти предприятия выступили заказчиками наибольшего количества проведенных КИ.
Владимир Мальцев также остановился на вопросе обеспечения качества проводимых в Украине КИ. Гарантия качества и достоверности КИ обеспечивается двухсторонним контролем. С одной стороны — регулирующие органы, уполномоченные государством (в Украине — ГП ГФЦ МЗ Украины) — создают нормативную базу для проведения КИ и осуществляют функцию контроля за ее соблюдением (рис. 3), с другой — большая ответственность возлагается на заявителя по проведению аудита и мониторинга КИ. Задачами заявителей (заказчиков, спонсоров) КИ являются: создание протокола КИ и получение всех разрешений от регулирующих органов, заключения со стороны комиссии по этике, других органов.
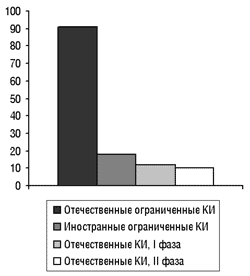 |
Рис. 3. Количество инспекционных проверок КИ в 1999–2002 гг.
С января 1999 г. по апрель 2002 г. Сектор провел более 100 инспекций КИ. При этом выявлен ряд недостатков (таблица), которых, по мнению Владимира Мальцева, могло не быть, если бы заказчики более ответственно относились к своим обязанностям аудитора КИ.
Таблица
Основные замечания при инспектировании КИ, %
|
Замечания |
1999 |
2000 |
2001 |
|
Недостатки в оформлении документации о получении и хранении ЛС, нарушении маркировки |
50 |
36 |
50 |
|
Отсутствие рандомизации |
16 |
17 |
16 |
|
Несоблюдение критериев включения/исключения пациентов |
14 |
5 |
14 |
|
Несвоевременное информирование о побочных реакциях ЛС |
14 |
11 |
14 |
|
Отсутствие письменного информированного согласия пациента |
12 |
– |
12 |
|
Недоукомплектованный файл исследователя |
40 |
30 |
35 |
Владимир Мальцев обратил внимание присутствующих на маркировку ЛС, предназначенных для КИ. Во-первых, согласно закону Украины «О лекарственных средствах», ЛС, используемые для КИ, должны иметь обозначение «Для клинических испытаний». Во-вторых, информация на этикетке, внешней и внутренней упаковке должна содержать: название ЛС, название и адрес производителя, номер серии, способ применения (изготовления), дозу действующего вещества, количество в упаковке, срок годности, условия хранения. Как видно из таблицы, около половины заказчиков КИ нарушают это условие.
Еще более серьезными нарушениями при проведении КИ являются те, которые могут представлять угрозу для жизни и здоровья пациентов. К таковым относятся: нарушения, которые выявляются повторно, серьезные побочные реакции, нарушения этических норм проведения КИ, отсутствие либо недостаточная эффективность испытуемых ЛС. По представлению Сектора директор ГФЦ вправе принимать решение о приостановке или запрещении КИ. Так, по результатам инспекционных проверок на основании перечисленных критериев в 1997–2001 гг. принято решение: продолжить КИ после устранения выявленных недостатков — в 127 случаях, приостановить КИ — в 3, прекратить КИ — в 1.
Для предотвращения подобных нарушений заказчик должен обеспечить контроль качества проведения КИ с помощью мониторинга и аудита. Мониторинг — это надзор и контроль со стороны заказчика (спонсора) в целях обеспечения проведения испытания, сбора данных и предоставления результатов в соответствии с протоколом, правилами надлежащей клинической практики (GCP) и действующих нормативных требований. Аудит — систематическая независимая проверка документации и деятельности привлеченных к проведению КИ сторон. Обычно монитором выступает представитель заказчика, а аудитором — представитель независимой компании (научно-исследовательской организации), привлеченной заказчиком по контракту.
Следует отметить, что в настоящее время при планировании КИ в недостаточной мере уделяется внимание таким факторам, как:
-
дизайн КИ (практически все проводятся как открытые);
-
рандомизация (как правило, не предусмотрена);
-
отбор контингента испытуемых;
-
определение критериев эффективности и безопасности;
-
методы обследования (часто неадекватные);
-
воздействие сопутствующей терапии;
-
некачественное оформление протокола.
Владимир Мальцев отметил, что на этапе анализа результатов проведенных КИ также отмечается ряд существенных недостатков. Среди них стоит выделить:
-
неполное предоставление данных, которые подтверждают эффективность и безопасность исследуемого ЛС;
-
неадекватные методы статистической обработки данных;
-
некачественная клиническая интерпретация полученных результатов;
-
неполный учет и описание побочных эффектов и реакций, выявленных в ходе КИ;
-
несоответствие утвержденному протоколу данных, которые приводятся в отчете.
Отечественные предприятия практически не уделяют внимания определению биоэквивалентности ЛС. В настоящее время готовится приказ МЗ Украины, согласно которому будет регламентировано определение биоэквивалентности при проведении КИ. В связи с этим Владимир Мальцев напомнил присутствующим, что определение биоэквивалентности и биодоступности — это один из неотъемлемых этапов КИ.
После начала активной работы по выявлению побочных реакций ЛС в Украине значительно увеличилось количество соответствующих сообщений (рис. 4).
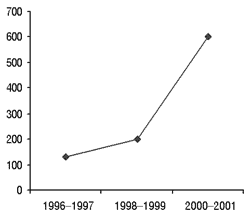 |
Рис. 4. Общее количество спонтанных сообщений о случаях побочных реакций ЛС, которые поступили в ГФЦ в 1996–2001 гг.
При клиническом применении ЛС выявлено около 800 случаев побочных эффектов, при проведении КИ — около 100.
Доля побочных эффектов ЛС отечественного и зарубежного производства представлена на рис. 5.
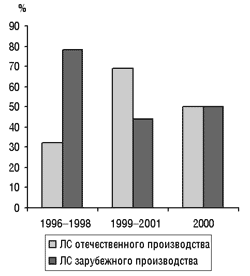 |
Рис. 5.?Доля побочных эффектов ЛС отечественного и зарубежного производства в 1996–2002 гг.
Согласно Приказу МЗ Украины № 347 от 19.12.2000 г. утверждены инструкция о форме, которую обязан заполнить каждый производитель ЛС, а также порядок, согласно которому производители должны сообщать в ГФЦ о побочных действиях производимых ими ЛС. Так, в первые 2 года после регистрации препарата каждое предприятие-производитель 1 раз в течение 6 месяцев должно уведомлять ГФЦ о побочных действиях ЛС. На протяжении следующих 3 лет предприятие обязано заполнять такую карту 1 раз в год, по прошествии этого срока — 1 раз в 5 лет, а также в случае перерегистрации лекарственного препарата. Эта форма аналогична принятой в ЕС. К сожалению, на 1 мая 2002 г. в ГФЦ не поступило ни одного сообщения от отечественных производителей о наличии побочных действий производимых ими ЛС. Зарубежные же производители сообщили о более чем 1500 случаях побочных эффектов производимых ими ЛС за рубежом, а также 183 — на территории Украины. Это позволяет констатировать, что собственная система контроля безопасности выпускаемой продукции на отечественных предприятиях практически отсутствует. Кроме того, очевидно, что отечественные производители не стремятся к взаимодействию с Сектором и ГФЦ. Такой подход противоречит законодательству Украины и международным обязательствам государства перед ВОЗ, Европейским Союзом, Советом Европы (в частности, директивам Совета ЕС по вопросам фармакологического надзора 75/319 ЕС с дополнениями, внесенными директивами 83/570/ЕС и 93/39/ЕС) и может обусловить формирование негативного имиджа отечественных производителей на международном рынке ЛС.
Тарас Махринский
Фото Евгения Кривши
В статье использованы слайды, представленные в докладе
Владимира Мальцева


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим