Большинство детей раннего возраста периодически переносят заболевания органов дыхания, в развитии и течении которых решающее значение имеет состояние иммунной системы организма. Известно, что некоторые дети подвержены рецидиву острых респираторных заболеваний, склонны к затяжному их течению, развитию осложнений и рецидивированию. Эта категория детского населения заслуживает особого внимания, так как частые респираторные инфекции могут обусловить срыв основных компенсаторно-адаптационных механизмов, привести к значительным нарушениям функционального состояния организма (особенно органов дыхания, пищеварительной и вегетативной нервной систем), способствовать снижению иммунорезистентности организма и раннему развитию хронической патологии. Наиболее достоверными признаками иммунодефицита принято считать высокую подверженность инфекциям и снижение показателей иммунного статуса, в первую очередь количества Т- и В-лимфоцитов, дисбаланс субпопуляций Т-хелперов и Т-супрессоров и снижение фагоцитарной активности моноцитарно-макрофагальной системы, наличие которых указывает на необходимость проведения иммунокоррекции (Бережной В.В., 2004).
Мировой опыт свидетельствует, что респираторные инфекции вызываются широким спектром возбудителей. Наиболее важным фактором в развитии рецидивирующего бронхита у детей являются острая респираторная вирусная инфекция или массированная вирусно-бактериальная инфицированность и персистенция оппортунистической микрофлоры. Рецидивированию бронхита способствуют низкая фагоцитарная активность макрофагов и нейтрофилов, сниженная протеолитическая система трахеобронхиального секрета, низкая неспецифическая ферментная защита бронхов, иммунодефицитное состояние (Антипкин Ю.Г., 2003).
Заболевания органов дыхания являются одной из наиболее важных проблем в педиатрии, поскольку до настоящего времени, несмотря на достигнутые успехи, они занимают одно из первых мест в структуре детской заболеваемости. Высокий уровень распространенности острых респираторных инфекций среди детей — важная социальная проблема, решение которой является одной из основных задач здравоохранения в педиатрии.
Дети, часто болеющие острыми респираторными инфекционными заболеваниями, составляют группы риска развития острого бронхита, бронхиолита, формирования рецидивирующего бронхита, включая обструктивные формы, и хронической бронхолегочной патологии. Одной из самых распространенных нозологий, особенно среди детей в возрасте 1–3 лет, является бронхит. По данным ряда российских авторов, заболеваемость бронхитами составляет 15–50% (Середа Е.В., 2002). Особенно актуальна эта проблема для детей с частыми острыми респираторными заболеваниями, особенно проживающих в экологически неблагоприятных регионах; при этом нередко развивается обструктивный синдром. Чувствительность рецепторов бронхов повышается при вирусной инфекции, сопровождающейся повреждением эпителия слизистой оболочки дыхательных путей. Повышенная чувствительность бронхиального дерева к вирусной инфекции может быть связана с аллергической предрасположенностью и гиперреактивностью бронхов.
Повторные острые респираторные заболевания могут способствовать сенсибилизации организма и создавать предпосылки для развития генерализованных реакций повышенной чувствительности с последующим формированием рецидивирующего обструктивного бронхита, бронхиальной астмы и других бронхолегочных заболеваний.
Известно, что воспаление — пусковой механизм всех изменений, характерных для хронического бронхита, приводящих к гиперсекреции, нарушению мукоцилиарного клиренса, нарушению дренажной функции, развитию бронхиальной обструкции, снижению местных защитных механизмов, и создает благоприятные условия для бактериальной инфекции. При этом возникает порочный круг взаимосвязанных и взаимообуславливающих факторов воспаления.
Принципиально важным представляется вопрос: рецидивирующая бронхолегочная патология — болезнь легких или иммунной системы? Если принять во внимание топический принцип классификации болезней, то следует признать, что патологический процесс действительно протекает в дыхательной системе. Однако, согласно более корректному этиологическому и патогенетическому подходам, причинами развития и перехода воспалительного процесса в легких в хроническую форму являются различные иммунные нарушения, вызывающие снижение резистентности организма к микробной агрессии. Таким образом, когда клиницист сталкивается с рецидивирующим бронхитом, он имеет дело не с первичной болезнью дыхательной системы, а с заболеванием иммунитета, неспособного осуществить надлежащую защиту бронхиального дерева. Исключение составляют редкие случаи аномалий развития органов дыхания (Казмирчук В.Е., 2008).
 На сегодня рецидивирующие респираторные заболевания занимают центральное место среди клинических масок иммунодефицитных болезней, поэтому проблема диагностики, лечения и реабилитации таких больных до сих пор остается чрезвычайно актуальной.
На сегодня рецидивирующие респираторные заболевания занимают центральное место среди клинических масок иммунодефицитных болезней, поэтому проблема диагностики, лечения и реабилитации таких больных до сих пор остается чрезвычайно актуальной.
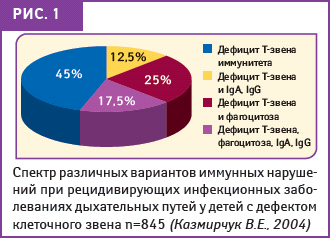
В большинстве случаев истинной причиной рецидивирующей бронхолегочной патологии у детей являются иммунные нарушения (рис. 1), приводящие к снижению сопротивляемости организма инфекционным агентам, а наиболее значимыми факторами риска — наследственная предрасположенность к бронхолегочным заболеваниям, антенатальная патология или же их сочетание.
Клинико-гематологическими критериями иммунных нарушений у детей с рецидивирующей бронхолегочной патологией являются:
- высокая частота рецидивов;
- затяжное течение;
- слабая, но чрезмерно длительная температурная реакция;
- низкая эффективность традиционного лечения;
- наличие очагов хронической инфекции в организме;
- стойкая лейкопения, нейтропения, лимфопения или немотивированный лимфоцитоз;
- низкая СОЭ в острый период заболевания, особенно при бактериальных инфекциях.
Детям с рецидивирующей бронхолегочной патологией зачастую необходимы консультация клинического иммунолога и применение иммунотропных препаратов. При этом своевременная коррекция иммунных нарушений не только позволяет добиться перелома в течении болезни, но и провести первичную профилактику хронических обструктивных болезней легких (ХОБЛ) (Казмирчук В.Е., 2008).
Основные цели при лечении рецидивирующих респираторных инфекций у детей таковы:
- устранение факторов риска;
- уменьшение количества острых эпизодов;
- снижение остроты и длительности острых эпизодов;
- сокращение приема антибиотиков, жаропонижающих/других симптоматических лекарственных средств;
- уменьшение количества пропусков школы и детского сада.
В последние годы на отечественном рынке появилось большое количество лекарственных средств, позиционируемых как иммуномодуляторы, в том числе и для применения у детей. Однако многие из них (теоретически многообещающих), так и не сумели занять достойного места в схемах лечения часто болеющих детей (Намазова Л.С., 2008).
Новый иммуномодулирующий препарат ИМУНОРИКС (пидотимод), появившийся на рынке Украины, является эффективной и надежной иммунотерапевтической защитой при рецидивирующих респираторных инфекциях у часто болеющих детей за счет предотвращения рецидивов заболеваний. Польза от более быстрого устранения острой инфекции и/или уменьшения выраженности ее симптомов заключается в уменьшении объема этиологического или симптоматического лечения, дней, проведенных в стационаре, и числа рабочих дней, пропущенных родителями. Исследования по препарату, проведенные в Европе, соответствуют уровню доказательности А.
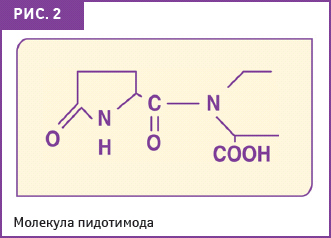 ИМУНОРИКС (пидотимод) — это синтезированный иммуномодулирующий препарат пептидной структуры (молекулярная формула C9H12N2O4S) с высокой биодоступностью для приема внутрь (рис. 2).
ИМУНОРИКС (пидотимод) — это синтезированный иммуномодулирующий препарат пептидной структуры (молекулярная формула C9H12N2O4S) с высокой биодоступностью для приема внутрь (рис. 2).
Процесс производства препарата ИМУНОРИКС гарантирует высокую степень очистки продукта, что обеспечивает эффективность и хорошую переносимость препарата. Таким образом, синтетическая формула пидотимода обеспечивает неизменное качество препарата и предполагаемый результат при его применении.
После перорального применения ИМУНОРИКС быстро всасывается — пик содержания вещества в плазме крови достигается через 1,5 ч после приема, биодоступность составляет 43–45% независимо от дозы, период полураспада 4 ч, выведение с мочой 95%. После повторного введения препарата не выявляют эффекта кумуляции или самоиндукции.
ИМУНОРИКС оказывает иммунокорригирующее действие посредством повышения активности фагоцитов как мононуклеарных, так и полиморфноядерных, повышая хемотаксическую и фагоцитарную активность и производство секреторного IgA. Миграционная способность макрофагов является важнейшим необходимым условием для эффективного фагоцитоза и элиминации возбудителя. Кроме того, препарат активирует другие неспецифические факторы иммунного ответа — естественные клетки-киллеры, которые обеспечивают одну из первых линий защиты организма от патогенных вирусов и бактерий, а также неопластических клеток. ИМУНОРИКС повышает функциональный ответ Т-лимфоцитов, которые при определенных состояниях действуют как координаторы специфического иммунитета. Препарат также стимулирует образование Т- и В-лимфоцитов, улучшая соотношение Т-хелперов и Т-супрессоров, увеличивает продукцию цитокинов (в частности — интерлейкина (ИЛ)-2), активизирует выработку гамма-интерферона — естественного противовирусного агента организма (Намазова Л.С., 2008). Эти характеристики позволяют считать препарат ИМУНОРИКС иммуномодулятором, воздействующим одновременно на несколько звеньев иммунного ответа, с возможностью его применения как в острой фазе заболевания, так и в качестве профилактики частых респираторных инфекций (рис. 3, 4).
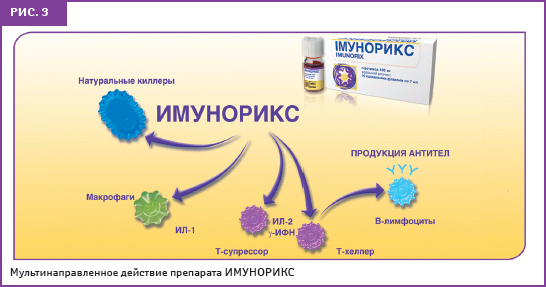

В условиях эксперимента было доказано влияние препарата ИМУНОРИКС на параметры иммунитета. В доклинических экспериментальных исследованиях была установлена способность препарата оказывать регулирующее действие на иммунный ответ (Maillard F., 1994). Показано, что пидотимод сохраняет способность перитонеальных макрофагов синтезировать NO и фактор некроза опухоли ? при его введении с метилпреднизолоном, в то время как введение мышам только метилпреднизолона приводило к снижению способности этих клеток к синтезу NO и фактора некроза опухоли ? (Taramelli D. et al., 1994). Доказана способность ИМУНОРИКСА к стимуляции функциональной активности нейтрофилов ex vivo и in vivo: согласно результатам исследования, введение пидотимода в дозе 200 мг/кг массы тела в течение 5 дней значительно повышало активность NK-лимфоцитов (естественных киллеров) мышей (Migliorati G. et al., 1992).
Под влиянием препарата отмечено увеличение продукции ИЛ-2. Было выявлено, что превентивное назначение 2 летним мышам пидотимода за 10 дней до их инфицирования E. coli приводило к усилению спленоцитами синтеза ИЛ-2, но не фактора некроза опухоли ; вместе с тем в спленоцитах мышей, не получавших пидотимод, после введения E. coli отмечали увеличение продукции как ИЛ-2, так и фактора некроза опухоли ? (Chiarenza A. et al., 1994; Annoni G. et al., 1994). Установлено, что введение пидотимода мышам нормализует повышенную продукцию адренокортикотропного гормона, стимулированную введением ИЛ-1, что свидетельствует о регуляторном влиянии этого препарата на взаимодействие иммунной и эндокринной систем (Chiarenza A. et al., 1994). Выявлено протекторное действие ИМУНОРИКСА при бактериальной инфекции у мышей. На различных экспериментальных моделях продемонстрировано, что предварительное интраперитонеальное введение препарата в дозе 0,01–100 мкг/мл в течение 5 дней способствовало повышению выживаемости лабораторных животных после инфицирования. Кроме того, было выявлено, что пидотимод повышает эффективность -лактамных антибиотиков (Coppi G. et al., 1991). Профилактическое назначение пидотимода в дозе 25 мг/кг массы тела снижает смертность у мышей, инфицированных Str. рneumoniae (Di Marco R. et al., 1992). В эксперименте на мышах было установлено, что профилактическое введение препарата в течение 15 дней до инфицирования их вирусом простого герпеса и вирусом гриппа приводит к увеличению периода выживаемости животных (Dianzani C. et al., 1994).
В клинических исследованиях изучали клинико-иммунологическую эффективность пидотимода у больных хроническим бронхитом (ХБ) и ХОБЛ. В двойном слепом плацебо-контролируемом исследовании с участием 137 пациентов с ХБ установлено, что назначение пидотимода в течение 7 дней сочетанно с антибиотиком, а затем 8 дней в виде монотерапии в дозе 800 мг дважды в сутки достоверно способствовало сокращению длительности обострения ХБ (Pozzi E. et al., 1994). В двойном слепом плацебо-контролируемом исследовании препарат назначали в виде монотерапии для профилактики обострений ХБ. Пидотимод или плацебо назначали 181 больному с ХБ в дозе 800 мг в сутки в течение 60 дней и затем наблюдали за пациентами также в течение 60 дней. Было выявлено, что за время лечения и последующего наблюдения прогрессивно снижалась частота обострений ХБ с высокой степенью достоверности (p<0,001) (Bisetti A. et al., 1994).
 Пидотимод или плацебо назначали для профилактики обострений ХБ в течение 60 дней и наблюдали за больными в течение 90 дней. Было выявлено, что пидотимод способствует уменьшению длительности и количества эпизодов обострений, а также снижает потребность в антибиотиках для купирования обострений ХБ (Ciaccia A. et al., 1994). При изучении влияния пидотимода на функциональную активность Т-лимфоцитов периферической крови у больных ХОБЛ (двойное слепое плацебо-контролируемое исследование с участием 52 пациентов) было установлено, что пидотимод потенцирует функциональную активность Т-лимфоцитов. Полученный эффект отмечали с 15 го дня лечения, который длился в течение 5 нед (Benetti G.P. et al., 1994).
Пидотимод или плацебо назначали для профилактики обострений ХБ в течение 60 дней и наблюдали за больными в течение 90 дней. Было выявлено, что пидотимод способствует уменьшению длительности и количества эпизодов обострений, а также снижает потребность в антибиотиках для купирования обострений ХБ (Ciaccia A. et al., 1994). При изучении влияния пидотимода на функциональную активность Т-лимфоцитов периферической крови у больных ХОБЛ (двойное слепое плацебо-контролируемое исследование с участием 52 пациентов) было установлено, что пидотимод потенцирует функциональную активность Т-лимфоцитов. Полученный эффект отмечали с 15 го дня лечения, который длился в течение 5 нед (Benetti G.P. et al., 1994).
Применение пидотимода у детей с рецидивирующими респираторными инфекциями всесторонне исследовано. В двойном слепом плацебо-контролируемом исследовании влияния пидотимода на рецидивирующие фаринго-тонзиллярные инфекции у 416 детей было установлено, что использование пидотимода достоверно уменьшает количество, длительность и тяжесть этих инфекций. Указанный эффект отмечали как во время лечения (пидотимод или плацебо в дозе 400 мг в течение 60 дней), так и в последующие 3 мес наблюдения (Passali D. et al., 1994).
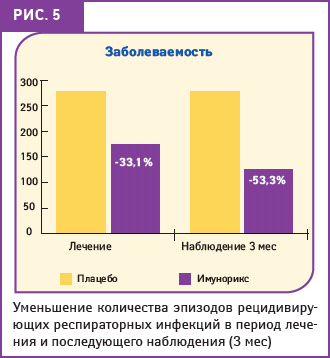
 Как свидетельствуют результаты данного исследования, применение пидотимода позволило значительно снизить количество инфекционных заболеваний у детей (рис. 5). В целом достоверный эффект снижения заболеваемости был выражен как в течение 2 мес лечения (186 случаев по сравнению с 278 в группе плацебо, р<0,01), так и в контрольный период наблюдения (129 случаев против 276 в группе плацебо, р<0,01).
Как свидетельствуют результаты данного исследования, применение пидотимода позволило значительно снизить количество инфекционных заболеваний у детей (рис. 5). В целом достоверный эффект снижения заболеваемости был выражен как в течение 2 мес лечения (186 случаев по сравнению с 278 в группе плацебо, р<0,01), так и в контрольный период наблюдения (129 случаев против 276 в группе плацебо, р<0,01).
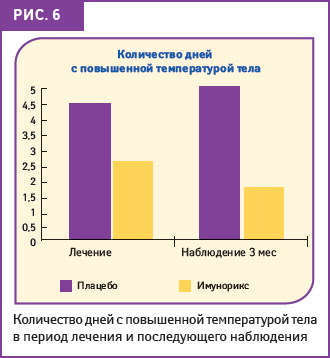
В подтверждение длительного эффекта от применения препарата в течение 2 мес лечения было доказано значительное уменьшение количества эпизодов инфекций в группе детей, принимавших ИМУНОРИКС (на 33,1%), и 3 мес контрольного наблюдения (на 53,3%). У пациентов, принимавших плацебо, показатели значительно отличались в пользу ИМУНОРИКСА. Также отмечено значительное сокращение количества дней с повышенной температурой тела (рис. 6), причем 1-я группа демонстрировала значительно лучший результат, чем 2-я (на 64,6%). Переносимость препаратов в обеих группах была отмечена как хорошая: однако в группе детей, получавших плацебо, побочные эффекты отмечали чаще, но все они были незначительными и быстро обратимыми (Passali D. et al., 1994).
При назначении 50 детям с рецидивирующими респираторными инфекциями пидотимода или плацебо (в дозе 800 мг/сут в течение 20 дней) нормализация иммунорегуляторного индекса (соотношение Т-хелперы/Т-супрессоры) происходила только у детей, получавших пидотимод (Carredu P. et al., 1994).
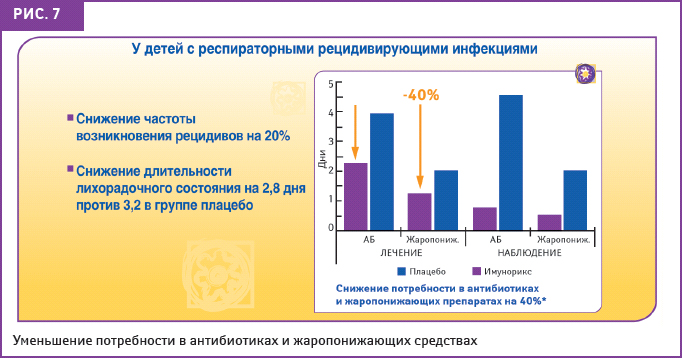
Исследование эффективности пидотимода, проведенное в 69 медицинских центрах (748 детей), продемонстрировало, что пидотимод достоверно способствует снижению частоты, тяжести и длительности повторных респираторных инфекций (Carredu P. et al., 1994). В работе приведены результаты обследования 671 ребенка — 405 мальчиков и 266 девочек — в возрасте 3–14 лет (57% детей дошкольного возраста и 43% школьников); 77 пациентов были исключены из исследования, так как принимали кортизон или системные иммуностимуляторы либо были в возрасте младше 3 лет. В группе детей, принимавших ИМУНОРИКС, частота возникновения рецидивов респираторных инфекций была на 20% меньше, чем в группе плацебо. Общее количество инфекционных эпизодов в группе ИМУНОРИКСА было значительно ниже (p<0,01), чем в группе плацебо (Carredu P. et al., 1994). Была выявлена значительная разница между двумя группами в длительности лихорадочного состояния со средней величиной 1,8–2,8 дня в группе ИМУНОРИКСА по сравнению с 2,8–3,2 дня в группе плацебо (p<0,01). Использование антибиотиков и симптоматических препаратов было существенно ниже у детей, получавших ИМУНОРИКС (р<0,01) (рис. 7). В ходе исследования было установлено, что среднее время до первого эпизода респираторной инфекции в группе плацебо составляет 36 дней в сравнении с группой, принимавшей ИМУНОРИКС, в которой к концу 2 го месяца исследования у более 50% детей не отмечали каких-либо признаков рецидивирующих респираторных инфекций (p<0,01). Таким образом, активация защитных реакций организма под воздействием препарата ИМУНОРИКС в сравнении с плацебо значительно уменьшила время отсутствия в школе, так же как и период, проведенный в медицинских учреждениях.
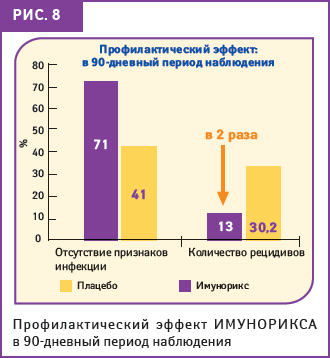 Также в ходе данного испытания было отмечено сохранение профилактического эффекта препарата ИМУНОРИКС после окончания лечения. В процессе наблюдения никаких признаков инфекции не было отмечено у 71% детей, принимавших ИМУНОРИКС, и у 41% детей из группы плацебо (p<0,01); кроме того, в 1-й группе пациентов было отмечено значительно меньшее количество эпизодов респираторной инфекции (13%), чем среди пациентов, получавших плацебо (30,2%) (рис. 8).
Также в ходе данного испытания было отмечено сохранение профилактического эффекта препарата ИМУНОРИКС после окончания лечения. В процессе наблюдения никаких признаков инфекции не было отмечено у 71% детей, принимавших ИМУНОРИКС, и у 41% детей из группы плацебо (p<0,01); кроме того, в 1-й группе пациентов было отмечено значительно меньшее количество эпизодов респираторной инфекции (13%), чем среди пациентов, получавших плацебо (30,2%) (рис. 8).
В период наблюдения частота возникновения симптомов респираторной инфекции у детей в группе ИМУНОРИКС была небольшой, длительность периода лихорадки, использование антибиотиков и симптоматических препаратов были существенно ниже. Критерий, определяющий промежуточный интервал между концом лечения и концом наблюдения (3 мес), подтвердил профилактический эффект препарата: период от окончания лечения до первой вспышки респираторной инфекции составил 65 дней в группе ИМУНОРИКСА и 19 дней в группе плацебо (p<0,01).
В результате исследования была также доказана высокая безопасность препарата: в группе детей, принимавших ИМУНОРИКС, было зафиксировано всего лишь 22 случая легких побочных эффектов (в группе плацебо — 15). Отмена препарата потребовалась лишь у 3 пациентов из группы ИМУНОРИКСА и у 1 из группы плацебо. Контроль за параметрами биохимического анализа крови во всех случаях не показал значительных изменений от исходных показателей. Таким образом, безопасность препарата оценена как хорошая либо отличная у 94,3% детей, получавших ИМУНОРИКС, и у 97,4% детей, получавших плацебо.
Метаанализ, проведенный группой мексиканских исследователей, также свидетельствует об эффективности пидотимода при лечении детей с рецидивирующими респираторными инфекциями (De la Torre Gonzalez C. et al., 2005). Кроме того, что при назначении пидотимода (в дозе 800 мг/сут в течение 15 дней, а затем — по 400 мг/сут еще в течение 20 дней) отмечали прогрессивное улучшение клиренса респираторного эпителия в течение 9 мес наблюдения (Aivazis V. et al., 2002). При изучении действия пидотимода у 120 детей в двойном слепом плацебо-контролируемом исследовании было показано, что наряду с положительным клиническим эффектом у детей, получавших пидотимод, повышалась функциональная активность нейтрофилов крови, что выражалось в усилении нейтрофильного хемотаксиса (Caramia G. et al., 1994).
Мультицентровое плацебо-контролируемое исследование было проведено в двух параллельных группах пациентов, принимавших ИМУНОРИКС и плацебо при условии обоюдной анонимности (слепой метод) (Буржио Г.Р. и соавт., 1994). Для эксперимента были приглашены часто болеющие дети обоих полов (n=101, 53 мальчика и 48 девочек) с респираторными инфекциями в анамнезе, проходившие курс лечения в амбулаторных условиях. Перед началом исследования были отстранены от участия пациенты, которые получали лечение другими иммуномодуляторами в течение 6 мес, предшествующих эксперименту, а также пациенты с инфекциями в острой фазе, с хроническими заболеваниями или с врожденным или приобретенным иммунодефицитом и, разумеется, были исключены из наблюдения больные со злокачественными новообразованиями дыхательных путей.
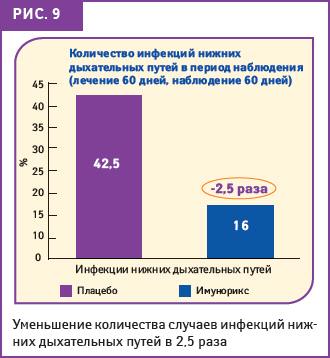 Детей разделили на 2 группы, каждый из них получил предписание принимать ежедневно внутрь ИМУНОРИКС в дозе 400 мг/сут (n=52) или плацебо (n=49); плацебо имело такой же внешний вид и идентичный вкус, как и ИМУНОРИКС. Лечение продолжалось 60 дней, далее следовал период наблюдения такой же длительности. Контрольные осмотры пациентов проводились в день начала эксперимента (Т0), по прошествии 30 (Т30) и 60 дней лечения (Т60), далее по истечении 2-месячного периода наблюдения (Т120) (Буржио Г.Р. и соавт., 1994). Что касается инфекций нижних дыхательных путей, то существенная разница всегда была в пользу препарата ИМУНОРИКС. Между 1-м и 2-м месяцем лечения, то есть в период, когда было выявлено статистически значимое (p<0,05) снижение заболеваемости инфекциями, в группе ИМУНОРИКС показатели были лучше, чем в группе плацебо. Это отличие осталось таким же и в период наблюдения, на протяжении которого только 16% детей из группы принимавших ИМУНОРИКС отмечали инфекции нижних дыхательных путей, а в группе плацебо таких детей было 42,5% (p<0,05) (рис. 9).
Детей разделили на 2 группы, каждый из них получил предписание принимать ежедневно внутрь ИМУНОРИКС в дозе 400 мг/сут (n=52) или плацебо (n=49); плацебо имело такой же внешний вид и идентичный вкус, как и ИМУНОРИКС. Лечение продолжалось 60 дней, далее следовал период наблюдения такой же длительности. Контрольные осмотры пациентов проводились в день начала эксперимента (Т0), по прошествии 30 (Т30) и 60 дней лечения (Т60), далее по истечении 2-месячного периода наблюдения (Т120) (Буржио Г.Р. и соавт., 1994). Что касается инфекций нижних дыхательных путей, то существенная разница всегда была в пользу препарата ИМУНОРИКС. Между 1-м и 2-м месяцем лечения, то есть в период, когда было выявлено статистически значимое (p<0,05) снижение заболеваемости инфекциями, в группе ИМУНОРИКС показатели были лучше, чем в группе плацебо. Это отличие осталось таким же и в период наблюдения, на протяжении которого только 16% детей из группы принимавших ИМУНОРИКС отмечали инфекции нижних дыхательных путей, а в группе плацебо таких детей было 42,5% (p<0,05) (рис. 9).
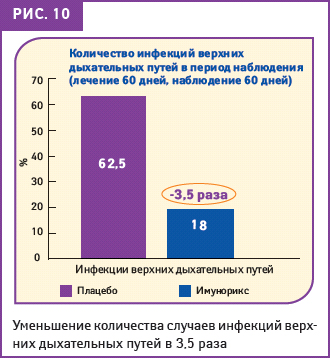
Аналогичные результаты были отмечены для инфекций верхних дыхательных путей. В данном случае интересно отметить, что в период наблюдения только у 18% пациентов, принимавших ИМУНОРИКС, были выявлены симптомы инфекций верхних дыхательных путей, а в группе плацебо (p<0,01) таких пациентов было 62,5% (рис. 10).
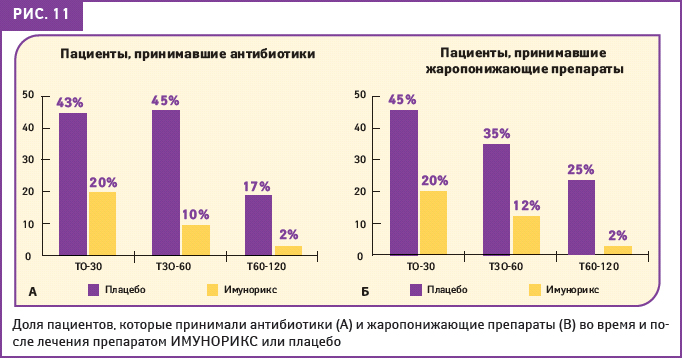
Что касается пациентов, которые вынуждены были принимать антибиотики и/или антипиретики для лечения острых эпизодов респираторных инфекций, возникших в период лечения и в период наблюдения, то разница между двумя группами всегда была значительной (рис. 11). Так, в течение 2 мес после лечения только 2% детей, принимавших ИМУНОРИКС, применяли жаропонижающие средства и антибиотики в связи с возникшим эпизодом острой инфекции.
В открытом контролируемом проспективном исследовании (Ди Филиппо С. и соавт., 1995) оценивали иммунотерапевтический эффект, который обеспечивает препарат ИМУНОРИКС, на примере пациентов, наблюдаемых в амбулаторных условиях, имеющих в анамнезе частые и рецидивирующие инфекции верхних и нижних дыхательных путей. В исследовании приняли участие 40 пациентов различного возраста (взрослых и детей) с наличием в анамнезе эпизодов фарингита и/или тонзиллита с высокой температурой тела не менее 5 раз в год. Все участники были рандомизированно поделены на 2 группы: принимавшие препарат ИМУНОРИКС и капсулированный лиофилизат лизатов из 8 бактерий; препараты применяли по следующей схеме:
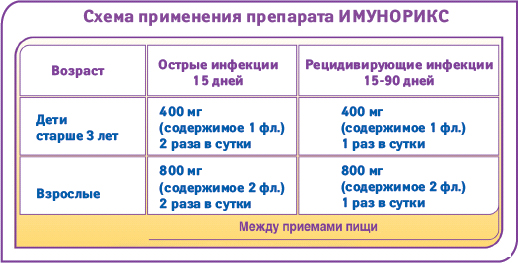
- ИМУНОРИКС (пидотимод): 800 мг/сут (взрослый) и 400 мг/сут (ребенок) в течение 60 дней;
- капсулированный лиофилизат 8 бактерий: 1 капсула в сутки по 7 мг (взрослый) или по 3,5 мг/сут (ребенок) в течение 10 дней в месяц, всего на протяжении 3 мес.
Контрольные осмотры проводили в 1-й день исследования, а также 3 мес спустя, что соответствовало 30 му и 20 му дню после прекращения лечения препаратами ИМУНОРИКС и капсулированный лиофилизат бактериальных лизатов соответственно. Таким образом, участников осматривал врач и оценивал иммунологические характеристики с помощью теста Мультитест-IMC. Данный тест основан на подкожном введении антигенов: при этом диаметр подкожных уплотнений коррелирует со степенью выраженности иммунитета.
Эффективность и безопасность иммуномодулятора ИМУНОРИКС доказана в 60 контролируемых рандомизированных клинических исследованиях, проведенных в Европе, с участием около 5700 пациентов
У участников исследования, получавших курс лечения ИМУНОРИКСОМ, выявили значительную статистически достоверную динамику в изменении индивидуальных иммунных реакций, чего не наблюдалось в группе больных, принимавших капсулированный лиофилизат лизатов из 8 бактерий. В группе ИМУНОРИКСА отмечали значительное увеличение количества и интенсивности положительных ответов в Мультитесте-IMC: 137 и 155% соответственно по сравнению с 14 и 28%, полученными при 3 месячном применении лиофилизата лизатов из 8 бактерий (рис. 12, А).
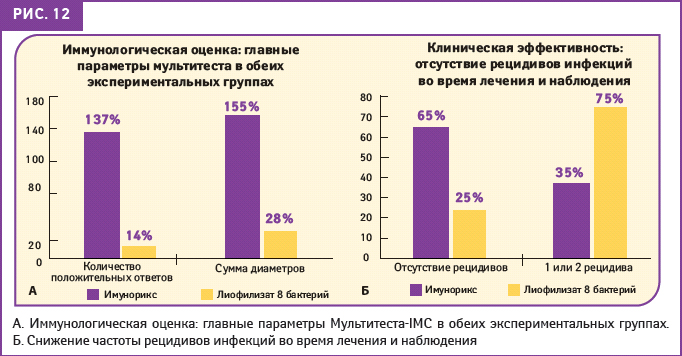
У 65% пациентов, принимавших ИМУНОРИКС, не было зарегистрировано рецидива инфекции в течение 3 мес наблюдения (по сравнению с 25% больных, принимавших капсулированный лиофилизат бактериальных лизатов) (рис. 12, Б).
У больных с аллергической патологией изучали безопасность и эффективность применения пидотимода у больных атопической бронхиальной астмой. Плацебо или пидотимод назначали по 800 мг 2 раза в сутки в течение 4 нед. Было установлено, что пидотимод не влияет на реактивность бронхов у больных бронхиальной астмой. Авторы также отмечают хорошую переносимость препарата (Vargas Correa J.B. et al., 2002). Использование пидотимода у детей с аллергическим ринитом и/или бронхиальной астмой в сочетании с частыми респираторными инфекциями позволило сократить количество и длительность респираторных инфекций. Обострений аллергических заболеваний за время лечения и наблюдения не отмечали (Gourgiotis D. et al., 2004).
Выявлено, что назначение пидотимода снижает экспрессию рецепторов CD30 на лимфоцитах детей с атопической бронхиальной астмой. Известно, что повышение экспрессии СD30 на Т-лимфоцитах ассоциируется с дифференцировкой Т-хелперов по Th2 типу. Таким образом, пидотимод может способствовать нормализации соотношения Th1/Th2 лимфоцитов у больных атопической бронхиальной астмой (Latza U. et al., 1999). Также в мире проводили исследования по применению пидотимода у детей с инфекцией мочевой системы, у больных с вирусными инфекциями, онкологическими заболеваниями.
Таким образом, эффективность и безопасность иммуномодулятора ИМУНОРИКС доказана в 60 контролируемых рандомизированных клинических исследованиях, проведенных в Европе с участием около 5700 пациентов. Установлен высокий профиль безопасности, когда частота побочных эффектов была на уровне плацебо.
Достоверно доказано снижение по сравнению с плацебо:
- длительности заболевания на 33,1% в течение 2 мес лечения;
- заболеваемости инфекциями нижних дыхательных путей в 2,5 раза;
- аболеваемости инфекциями верхних дыхательных путей в 3,5 раза;
- потребности в антибиотиках и жаропонижающих средствах на 40%;
- длительности лихорадочного состояния на 30%;
- количества рецидивов в 2,5 раза.
А также:
- отсутствие лекарственного взаимодействия;
- стойкое сохранение эффекта через 3 мес после лечения.
Препарат эффективен на всех этапах иммунного ответа как в острую фазу заболевания, так и при длительной иммунотерапии повторных респираторных инфекций.
Следовательно, на рынке Украины появился инновационный иммуномодулятор в удобной лекарственной форме (раствор для приема внутрь со вкусом лесных ягод) для иммунотерапии рецидивирующих респираторных бактериальных, вирусных и грибковых инфекций у часто болеющих пациентов старше 3 лет и взрослых, эффективность и безопасность которого соответствуют всем критериям доказательной медицины уровня А. С 1994 г. ИМУНОРИКС применяют в Италии. В настоящее время он зарегистрирован и применяется в странах Европы, Азии, Южной и Северной Америки. С успехом применяется в течение 2 лет в России, а также в странах СНГ.
Список литературы
Антипкін Ю.Г. із співавт. Сучасні підходи до діагностики, профілактики рецидивуючих і хронічних бронхітів у дітей. — К., 2003. — с. 122.
Бережной В.В. Иммунокоррекция в педиатрии//Здоров’я України. — 2004. — № 108.
Буржио Г.Р., Марселья Г.Л., Севери Ф. и соавт. Рецидивирующие респираторные инфекции в детском возрасте и иммуномодулирующая активность препарата Имунорикс® (пидотимод)//Arzneim. Forsch./Drug Res. — 1994. — 44 (II), 12a.
Ди Филиппо С., Варакалли С., Зардо Ф. Имунорикс® (пидотимод) при лечении рецидивирующих тонзиллофарингитов//Aсtamed Drug Review — 1995.
Казмирчук В.Е. Рецидивирующая бронхолегочная патология у детей: ошибки в диагностике и лечении с позиции клинического иммунолога//Клиническая иммунология. Аллергология. Инфектология. Спецвыпуск. — 2008. — № 5/2.
Середа Е.В. Бронхиты у детей: современные принципы терапевтической тактики//Фарматека. — 2002. — № 11 (62).
Намазова Л.С. Новые возможности иммуномодулирующей терапии часто болеющих детей//Практика педиатра. — 2008. — №1. — с. 78–82.
Annoni G., Arosio B., Santambrogio D. et al. Gene Expression for Interleukin-2 and Tumor Necrosis Factor-a in the Spleen of Old Rats under Physiological Condition and during Septic Shock//Arzneimittelfoschung. — 1994. — 44 (12A): 1433–1436.
Aivazis V., Halzimichail A., Papachristou A. et al. Clinical evaluation and changes of the respiratory epithelium function after administration of Pidotimod in Greek children with recurrent respiratory tract infections//Minerva Pediatr. — 2002. — 54 (4): 315–319.
Benetti G.P., Ieleni M.T., Passera A. et al. Ex vivo evaluation of Pidotimod activity in patients with chronic obstructive pulmonary disease//Arzneimittelfoschung. — 1994. — 44 (12A): 1503–1505.
Bisetti A., Ciappi G., Bariggi F. et al. Evaluation of the Efficacy of Pidotimod in the Exacerbations in Patients Affected with Chronic Bronchitis//Arzneimittelfoschung. — 1994. — 44 (12A): 1499–1502.
Caramia G., Clemente E., Solli R. et al. Efficacy and Safety of Pidotimod in the Treatment of Recurrent Respiratory Infections in Children//Arzneimittelfoschung. — 1994. — 44 (12A): 1480–1484.
Carredu P. Role of Immunoactivation with Pidotimod in Recurrent Respiratory Infections in Childhood//Arzneimittelfoschung. — 1994. — 44 (12A): 1506–1511.
Carredu P., Mei V., Venturoli V. et al. Pidotimod in the Treatment of Recurrent Respiratory Infections in Pediatric Patients//Arzneimittelfoschung. — 1994. — 44 (12A): 1485–1489.
Chiarenza A., Icerato M.P., Barbera L. et al. Modulating effects of the synthetic thymic dipeptide pidotimod on the immune system in the aging rat//Pharmacol. Toxicol. — 1994. — 74 (4–5): 262–266.
Ciaccia A. Pidotimod Activity against Chronic Bronchitis Exacerbations//Arzneimittelfoschung. — 1994. — 44 (12A): 1516–1520.
Coppi G., Falcone A., Manzardo S. Protective Effects of Pidotimod against Experimental Bacterial Infections in Mice//Arzneimittelfoschung. — 1994. — 44 (12A): 1417–1421.
De Martino et al. The child with recurrent respiratory infections: normal or not //J. Chemother. — 1991. — Vol. 18, p. 13–18.
De la Torre Gonzalez C., Pacheco Rios A., Escalante Domingues A.Y. et al. Comparative meta-analysis of immunostimulant agents used in pediatric patients in Mexico//Rev. Allerg. Mex. — 2005. — 52 (1): 25–38.
Di Marco R., Condorelli F., Girardello R., et al. Increased rate of survival in Streptococcus pneumoniae — infected rats treated with the new immunomodulator Pidotimod//Scand. J. Infect. Dis. — 1992. — 24 (6): 82–83.
Dianzani C., Colangelo D., Tonso E. et al. In vivo Antiviral Effects of Pidotimod//Arzneimittelfoschung. — 1994. — 44 (12A): 1431–1433.
Gourgiotis D., Papadopulos N.G., Bossios A. et al. Immune modulator pidotimod decreases the in vitro expression of CD30 in peripheral blood mononuclear cells of atopic asthmatic and normal children//J. Asthma. — 2004. — 41 (3): 285–287.
Latza U., Davis S., Wilhelm D. et al. Soluble cytokine receptor CD30 in atopic disorders: a case-control study//Clin. Exp. Allergy. — 1999. — 29 (1): 97–104.
Maillard F. Introductory Overview//Arzneimittelfoschung. — 1994. — 44 (12A):1399–1401
Migliorati G., Di Adamio L., Coppi G. et al. Pidotimod stimulates natural killer activity and inhibits thymocyte cell death//Immunopharmacol. Immunotoxicol. — 1992. — 14 (4): 737–748.
Passali D., Calearo C., Conticello S. et al. Pitodimod in the Management of Recurrent Pharyngotonsillar Infections in Childhood//Arzneimittelfoschung. — 1994. — 44 (12A): 1511–1516.
Pozzi E., Dolatti A., Orlandi O. et al. Pidotimod in the Treatment of Patients Affected by Bacterial Exacerbations of Chronic Bronchitis//Arzneimittelfoschung. — 1994. — 44 (12A): 1495–1498.
Taramelli D., Malaborba M.G., Basilico N. et al. Effects of Pidotimod on Macrophage Functions in Methylprednisolone-treated Mice//Arzneimittelfoschung. — 1994. — 44 (12A): 1425–1430.
Vargas Correa J.B., Espinosa Morales S., Bolanos Ancona J.C. et al. Pidotimod in recurring respiratory infection in children with allergic rhinits, asthma, or both conditions//Rev. Alerg. Mex. — 2002. — 49 (2): 27–32.


Коментарі