
MEA — це угоди між фармацевтичним виробником, постачальником та платником медичних послуг (державою, страховим фондом), які застосовуються з метою забезпечення доступу пацієнтів до інноваційних медичних технологій — схем діагностики, профілактики, лікування. Укладаються вони в разі, коли у зв’язку з коротким терміном виведення на ринок препарату ще не накопичено достатньо доказів про його доведену ефективність, клінічні переваги, немає оцінок впливу на якість життя тощо.
Такі угоди використовують для забезпечення більш швидкого доступу до нових потенційно вигідних технологій охорони здоров’я, для отримання найкращого показника «витрати–ефективність» та забезпечення доступності для більшої когорти пацієнтів високовартісних і високотехнологічних препаратів.
Теоретичні основи методів МЕА розроблені провідними фармакоекономістами Лондонської школи економіки, Міжнародного товариства фармакоекономічних досліджень — ISPOR, експертами з ВООЗ [1–4].
У європейській моделі фінансування охорони здоров’я основним є готовність і здатність виробників, платників і керівників агентств з оцінки технологій охорони здоров’я (Health Technology Assessment — НТА) знайти стабільні рішення щодо ціни та розміру відшкодування витрат на лікарські засоби. Робиться це з метою полегшення раннього доступу пацієнтів до інноваційних, ефективних препаратів, які є високовартісними, проте забезпечують поліпшення якості життя, зниження показників інвалідизації, смертності тощо.
Європейська комісія може видавати дозвіл на маркетинг лише після того, як Європейське агентство з лікарських засобів (European medicines agency — ЕМА) затверджує реєстраційне досьє на інноваційний препарат, враховуючи дані клінічних досліджень про якість, безпеку та ефективність препарату.

Методи МЕА доцільно застосовувати у системі НТА при оцінці витрат на схеми лікування, враховуючи декілька показників. Наприклад, показник про ефективність, результати лікування, вплив на якість життя, а також вплив на бюджет країни при впровадженні інноваційного препарату для економії витрат у системі охорони здоров’я на перспективу. Аналіз літератури показав, що не існує єдиного підходу до формування МЕА для лікарських засобів. Так, кожна країна визначає власну політику проведення МЕА та оприлюднення даних для фахівців охорони здоров’я.
У європейських країнах, таких як Італія, Великобританія та Швеція, інформація про препарати, які включені в МЕА, є публічною і доступна на сайтах агентств з НТА.
У Бельгії та Франції зміст угод є конфіденційним для усіх зацікавлених сторін. У Чеській Республіці зміст МЕА конфіденційно обговорюється між компаніями-заявниками та Союзом страхових фондів, який відповідає за відшкодування коштів. У Чехії передбачається конфіденційна знижка на інноваційний препарат, тобто декларація ціни виробником, за якою лікарський засіб буде надаватися для страхового забезпечення. Термін договору, як правило, становить 3 роки, продовження договору здійснюється на основі даних про досвід застосування (ефективність препарату) інших країн та на основі проведених досліджень ефективності та безпеки препарату.
У Франції для кожного засобу визначаються обсяги постачання (реалізації) та пов’язані з ними фінансові оплати. Витрати на лікування встановлені відповідно до угоди, якщо компанія їх перевищила, вона повертає кошти. Ціна на інноваційний препарат затверджується на державному рівні. Якщо після досліджень засіб отримує кращу оцінку, то ціна зберігається, якщо ні — компанія відшкодовує різницю у ціні.
У Італії метод МЕА у більшості затверджених агентствами з НТА базується на показниках ефективності лікарського засобу, які накопичуються в процесі застосування. Перший курс препарату повністю фінансується виробником для визначеної когорти пацієнтів, які відповідають вимогам, прописаним в МЕА.
Тобто у МЕА вказуються тривалість курсу та характеристики пацієнтів, які будуть отримувати схему лікування за МЕА (вік, стать пацієнта, стадія, тривалість основного захворювання, супутні патології тощо). Також визначаються ціна препарату та вартість, яка відшкодовується Національною службою охорони здоров’я. Рішення про встановлення ціни та відшкодування витрат повторно переглядається через 2 роки (24 міс), на основі кожної конкретної МЕА для конкретного препарату. Проте термін МЕА може змінювати, наприклад, при невідповідності заявленої виробником ефективності інноваційного препарату для когорти пацієнтів протягом першого року.
У Литві метод МЕА застосовується, коли витрати на відшкодування інноваційного препарату є вищими порівняно з аналогічними за дією засобами.
У Великобританії використовують метод МЕА для схем доступу, за допомогою яких фармацевтична компанія та департамент охорони здоров’я спільно з Національним інститутом здоров’я і клінічної досконалості NICE (який є найбільш авторитетним агентством з НТА у світі) надають фінансовий доступ пацієнтам до інноваційних ліків. Ці препарати мають належний показник «витрати–ефективність» відповідно до затверджених критеріїв і показників (граничний рівень фінансування на 1 рік, враховуючи показник якості життя — QALY).
У Швеції діє національний реєстр угод, який фінансується урядом на основі звітів від Національної ради з питань охорони здоров’я (Агентства з НТА), що подає обґрунтовані дані про обсяги використання препаратів у кількості упаковок та відповідних витрат.
Дані літератури свідчать, що за АТС-класифікацією інноваційні ліки, на які затверджено МЕА, найчастіше є антинеопластичними та імуномодулюючими засобами для лікування тяжких стадій онкологічних захворювань. Вони займають 37,8% від усієї кількості МЕА.
Ці групи препаратів впроваджуються з використанням методології МЕА у країнах ЄС. Основні результати аналізу, які препарати за АТС-класифікацією включені в МЕА у країнах ЄС, наведено на рисунку.
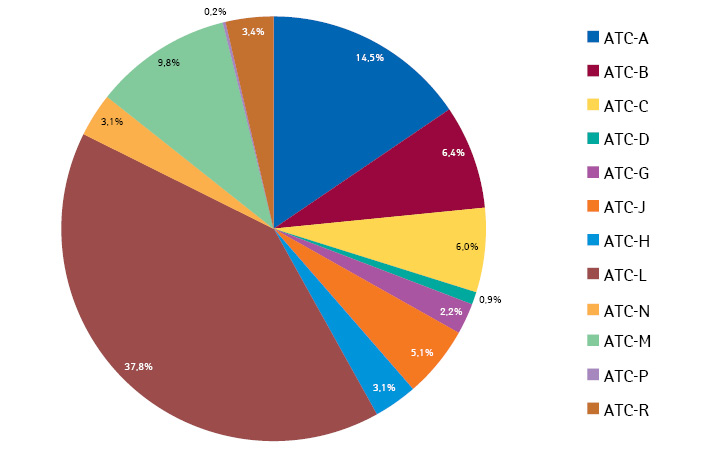
Як свідчать дані, найчастіше у МЕА включені інноваційні засоби, що впливають на травну систему і метаболізм, — 14,5%, засоби, що діють на нервову систему, — 9,8%, засоби, що впливають на систему крові та гемопоез, — 6,4%.
Враховуючи досвід країн ЄС, можна констатувати, що методи МЕА впроваджують задля забезпечення доступу пацієнтів до ефективного лікування інноваційними препаратами та доступності лікарських засобів шляхом фінансування витрат виробником та замовником (державою, фондами страхування), для раціонального використання коштів на основі даних НТА з метою покращання фармацевтичної допомоги населенню та підвищення якості життя й результатів лікування.
доктор фармацевтичних наук, професор, завідувач кафедри ОЕФ,
технології ліків та фармакоекономіки факультету післядипломної освіти
Львівського національного медичного університету ім. Данила Галицького,
Христина-Ольга Ярославівна Стасів, асистент

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим