
Лекарственное средство биологического происхождения может получить разрешение на маркетинг FDA в качестве оригинального, биоподобного (biosimilar) или взаимозаменяемого (interchangeable). Оригинальное одобряют на основе полного профиля неклинических и клинических данных, демонстрирующих его безопасность и эффективность. Биоподобное — с частичной опорой на досье референтного (оригинального), поэтому:
- биоаналогичный и оригинальный (референтный) препараты очень похожи, несмотря на незначительные различия в составе вспомогательных веществ, при этом
- клинически значимые различия между ними в отношении безопасности, чистоты и силы действия отсутствуют.
Определение препарата как взаимозаменяемого с референтным означает, что он не только биоподобен ему, но и дает тот же клинический результат. Кроме того, риск в отношении безопасности или снижения эффективности при чередовании или переключении между биоподобным и референтным препаратами не выше, чем риск использования референтного продукта без такого чередования или переключения.
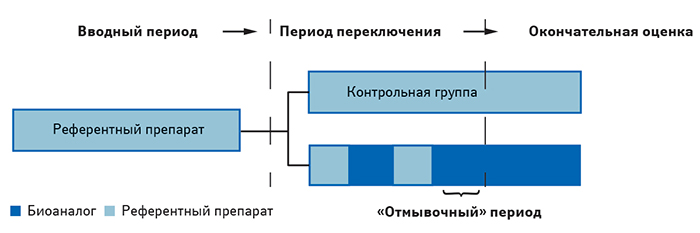
В США пока не утверждено ни одного взаимозаменяемого биоаналога, но «Boehringer Ingelheim», к примеру, уже заявила о начале исследования взаимозаменяемости своего биоаналогичного адалимумаба. Соответствующим руководством компаниям настоятельно рекомендовано использовать «переключение» при проведении клинических исследований (рис. 1). Этим дизайном предусмотрено две смены препаратов, то есть все участники при включении начинают с референтного, после чего в основной группе переходят на биоаналог, затем снова на референтный и заканчивают биоаналогом (минимум 3 переключения). В контрольной группе участники будут принимать референтный продукт в течение периода исследования. Критически важно, что основными параметрами сравнения являются фармакокинетические (ФК) и фармакодинамические (ФД), а не клинические (которые FDA считает менее чувствительными). Это существенно снижает затраты на проведение исследований.
Биоаналог — не генерик?
Активные ингредиенты биологических препаратов представляют собой более крупные и сложные молекулы, чем у низкомолекулярных веществ. Их обычно производят в живой системе, такой как микроорганизм, животная или растительная клетка. Эта повышенная сложность объясняет, почему биоаналоги регулируются иначе, чем генерики, и почему закон допускает некоторые различия между биосимиляром и референтным продуктом. При этом биоаналог должен иметь аналогичные эталонному продукту лекарственную форму, способ введения и силу действия.
Какие данные необходимы для одобрения биоподобного или взаимозаменяемого продукта?
Для разрешения на маркетинг нужны данные, демонстрирующие биоаналогичность (рис. 2):
- аналитические исследования, допускающие незначительные различия с референтным;
- исследования in vivo, включая оценку токсичности;
- клинические исследования, обычно включающие оценку иммуногенности, ФК и, возможно, ФД, иногда — сравнительные клинические исследования эффективности.
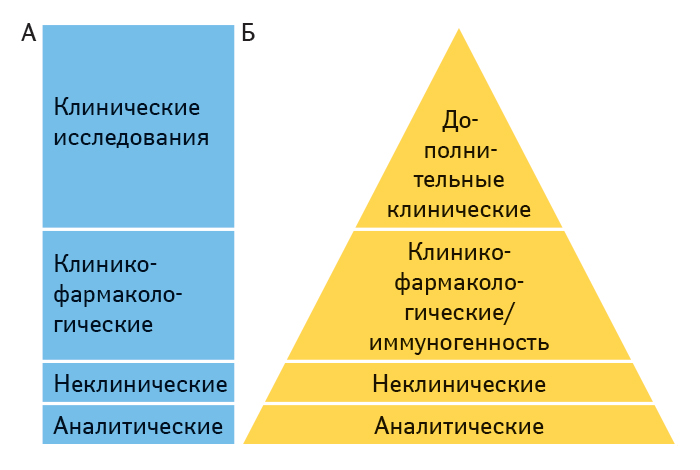
и безопасности оригинального пре- парата и (Б) «сокращенная» (abbreviated) — для подтверждения биоаналогичности (возможно, наряду со вз имозаменяемостью) биоаналога (www.fda.gov)
FDA требует подавать вначале аналитические данные для оценки сходства структуры и функции биоаналога и референтного продукта. После того, как проведут исследования ФК/ФД, будут планировать дальнейшие клинические исследования. Кроме того, если известно, к примеру, что для референтного продукта характерна повышенная частота развития иммунных реакций, FDA, вероятно, потребует более тщательной оценки иммуногенности бионалога.
Показания и назначения
Биоаналог может быть одобрен без непосредственного изучения применения по каждому показанию. Эта концепция называется «экстраполяция» и имеет решающее значение для целей сокращенного досье — достижение искомых результатов при потенциально более низких затратах. А уж если клиницист назначит биоподобный препарат по показанию, которого нет ни у него, ни, следовательно, у оригинального продукта, это будет его собственным решением, за которое он несет ответственность. Медицинскую практику FDA не регулирует.
Как только в США появятся взаимозаменяемые биологические продукты, некоторые штаты могут разрешить замену эталонного продукта взаимозаменяемым — практика, обычно называемая заменой на уровне аптеки. Пациент может рассчитывать на то, что биоаналог будет действовать в организме так же, как и оригинальный препарат. Наличие биоподобных и взаимозаменяемых биологических продуктов может предоставить больше вариантов лечения для пациентов и снизить соответствующие затраты.
Экономический эффект
В опубликованной FDA «Фиолетовой книге» («Purple Book»), носящей, подобно «Оранжевой», официальное название «Списки одобренных биологических продуктов с указанием эксклюзивности реферетных продуктов и оценками биоподобности или взаимозаменяемости» (Lists of Licensed Biological Products with Reference Product Exclusivity and Biosimilarity or Interchangeability Evaluations), содержится актуальная информация о биоаналогах. Книга состоит из двух перечней — биопрепаратов, одобренных центрами оценки и исследований (Center for Biologics Evaluation and Research — CBER), и лекарственных средств (Center for Drug Evaluation and Research — CDER) (рис. 3).
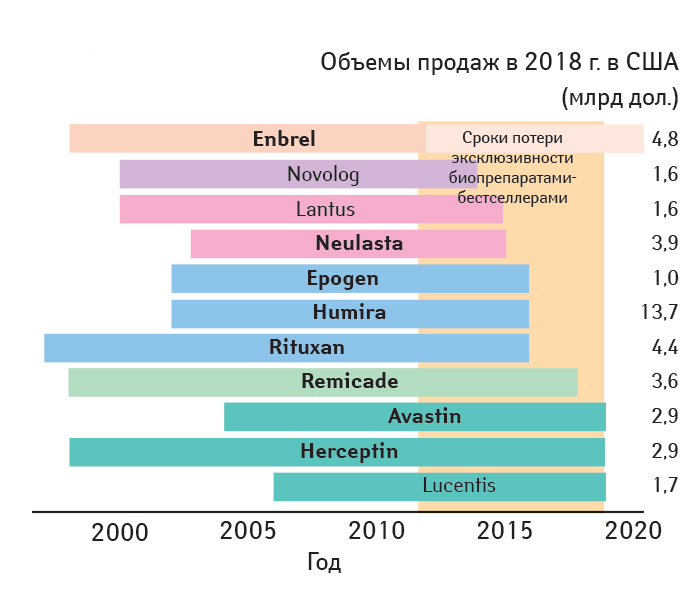
В настоящее время FDA одобрено 23 биоаналога с 9 действующими веществами (cм. рис. 3 плюс аналог Neupogen, не имеющий статуса блокбастера), однако на рынок выведено не больше 10. Предполагаемая потенциальная прямая экономия средств в результате внедрения биоаналогов оценена в размере 54,0 млрд дол. США за 10 лет, или около 2,8% общего объема продаж биологических препаратов за тот же период (Mulcahy A.W. et al., 2018).
Именно биопрепараты по большей части ответственны за повышение расходов на лекарства на 70% в период 2010–2015 гг., в то время как расходы США на рецептурные лекарственные средства повысились на 4,8% до 323 млрд дол. с 2015 по 2016 г. В 2015 г. доля биологических препаратов в этих расходах составила 38% из-за их высокой стоимости.
по материалам www.fda.gov; www.drugs.com; lab.express-scripts.com

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим