Европейское агентство по лекарственным средствам (European Medicines Agency — EMA) опубликовало 21 января обзор своих ключевых рекомендаций в 2020 г. по разрешениям на маркетинг и мониторингу безопасности лекарственных средств для использования людьми.
В 2020 г. EMA рекомендовало к одобрению 97 лекарственных средств, из них 39 — с новым действующим веществом, одна вакцина и одно лекарство от COVID-19, а также препарат для использования в странах за пределами ЕС. В 2019 г. результаты были скромнее: всего 66 препаратов, из которых 30 — с новыми действующими веществами. При этом наибольшее количество одобренных препаратов с новыми действующими веществами предназначены для лечения онкологических (11), инфекционных (7), гематологических заболеваний (5) и иммунопрофилактики (вакцины, 4). При этом 6 продуктов проходили по ускоренной процедуре:
- Blenrep (белантамаб мафодотин-blmf) для лечения множественной миеломы;
- Enhertu (фам-трастузумаб дерукстекан) для лечения HER2-положительного метастатического рака молочной железы;
- Givlaari (гивосиран) для лечения острой печеночной порфирии у взрослых и подростков;
- Oxlumo (люмасиран) для лечения первичной гипероксалурии 1-го типа;
- Zabdeno и Mvabea (вакцины для профилактики болезни Эбола, вызванной эболавирусом Заира, у взрослых и детей в возрасте от 1 года и старше; предназначены для двухдозового режима: сначала Zabdeno, затем — Mvabea).
«ЕС-лекарства для всех»
Комитет по лекарственным средствам для применения у человека (Committee for Medicinal Products for Human Use — CHMP) ЕМА принял положительное заключение относительно Dapivirine Vaginal Ring (дапивирин), применяемого для снижения риска заражения вирусом иммунодефицита человека типа 1 (ВИЧ-1). Это — одиннадцатое лекарственное средство, рекомендованное EMA в рамках действующей с 2004 г. процедуры под названием «EU-Medicines for all» или «EU-M4all», ранее известной как процедура по статье 58 (правовой основой является статья 58 Регламента (ЕС) № 726/2004. CHMP оценивает лекарства и вакцины в соответствии с этой процедурой на соответствие тем же строгим стандартам, что и лекарства, предназначенные для применения в Европе, при этом взимают такие же сборы, как за участие в централизованной процедуре. Результатом становится публикация EMA своего заключения о соотношении пользы и риска, цель которого — облегчить преквалификацию лекарства ВОЗ и регистрацию в целевых странах. В перечне из 10 ранее одобренных препаратов — 3 антиретровирусных, 1 противомалярийное, 1 антигельминтное средство, 3 вакцины (противомалярийная, а также 6- и 4-валентные для профилактики детских инфекций от «Sanofi Pasteur» и «GlaxoSmithKline Biologicals»), антисептическое средство для обработки пупочной ранки и мизопростол для предупреждения послеродовых кровотечений. Препараты, участвовавшие в данной процедуре, регистрируют затем преимущественно в странах с уровнем дохода ниже среднего, в том числе Украине (рисунок).
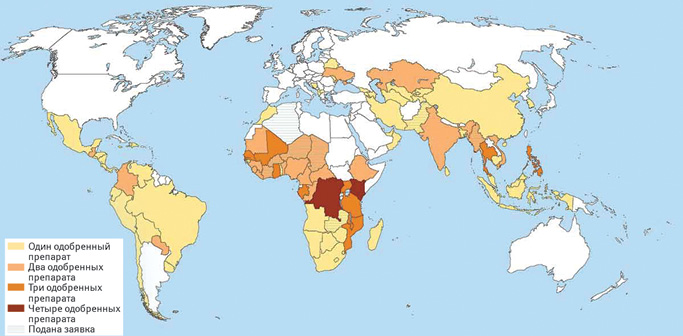
В I кв. 2021 г. EMA планирует завершить работу над руководящим документом по данной процедуре (Public guidance parallel application EU m4all).

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим