«Учитывая респираторный тропизм вируса, удивительно, что только 7 из почти 100 вакцин, которые в настоящее время проходят клинические исследования, вводятся в нос», — отметили Фрэн Лунд (Fran Lund) и Трой Рэндалл (Troy Randall), авторы статьи в Science с красноречивым названием «Запах вакцины»*.
Данный способ вакцинации дает два дополнительных уровня защиты по сравнению с внутримышечными прививками, потому что обеспечивает выработку: 1) иммуноглобулина А и резидентных В- и Т-клеток памяти в слизистой оболочке дыхательных путей, которые являются эффективным барьером для инфекции в этих местах, и 2) перекрестно-реактивных резидентных В- и Т-клеток памяти, которые могут реагировать раньше, чем другие (рисунок).
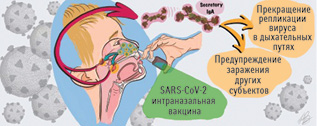
Преимущества интраназальных вакцин включают безыгольчатое введение, доставку антигена к месту инфекции и выработку иммунитета слизистой оболочки дыхательных путей. Опасения вызывают антивекторные антитела, которые ухудшают доставку иммуногенного материала, а также риск реверсии живого ослабленного вируса SARS-CoV-2. При том, что данный риск — минимальный, живая вакцина, вероятно, будет противопоказана младенцам, лицам в возрасте старше 49 лет и пациентам с ослабленным иммунитетом, полагают авторы. В статье также рассмотрены индивидуальные преимущества и проблемы каждой из 7 интраназальных вакцин-кандидатов, находящихся на 1-й фазе исследований (таблица).
| Таблица | Данные о текущих клинических исследованях вакцин-кандидатов для интраназального введения |
| Название (количество доз) | Спонсор | Тип | Номер по clinicaltrials.gov, тип и дата первичного окончания |
| MV-014-212(одна и две дозы) | Meissa Vaccines, Inc. (США) | Живая аттенуированная респираторно-синцитиальная вирусная векторная вакцина, экспрессирующая спайк-белок SARS-CoV-2 | NCT04798001 — 1-й фазы, открытое, три режима доз (31 октября 2022 г.) |
| DelNS1-nCoV-RBD LAIV(две дозы) | The University of Hong Kong | Генно-инженерный живой аттенуированный вирус гриппа, экспрессирующий рецепторсвязывающий домен (RBD) спайк-белка SARS-CoV-2 | NCT04809389 — 1-й фазы, рандомизированное двойное слепое с повышением дозы (сентябрь 2022 г.) |
| ChAdOx1 nCov-19 (одна и две дозы) | University of Oxford | Векторная на основе аденовируса шимпанзе, несущего спайк-белок SARS-CoV-2 | NCT04816019 — 1-й фазы, открытое, три режима доз (февраль 2022 г.) |
| AdCOVID (одна и две дозы) | Altimmune, Inc. (США) | Векторная на основе аденовируса 5-го типа | NCT04679909 — 1-й фазы, двойное слепое рандомизированное плацебо-контролируемое, три режима доз (февраль 2022 г.) |
| BBV154 (одна и две дозы) | Bharat Biotech International Limited | На основе аденовирусного вектора с дефицитом репликации, экспрессирующего стабилизированный спайковый белок SARS-CoV-2 | NCT04751682 — 1-й фазы, двойное слепое рандомизированное плацебо-контролируемое (25 июня 2021 г.) |
| COVI-VAC (одна и две дозы) | Codagenix, Inc (США) | Живая аттенуированная | NCT04619628 — 1-й фазы, рандомизированное двойное слепое плацебо-контролируемое с повышением дозы, три режима доз (июнь 2021 г.) |
| MAMBISA (две вакцины-кандидата) | Центр генной инженерии и биотехнологии (Center for Genetic Engineering and Biotechnology — CIGB) (Куба) | Субъединичные, на основе RBD спайк-белка SARS-CoV-2 | RPCEC00000345 (MAMBISA) — 1-й/2-й фаз, рандомизированное в параллельных группах (31 мая 2021 г.) |
В апреле 2021 г., по сообщению Роспатента, Центр имени Гамалеи получил патент на интраназальную вакцину от коронавируса. Также в 2021 г. собираются завершить доклинические исследования вакцины в виде кисломолочного продукта (йогурта). По словам директора института, препарат состоит из пробиотических микроорганизмов, которые содержат фрагменты генов патогена.
20 июня Meissa Vaccines, Inc. доложила на международной конференции о результатах исследования in vivo своей живой аттенуированной вакцины и приступила к клиническому исследованию.
30 июня американская Codagenix опубликовала доклинические данные о своей вакцине, что совпало с окончанием 1-й фазы клинического исследования вакцины, где были продемонстрированы ее безопасность и хорошая переносимость. Эти данные подчеркивают перспективность новой платформы вакцины Codagenix, которая сочетает технологию деоптимизации кодонов с проверенным подходом к живой аттенуированной вакцине для создания рациональных, безопасных, эффективных и легко применяемых вакцин, способных удовлетворить насущные глобальные потребности здравоохранения.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим