Підсумки 2020 р.
За підсумками 2020 р. ЕМА рекомендовано до схвалення 97 препаратів (що є рекордною цифрою за останні 10 років) (рис. 1). Серед них, зокрема, Zolgensma для лікування немовлят та дітей зі спинно-м’язовою атрофією, Givlaari — перший препарат для лікування дорослих та підлітків з гострою печінковою порфірією, Enerzair Breezhale — потрійна комбінація для застосування при астмі та ін.
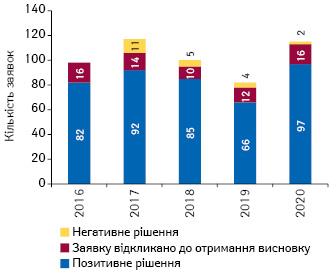
З 97 схвалених препаратів 22 отримали статус орфанного. 6 препаратів отримали допуск на ринок за прискореною експертизою: Blenrep, Enhertu, Givlaari, Mvabea, Oxlumo та Zabdeno. 13 препаратів отримали умовний дозвіл на маркетинг — Adakveo, Ayvakyt, Blenrep, Comirnaty, Enhertu, Hepcludex, Idefirix, Dovprela, Retsevmo, Rozlytrek, Tecartus, а також Veklury та Zolgensma (рис. 2).
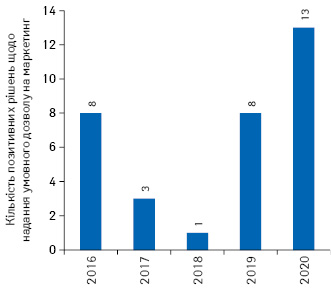
Схвалено 8 препаратів — учасників програми Priority Medicines (PRIME): Blenrep, Givlaari, Hepcludex, Idefirix, Oxlumo, Rozlytrek, Tecartus та Zolgensma.
PRIME
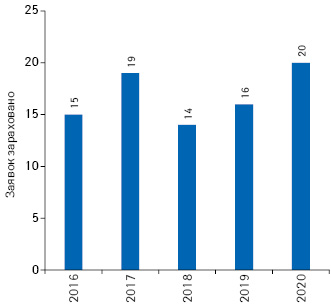
Ініціатива PRIME стартувала у березні 2016 р. на підтримку розвитку лікарських засобів для пацієнтів, які не мають варіантів лікування або їх вибір дуже обмежений. Допуск до програми надається для найбільш перспективних кандидатів у препарати, які мають потенціал принести значну терапевтичну перевагу. У 2020 р. до програми зараховано 20 кандидатів у препарати (рис. 3).
Підтримка малих та середніх компаній
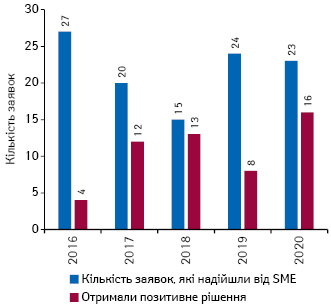
Малі та середні дослідницькі компанії (small and medium-size enterprise — SME) вважаються драйвером інновацій в ЄС. ЕМА їх підтримує, зокрема, у регуляторних та адміністративних питаннях, надає рекомендації та настанови. У 2020 р. агентство отримало 222 запити щодо роз’яснення адміністративних та регуляторних аспектів. За підсумками року від SME надійшло 23 заявки на маркетування (більшість стосуються препаратів для лікування пацієнтів з орфанними захворюваннями), з них 16 отримали позитивний висновок, що є найбільшою цифрою за останні 5 років (рис. 4).
Інспекції: GMP, GCP, фармаконагляд
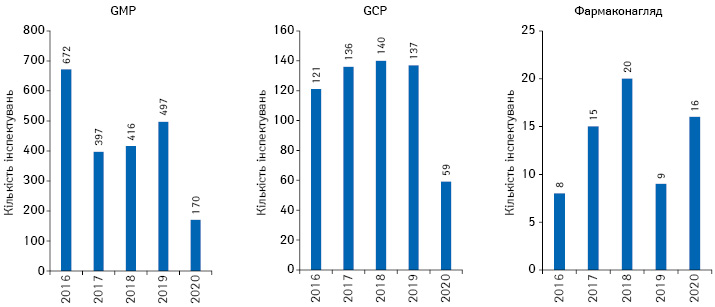
На фоні пандемії коронавірусу у 2020 р. помітно зменшилася кількість запитів на проведення інспектувань у рамках реєстрації за централізованою процедурою ЕМА: на відповідність виробництва лікарських засобів вимогам Належної виробничої практики (Good manufacturing practice — GMP), нормам Належної клінічної практики (Good Clinical Practice). У 2020 р. було проведено 170 інспекцій на відповідність GMP та 59 — GCP. Також за підсумками минулого року проведено 16 інспектувань систем фармаконагляду (рис. 5).
Brexit
Великобританія офіційно вийшла з ЄС 31 січня 2020 р. З травня 2017 р. ЕМА, Європейська Комісія та національні регуляторні органи країн — членів ЄС тісно співпрацювали з метою мінімізації впливу Brexit на систему постачання ліків. Кропітка робота тривала впродовж усього перехідного періоду. Одним з основних наслідків Brexit для ЕМА стала втрата британських експертів, адже Великобританія більше не може брати участь у засіданнях наукових комітетів або робочих груп агентства.
У січні 2020 р. ЕМА завершила переїзд з Лондона до нової штаб-квартири в Амстердамі.
COVID-19: відповідь на пандемію
«2020 р. запам’ятається як рік, коли пандемія COVID-19 охопила весь світ. Як орган, відповідальний за регулювання обігу лікарських засобів, ЕМА відіграє важливу роль у забезпеченні легалізації ліків та вакцин для боротьби з цією новою хворобою якомога швидше, не жертвуючи при цьому стандартами щодо ефективності, безпеки та якості. Тільки-но штаб-квартира ЕМА перемістилася до Амстердаму, спалах пандемії коронавірусу змусив агентство перевести роботу у віддалений режим, а також переглянути пріоритетність планів відповідно до актуальних потреб охорони здоров’я. ЕМА створено гнучку інфраструктуру та мобілізовано європейський досвід для забезпечення швидкого прийняття рішень, у тому числі за допомогою створення Робочої групи з COVID-19 (COVID-ETF). Основним інструментом для прискорення оцінки препаратів та вакцин проти COVID-19 стало застосування поступової експертизи реєстраційного досьє (rolling reviews)», — зазначила Емер Кук (Emer Cooke), новий виконавчий директор ЕМА (у червні 2020 р. вона змінила на цій посаді Гвідо Разі (Guido Rasi), який очолював агентство протягом останніх 9 років).
У 2020 р. вірус SARS-CoV-2 принципово змінив підходи до роботи та взаємодії між людьми та поставив серйозний виклик перед науковою спільнотою. Безпрецедентна мобілізація сил та обмін інформацією між академічними колами, фарміндустрією, регуляторними органами, професіоналами охорони здоров’я, пацієнтськими організаціями сприяли схваленню в ЄС першої вакцини проти цього нового захворювання вже у грудні 2020 р.
У зв’язку з обмеженням доступу осіб, не хворих на COVID-19, до закладів охорони здоров’я, необхідно було внести зміни до протоколів лікування пацієнтів з певними захворюваннями. Розробники лікарських засобів потребували термінових рекомендацій, як проводити клінічні дослідження в ситуації, коли учасники мали залишатися вдома та не могли відвідувати лікарні.
З початку пандемії ЕМА вжило заходів з адаптації реєстраційних процедур для забезпечення схвалення лікарських засобів та вакцин у найкоротші терміни.
Також разом з Європейською мережею регулювання лікарських засобів (European medicines regulatory network — EMRN) ЕМА відігравало важливу роль у реагуванні ЄС на пандемію коронавірусу.
25 років EMA
У 2020 р. ЕМА відсвяткувало 25-річний ювілей з моменту створення агентства 26 січня 1995 р. Умови роботи за ці роки зазнали фундаментальних змін з точки зору наукового, технологічного, регуляторного та соціального аспектів. Але місія залишилася незмінною — об’єднати найкращих експертів з країн — членів ЄС для забезпечення надійної системи оцінки препаратів та нагляду за їх обігом.
У 2020 р. виповнилося, зокрема, 20 років із запровадження законодавства у сфері регулювання орфанних препаратів (за ці 20 років статус орфанного надано 2,3 тис. препаратів для лікування рідкісних захворювань), 15 — із запровадження Регламенту Європейської Комісії № 2049/2005, яким встановлено правила оплати зборів та отримання адміністративної підтримки від ЕМА малим і середнім підприємствам. Основні віхи історії ЕМА відображено в таблиці.
| Таблиця | Ключові віхи історії ЕМА |
| Рік | Ключові віхи |
| 1995 | Заснування агентства |
| 2000 | Запровадження законодавства у сфері регулювання орфанних препаратів |
| 2004 | Оновлення законодавства щодо фармсектору |
| 2005 | Регламент Європейської Комісії № 2049/2005 |
| 2006 | Схвалено перші біосиміляри |
| 2010 | Розроблено нові правила з фармаконагляду |
| 2011 | Директива 2011/62/EU |
| 2012 | Схвалено першу генну терапію |
| 2014 | Схвалено першу клітинну терапію |
| 2016 | Поява у відкритому доступі даних клінічних досліджень |
| 2018 | Схвалено перші препарати CAR-T-клітинної терапії |
| 2019 | Схвалено вакцину проти вірусу Ебола |
| 2020 | Зміна штаб-квартири |
Доступ до клінічних даних
З жовтня 2016 р. агентство надає відкритий онлайн-доступ до клінічних даних нових лікарських засобів, схвалених для застосування у людини на території ЄС (clinicaldata.ema.europa.eu). За даними 2020 р., нараховується більше 8 тис. унікальних користувачів ресурсу. За підсумками минулого року зафіксовано 91 тис. переглядів документів та 922 тис. завантажень.
Європейський союз охорони здоров’я
Європейська Комісія переконана, що для боротьби з нинішньою загрозою пандемії коронавірусу та майбутніми надзвичайними ситуаціями у сфері охорони здоров’я необхідно посилити координацію зусиль на рівні ЄС та бере курс на формування Європейського союзу охорони здоров’я (European Health Union). Висувається ряд пропозицій щодо посилення системи санітарно-епідеміологічної безпеки та реагування на кризи ключовими агентствами ЄС. За ЕМА пропонується закріпити повноваження, які агентство добровільно взяло на себе у відповідь на загрозу COVID-19, зокрема координацію дефіциту критично важливих лікарських засобів та екстрене створення наукової робочої групи, яка може швидко допомогти розробникам кандидатів у препарати під час надзвичайних ситуацій у сфері охорони здоров’я.
Також Європейська Комісія пропонує доручити ЕМА моніторинг та управління дефіцитом критично важливих медичних виробів, а також організацію роботи експертних груп, відповідальних за проведення клінічної оцінки та надання рекомендацій щодо медичних виробів, які пов’язані з високим ризиком та призначених для діагностики in vitro.
Regulatory Science Strategy to 2025
У відповідь на значне прискорення темпів появи інновацій та необхідність регуляторів підтримувати розробку все більш складних препаратів ЕМА розроблено та прийнято у 2020 р. стратегію, спрямовану на створення більш адаптивної системи регулювання — Regulatory Science Strategy to 2025.
Під Regulatory Science мається на увазі коло наукових дисциплін, які застосовуються для оцінки якості, безпеки та ефективності лікарських засобів і служать основою для прийняття регуляторних рішень протягом усього життєвого циклу ліків.
Один з перших результатів реалізації цієї стратегії полягає у впровадженні нової, більш гнучкої, маневреної організаційної структури. Зокрема, всі види діяльності, що стосуються лікарських засобів для застосування у людини (надання настанов та рекомендацій щодо розробки ліків, дозволу на маркетинг, здійснення фармаконагляду) інтегровано в один відділ — Human Medicines Division.
Ця стратегія також пов’язана зі Стратегію співпраці мережі європейських регуляторних органів з лікарських засобів на 2020–2025 рр. (EU Medicines Agencies Network Strategy 2020–2025), що визначає бачення стосовно забезпечення постачання безпечних та ефективних лікарських засобів в умовах розвитку науки, медицини, цифрових технологій, а також глобалізації та враховуючи поточні загрози громадському здоров’ю, у тому числі пандемію коронавірусу, антимікробну резистентність та ін. Шість пріоритетних напрямків стратегії включають:
1) доступність ліків;
2) аналіз даних, цифрові інструменти та цифрова трансформація;
3) інновації;
4) виклики охорони громадського здоров’я;
5) виклики в ланцюгах поставок лікарських засобів;
6) стійкість мережі та високий професіоналізм.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим