 Есть ли разница между Losec® (омепразол) и Lasixтм (фуросемид)? Один из них — ингибитор протонной помпы, использующийся для лечения пептической язвы желудка, а второй — диуретик, предназначенный для терапии артериальной гипертензии. Два совершенно разных препарата, но когда терапевты пишут эти названия от руки или производят заказ лекарственного средства в аптеке по телефону, существует возможность возникновения ошибки вследствие созвучности этих названий или их похожего написания. Это, в свою очередь, может привести к непоправимым последствиям для пациента.
Есть ли разница между Losec® (омепразол) и Lasixтм (фуросемид)? Один из них — ингибитор протонной помпы, использующийся для лечения пептической язвы желудка, а второй — диуретик, предназначенный для терапии артериальной гипертензии. Два совершенно разных препарата, но когда терапевты пишут эти названия от руки или производят заказ лекарственного средства в аптеке по телефону, существует возможность возникновения ошибки вследствие созвучности этих названий или их похожего написания. Это, в свою очередь, может привести к непоправимым последствиям для пациента.
После того, как случаи ошибочного визуального или аудиального распознания названия были зафиксированы, Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) приняло решение об инициации замены торгового названия Losec®. «AstraZeneca», производитель этого препарата, сменила название препарата на Prilosec.
Однако на этом злоключения с названием этого лекарственного средства не закончились. В августе 1996 г. в журнале «New England Journal of Medicine» была опубликована информация о случае ошибочного лечения пациента с пептической язвой желудка антидепрессантом Prozac®/Прозак® (флуоксетин). Причиной этой ошибки послужила схожесть в написании: фармацевт прочитал в рецепте вместо Prilosec — Prozac. Авторы статьи пришли к выводу, что единственным способом избежать подобных ошибок в будущем в случае с Prilosec может стать использование при назначении названия его действующего вещества — омепразола. Этот пример иллюстрирует те проблемы, с которыми сегодня сталкиваются фармацевтические компании и маркетинговые агентства при создании торговых названий.
Подобные совпадения послужили причиной создания FDA специальной программы, которая должна помочь впредь избегать такой путаницы. Сейчас регуляторный орган США находится на завершающем этапе своей 2-летней пилотной программы. Его примеру последовало и Европейское агентство по лекарственным средствам (European Medicines Agency — ЕМА), которое, воспользовавшись основными положениями, наработанными FDA, также внедряет подобную практику, призванную предотвратить путаницу в торговых названиях лекарственных средств.
Пересмотр регуляторными органами процедуры утверждения торговых названий в сторону ее ужесточения привел к тому, что представители Большой Фармы столкнулись с увеличением периода, необходимого для получения разрешения на использование торгового названия, количества отказов и, таким образом, вынуждены создавать несколько брэндов для удовлетворения требований разных стран мира.
Как же фармацевтические компании могут адаптироваться к изменениям в порядке утверждения торговых названий лекарственных средств? Какие шаги могут предпринять представители Большой Фармы, чтобы повысить вероятность получения позитивного решения от регуляторных органов?
Мозговой штурм
Обычно, когда стоит задача подобрать торговое название для определенного лекарственного средства, работу начинают с приблизительно 250 названий и сужают этот список до 4–5 кандидатов, которые соответствуют необходимым критериям, что позволит им быть утвержденными Управлением по патентам и торговым маркам США (U.S. Patent and Trademark Office — USPTO), FDA и EMA.
Больше торговых названий — больше отказов
В период 1980–2010 гг. количество зарегистрированных торговых названий лекарственных средств увеличилось в 3 раза. В 2010 г. по всему миру было зарегистрировано более 238 тыс. торговых названий лекарственных средств. Наряду с увеличением количества утвержденных торговых названий увеличилось и число отказов FDA и EMA. В предыдущие годы доля отрицательных решений FDA была на уровне 30%, а после разработки нового, более строгого подхода к утверждению торговых названий составила около 36%. Количество отрицательных решений, принимаемых FDA и EMA, в сумме достигает 40–50% поданных заявлений ежегодно.
Лидеры
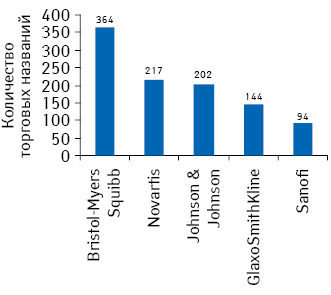
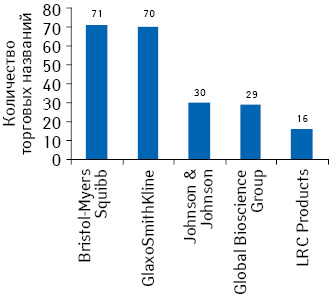
В этих условиях во избежание ситуации, когда не одобрено ни одно торговое название для препарата, фармацевтические компании вынуждены подавать заявления на утверждение большего количества торговых названий, чем необходимо. Максимальное количество зарегистрированных торговых названий в 2009 г. в США принадлежало компаниям «Bristol-Myers Squibb», «Novartis», «Johnson & Johnson», «GlaxoSmithKline» и «Sanofi» (рис. 1). Для сравнения в Великобритании в том же году было одобрено в среднем в 5 раз меньшее количество торговых названий. Так, пальму первенства по регистрации получили компании «Bristol-Myers Squibb», «GlaxoSmithKline» и «Johnson & Johnson», а 4-я и 5-я позиции достались «Global Bioscience Group» и «LRC Products» (рис. 2).
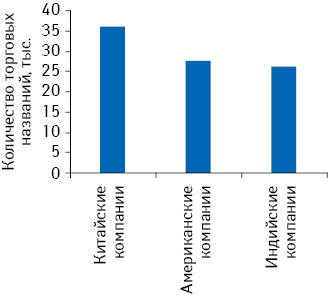
В региональном разрезе наибольшее количество торговых названий было зарегистрировано китайскими фармацевтическими компаниями. В 2010 г. они стали собственниками свыше 36 тыс. торговых названий по всему миру (рис. 3). Для сравнения американские компании получили 27,5 тыс. торговых названий, а индийские — более 26 тыс. Кроме того, в топ-10 стран, зарегистрировавших максимальное количество торговых названий, вошли Вьетнам, Венесуэла и Турция.
Пилотная программа FDA: создание идеального имени
Немногие люди вне отрасли понимают, что фармацевтическая компания может владеть торговым названием, но при этом никогда не использовать его. Это обусловлено тем, что FDA рассматривает и утверждает торговые названия до финального одобрения лекарственного средства. FDA анализирует торговые названия лекарственных средств, зарегистрированные начиная с 1994 г., на предмет несоответствий.
Существовавший ранее порядок оценки FDA торговых названий достаточно субъективен в оценке схожести по написанию или звучанию разных названий и риска обусловленной этим ошибки при отпуске лекарственного средства. Этот процесс сталкивается с рядом проблем, главная из которых — невозможность заранее предугадать, какого рода путаница может возникнуть.
В июне 2003 г. FDA провело свою первую публичную встречу по обсуждению методов скрининга для торговых названий препаратов. В ходе этого совещания было решено, что с целью разработки наилучших методов анализа и оценки риска ошибки необходимо создать многоуровневую тест-систему со стандартизованными инструментами, которые необходимо последовательно применять в процессе исследования. В 2006 г. Институт медицины (Institute of Medicine) официально рекомендовал FDA взаимодействовать с широким кругом заинтересованных организаций при разработке новых стандартов безопасности для упаковки и маркировки препаратов во избежание медицинских ошибок.
Начало процессу разработки нового порядка утверждения торговых названий было положено 27 сентября 2007 г., когда президент Джордж Буш (George Bush) подписал поправки к Закону о FDA (Amendments Act) 2007 г., в который вошел расширенный вариант акта «Prescription Drug User Fee Act» (PDUFA). Согласно этому закону, FDA обязалось улучшить своевременность и последовательность анализа торговых названий новых лекарственных средств с целью:
- снижения риска медицинских ошибок, обусловленных схожим звучанием либо написанием торговых названий препаратов;
- создания руководства для представителей отрасли по разработке торгового названия, соответствующего критериям FDA;
- внедрения пилотной программы для испытания нового подхода при анализе риска ошибки при использовании торговых названий;
- предоставить общественности доступ к программе «Phonetic and Orthographic Computer Analysis» (POCA), созданной FDA и позволяющей проводить фонетический и орфографический анализ названий (POCA используется FDA для оценки риска возможных ошибок при произнесении или написании названия лекарственного средства).
На своем третьем открытом заседании 5–6 июня 2008 г. FDA рассмотрело и прокомментировало проект новой концепции по торговым названиям. Управление порекомендовало производителям участвовать в пилотной программе для создания собственных наработок по этому вопросу. После публичного обсуждения финальный вариант документа был опубликован в октябре 2008 г. и стал основой PDUFA IV — пилотной программы, которая в конце 2009 г. была запущена при участии заинтересованных фармацевтических компаний.
По завершении пилотной программы в 2011 г. FDA подведет итоги и оценит результативность нового порядка утверждения торговых названий. FDA планирует провести открытое заседание в 2012–2013 гг., цель которого — обсуждение итогов и разработка предложений по вопросам ключевых принципов предоставления данных в будущем. Таким образом, эта программа призвана стандартизировать процесс оценки торговых названий лекарственных средств.
Пилотная программа FDA предполагает 7 основных шагов на пути к утверждению торгового названия:
- предварительный скрининг, целью которого является отсеять названия, содержащие информацию, ассоциирующуюся с дозировкой, формой выпуска, способом применения препарата (например «BID» или «TID», «TABS» или «CAPS»), а также проанализировать возможность возникновения ошибок при использовании сокращения названия лекарственного средства;
- название препарата не должно ассоциироваться, частично состоять из/быть похожим на название его действующего вещества;
- сбор информации о наличии сходства по написанию или звучанию с уже зарегистрированными или находящимися в процессе утверждения торговыми названиями лекарственных средств;
- использование IT-технологий (специальная программа и определенный набор инструментов) для анализа наличия сходства по написанию или звучанию с уже зарегистрированными или находящимися в процессе утверждения торговыми названиями лекарственных средств;
- сбор данных в США или других странах о медицинских ошибках, связанных с предлагаемым торговым названием;
- модельные исследования — создание фокус-групп для определения риска возникновения ошибок при написании или произношении названия препарата;
- оценка вероятности возникновения ошибок и анализ последствий, к которым они могут привести.
Европейские перспективы
Одновременно с инициативами, внедряемыми в США, в Европе также проводится разработка более универсального подхода к оценке торговых названий лекарственных средств. В частности, EMA разрабатывает схожий порядок анализа вероятности возникновения ошибок при написании или восприятии на слух названия препарата. По некоторым оценкам, этот порядок даже более строгий, чем пилотная программа FDA. Общим в позиции EMA и FDA является мнение, что торговые названия новых лекарственных средств не должны быть фонетически или визуально похожими на уже зарегистрированные брэнды или названия препаратов, находящихся в процессе одобрения регуляторными органами.
Рассмотрение EMA вариантов торговых названий было начато в 1995 г., а в 1999 г. создана специальная рабочая группа «Name Review Group», в обязанности которой входило принятие решений об утверждении или отказе в утверждении поданных фармацевтическими компаниями торговых названий для лекарственных средств. В состав группы входит 15 экспертов, которые в течение 18 мес с момента подачи заявки должны принять решение по предлагаемому торговому названию лекарственного средства.
В отличие от FDA, которое опубликовало свои специальные критерии оценки торговых названий препаратов, EMA предоставляет фармацевтическим компаниям набор общих принципов, которым необходимо следовать при присвоении названий препаратам.
Среди прочих в числе этих принципов указывается, что торговые названия не должны:
- способствовать возникновению заблуждений вследствие терапевтической или фармацевтической коннотации;
- вводить в заблуждение относительно состава продукта;
- способствовать возникновению ошибок вследствие фонетической или визуальной схожести;
- способствовать возникновению ошибок вследствие схожести с названием действующего вещества (будущего названия генерической версии препарата);
- содержать сообщения рекламного характера или иметь агрессивный оттенок на любом из официальных языков стран ЕС.
Следует отметить, что именно последний пункт демонстрирует основное отличие между подходами, внедряемыми FDA и EMA. Так, FDA работает исключительно в англоязычном правовом поле, а EMA вынуждено учитывать возможные источники возникновения ошибок в 30 странах и на 22 различных языках.
В результате этого в 2008 г. 43% названий, поступивших на рассмотрение рабочей группы при EMA, были отклонены. Следует отметить, что доля отказов в регистрации торгового названия препарата уменьшилась с момента внедрения нового подхода к их утверждению (рис. 4).
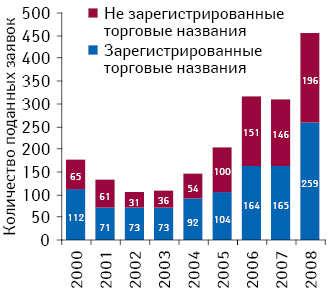
По данным EMA, наиболее распространенными причинами для отказа являются фонетическое или орфографическое сходство с существующими брэндами, сходство с международными непатентованными наименованиями препарата и наличие сообщений рекламного характера или вводящих в заблуждение пациента. Так, Заид Фриас (Zaide Frias), глава рабочей группы «Name Review Group» при ЕМА, отметила, что 84% отказов связано с возможностью путаницы между заявленным названием и уже зарегистрированными торговыми брэндами, а остальные заявления были отклонены по причине того, что они содержат сообщения рекламного характера или информацию, вводящую в заблуждение.
Цена ошибки
Процесс присвоения названия действующему веществу обычно стартует в конце I фазы клинических исследований. На этом этапе вероятность того, что препарат так и не выйдет на фармацевтический рынок, остается достаточно большой. Команда исследователей в это время обладает общими представлениями о том, с какой целью будет применяться препарат, но информация о форме выпуска, дозировке и возможных побочных эффектах препарата отсутствует.
По этой причине маркетологи, проводящие пробное изучение возможных названий для препарата, начинают этот процесс с 200–300 возможных вариантов и сужают круг хотя бы до 5–10 наименований, которые будут подаваться в USPTO для регистрации. Обычно это происходит за 1–2 года до подачи заявки на одобрение препарата регуляторными органами. В FDA подают 2 варианта названия для лекарственного средства — основное и резервное, а EMA разрешает заявлять до 4 названий. Таким образом, это предоставляет некоторое поле для маневра, что особенно важно в том случае, если вы не уверены в получении благоприятного ответа от USPTO.
Стоимость разработки одного торгового названия, включая предоставление юридических консультаций и маркетинговых услуг, может достигать несколько сотен тысяч долларов. Например, разработка 100 потенциальных торговых названий, отбор 15 из них и скрининг оставшихся, который проводит «Brand Institute», оценивается в 250 тыс. дол.
При этом возможен вариант, когда регуляторные органы разных стран утверждают разные торговые названия. Например, FDA и EMA могут зарегистрировать разные названия. В такой ситуации перед маркетологом стоит сложная задача: необходимо либо заново подать заявку в один из регуляторных органов, либо продвигать один и тот же препарат под разными торговыми названиями в разных странах.
Но возможен и более сложный вариант. Поскольку USPTO, FDA и EMA являются независимыми организациями и действуют самостоятельно, возможна ситуация, когда все названия, которые компания зарегистрировала в USPTO, были отклонены регуляторными органами. В этом случае компании приходится начинать все сначала и ждать 1–2 года до получения торгового названия для лекарственного средства.
Высокие ставки и множество игроков
Вернер Харинг (Werner Haring), доктор философии, адвокат, работающий в фармацевтической сфере, отметил, что многие фармацевтические компании подают заявку на получение торгового названия для препарата, который находится на ранней стадии клинических исследований. Однако это не избавляет их от риска отклонения заявки за 2–3 мес до предполагаемого лонча лекарственного средства, таким образом компания может потерять сотни миллионов долларов.
Согласно мнению В. Харинга, одной из основных целей пилотной программы FDA является создание условий для диалога между регуляторным органом и фармацевтическими компаниями, что должно способствовать снижению риска отказов в «последний момент».
Ставки на утверждение торгового названия для лекарственного средства на фармацевтическом рынке очень высоки. Так, согласно данным, опубликованным исследователями из Аугсбургского (University of Augsburg), Калифорнийского (University of California) университетов и представителями руководства Федеральной резервной системы США (U.S. Federal Reserve System Board of Governors), в 2010 г. отказ в утверждении торгового названия со стороны FDA приводил к крайне негативной реакции инвесторов.
Кроме того, отказ FDA является вторым по значению фактором, негативно влияющим на стоимость акций фармацевтических компаний. Большее негативное влияние способна оказать лишь информация об отрицательном значении такого финансового показателя компании, как прибыль.
Блестящие планы и человеческий фактор
Несмотря на усилия, совместно предпринимаемые регуляторными органами и представителями фармацевтической промышленности по созданию порядка утверждения торговых названий препаратов, которые являются одновременно эффективными с маркетинговой точки зрения и безопасными для потребителя, инновационный многоуровневый подход к анализу предлагаемых названий может привести к новым трудностям.
Так, доктор В. Харинг отметил, что бывают случаи, когда название, успешно прошедшее проверку внутри компании в соответствии с подходами, использующимися FDA, не было зарегистрировано регуляторным органом, а название, с трудом миновавшее контроль на уровне компании, было одобрено FDA.
Проблема может заключаться в том, что компании подают в FDA и EMA сокращенные отчеты о проведении тестирования названия вместо предоставления полных данных. Еще одна серьезная проблема этого подхода — влияние человеческого фактора. Например, орфографическая экспертиза является источником достаточно субъективных данных.
Новые технологии и инициативы, призванные предупредить ошибки при назначении лекарственных средств, например, компьютерная программа, позволяющая оформлять рецепты в электронном виде и располагающая рядом информационных инструментов (e-рrescribing), не только являются источником новых возможностей, но и несут определенные риски. Сейчас эта система внедряется правительствами многих стран, ее использование позволит избежать ошибок при лечении пациента и даст возможность более эффективно расходовать финансовые ресурсы. Представьте, какова вероятность ошибки при заполнении рецепта путем выбора нужного препарата из алфавитного меню программы.
Это ставит вопрос о том, сколько денег и времени готовы вкладывать государственные органы в создание систем, позволяющих регистрировать безопасные с точки зрения возможной ошибки торговые названия, если все это может свестись на нет в результате наличия человеческого фактора.
P.S. Таким образом, не существует рецепта создания идеального торгового названия лекарственного средства, однако регуляторные органы разных стран в сотрудничестве с представителями Большой Фармы предпринимают максимум усилий для того, чтобы сделать порядок утверждения торгового названия прозрачным и предсказуемым, а также обезопасить пациентов от возможных медицинских ошибок.
по материалам www.compumark.thomson.com, www.pwc.com, www.anefp.org,
www.brandinstitute.com, www.nejm.org

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим