Обмеження реклами безрецептурних лікарських засобів
З моменту (і за умови) набуття чинності змінами до законодавства буде дозволено рекламу не всіх безрецептурних ліків, а лише тих, які не внесені до Переліку лікарських засобів, заборонених до рекламування. На МОЗ України покладено завдання затвердити своїм наказом Критерії визначення лікарських засобів, рекламування яких заборонено, а також затверджувати їх перелік. Рішення про віднесення лікарських засобів до тих, рекламування яких заборонено, прийматиметься під час їх державної реєстрації (перереєстрації) із внесенням відповідної інформації до Державного реєстру лікарських засобів України (далі — Реєстр). Реклама лікарських засобів, зареєстрованих в Україні до набуття чинності нововведеннями, може здійснюватися лише після внесення відповідних змін до Реєстру. Отже, після (і за умови) набуття чинності змінами буде дозволена тільки реклама препаратів, які:
- відпускаються без рецепта лікаря;
- не внесені до Переліку лікарських засобів, заборонених до рекламування;
- щодо яких у Реєстр внесено інформацію про допустимість їх рекламування (рис. 1).
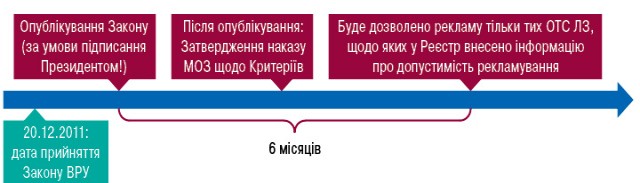
Ймовірна процедура
Виходячи з формулювань Закону, можна припустити, що визначення статусу ОТС-препаратів для цілей рекламування відбуватиметься в порядку, наведеному на рис. 2. У свою чергу, визначення статусу вже зареєстрованого ОТС-препарату проводитиметься в порядку, представленому на рис. 3.
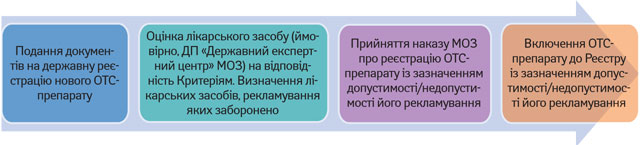
Порядок визначення статусу ОТС-препаратів
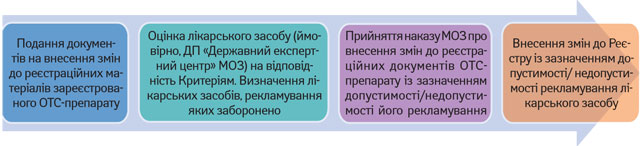
Порядок визначення статусу вже зареєстрованих ОТС-препаратів
Нововведення: усунення обмежень щодо публікації нерекламної інформації
Згідно із Законом у виданнях, призначених для медичних, а відтепер — і для фармацевтичних працівників, а також у матеріалах, що розповсюджуються на спеціалізованих семінарах із медичної тематики, дозволятиметься публікувати інформацію про:
- будь-які препарати, незалежно від внесення їх до Переліку лікарських засобів, заборонених до рекламування;
- незареєстровані лікарські засоби, або такі, що перебувають на стадії розробки чи впровадження у виробництво.
Така інформація може включати лише назву, характеристику, лікувальні властивості та можливу побічну дію препарату. Виходячи з формулювання Закону, можна зробити висновок про невіднесення такої інформації до реклами лікарських засобів, а отже — про наближення законодавства України у цій частині до практики ЄС (зокрема, Директиви ЄС 2001/83).
Розширення дії спеціальних вимог
Багато обмежень, які раніше були характерні для реклами лікарських засобів, використовуватимуться й для реклами інших товарів:
- реклама не лише лікарських засобів, але й медичних виробів, методів профілактики, діагностики, лікування і реабілітації повинна буде містити об’єктивну інформацію про такі товари і здійснюватися так, аби було зрозуміло, що наведене повідомлення є рекламою, а рекламований товар є, відповідно, лікарським засобом, медичним виробом, методом профілактики, діагностики, лікування, реабілітації;
- реклама повинна буде містити вимогу про необхідність консультації з лікарем не лише перед застосуванням препаратів, а й перед використанням медичних виробів;
- у рекламі заборонятиметься розміщення відомостей, які можуть справляти враження, що за умови застосування лікарського засобу чи використання медичного виробу консультація з фахівцем не є необхідною, а також відомостей про те, що лікувальний ефект є гарантованим;
- також буде заборонено розміщувати в рекламі інформацію, що може вводити споживача в оману стосовно складу, походження, ефективності, патентного захисту товару, а саме: лікарських засобів, а відтепер — і медичних виробів, методів профілактики, діагностики, лікування і реабілітації.
Наслідки набуття чинності положеннями закону щодо реклами лікарських засобів
Вищевказані нововведення щодо рекламування ліків набудуть чинності через 6 міс після офіційного опублікування Закону. До цього часу діятимуть чинні положення ст. 21 Закону «Про рекламу». Ризик тимчасового зупинення рекламування ОТС-препаратів існує, але значною мірою залежатиме від прийняття МОЗ України необхідних підзаконних актів, а також від прозорості, швидкості і простоти процедури внесення змін до реєстраційних даних щодо допустимості/недопустимості рекламування безрецептурних лікарських засобів.
адвокат,
партнер Адвокатської фірми «ПАРИТЕТ»


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим