ПОВІДОМЛЕННЯ
на публічне обговорення виноситься проект наказу Міністерства охорони здоров’я України «Про затвердження Методичних рекомендацій з розробки локального формуляра лікарських засобів» (далі — проект наказу)
Проект наказу розроблено відповідно до наказу МОЗ України від 22.07.2009 № 529 «Про створення формулярної системи забезпечення лікарськими засобами закладів охорони здоров’я», пункту 10 протокольного рішення наради під головуванням Прем’єр-міністра України М. Азарова від 16 червня 2010 р. щодо забезпечення доступності для населення якісних лікарських засобів.
Метою прийняття проекту наказу є подальший розвиток і впровадження формулярної системи забезпечення лікарськими засобами як основи раціональної фармакотерапії на принципах доказової медицини і відповідних стандартів лікування, забезпечення оптимального використання наявних ресурсів для досягнення високої якості медичної допомоги, сприяння організації адекватної роботи фармако-терапевтичних комісій закладу охорони здоров’я. Проект наказу, пояснювальна записка, повідомлення про оприлюднення проекту розміщено на сайті Міністерства охорони здоров’я України.
Зауваження та пропозиції приймаються у письмовому або електронному вигляді до 01.11.2012 року на адресу: Державний експертний центр МОЗ України 03151, м. Київ, вул. Ушинського, 40 тел. (044) 393–75–89, Думенко Тетяна Михайлівна, e-mail: [email protected].
Пояснювальна записка
до проекту наказу МОЗ України
«Про затвердження Методичних рекомендацій
з розробки локального формуляра лікарських засобів»
1. Обґрунтування необхідності прийняття акта
Проект наказу розроблено на виконання п.10 протокольного рішення наради під головуванням Прем’єр-міністра України М.Я. Азарова від 16.06.2010 р. щодо забезпечення доступності для населення якісних лікарських засобів та у відповідності до Положення про локальний формуляр лікарських засобів, затверджений наказом МОЗ України від 22.07.2009 № 529 «Про створення формулярної системи забезпечення лікарськими засобами закладів охорони здоров’я», зареєстрованим у Міністерстві юстиції від 29.10.2009 № 1003/17019.
Локальний формуляр лікарських засобів є медико-технологічним документом впровадження формулярної системи на рівні закладу охорони здоров’я, відноситься до галузевих стандартів медичної допомоги. З огляду на сучасний стан формулярної системи в Україні створення методичних рекомендацій з розробки, перегляду та оновлення локального формуляра лікарських засобів є своєчасним, актуальним та сприятиме організації адекватної роботи фармако-терапевтичної комісії закладу охорони здоров’я.
2. Мета і шляхи її досягнення
Мета: подальший розвиток і впровадження формулярної системи забезпечення лікарськими засобами як основи раціональної фармакотерапії на принципах доказової медицини і відповідних стандартів лікування, забезпечення оптимального використання наявних ресурсів для досягнення високої якості медичної допомоги, сприяння організації адекватної роботи фармако-терапевтичних комісій закладу охорони здоров’я.
3. Правові аспекти
- Стаття 14–1 Закону України «Про внесення змін до Основ законодавства України про охорону здоров’я щодо удосконалення надання медичної допомоги», який набрав чинності 01.01.2012 року.
- Наказ МОЗ України від 22.07.2009 р. № 529 «Про створення формулярної системи забезпечення лікарськими засобами закладів охорони здоров’я», зареєстрованого у Міністерстві юстиції України за № 1007/17022 від 29.10.2009 р., затверджено Положення про локальний формуляр лікарських засобів.
4. Фінансово-економічне обґрунтування
Реалізація проекту наказу не потребує додаткових матеріальних та інших витрат з державного бюджету України.
5. Позиція заінтересованих органів
Проект акта не стосується інтересів інших органів, тому не потребує погодження.
6. Регіональний аспект
Проект наказу стосується питань раціонального забезпечення лікарськими засобами закладів охорони здоров’я державної та комунальної форм власності.
7. Запобігання корупції
У проекті наказу відсутні правила і процедури, які містять ризик вчинення корупційних правопорушень.
8. Громадське обговорення
З метою громадського обговорення проект наказу розміщено на офіційному веб-сайті Міністерства охорони здоров’я України.
9. Позиція соціальних партнерів
Проект наказу не стосується соціально-трудової сфери.
10. Оцінка регуляторного впливу
Проект наказу не є регуляторним актом.
11. Прогноз результатів
Прийняття проекту наказу матиме соціальний та медичний ефект:
- дозволить громадянам України отримати якісну та висококваліфіковану медичну допомогу, шляхом забезпечення закладів охорони здоров’я безпечними та якісними лікарськими засобами, використання найбільш раціональних, високоефективних та економічно доцільних методів фармакотерапії на принципах доказової медицини
- сприяння організації належної роботи фармако-терапевтичних комісій закладу охорони здоров’я.
| Заступник Міністра — керівник апарату |
Р. Богачев |
ПРОЕКТ
Про затвердження Методичних рекомендацій з розробки локального формуляра лікарських засобів
З метою реалізації Плану основних організаційних заходів Міністерства охорони здоров’я України на 2012 рік, затвердженого наказом МОЗ України від 25.01.2012 № 45, наказу МОЗ України від 22.07.2009 № 529 «Про створення формулярної системи забезпечення лікарськими засобами закладів охорони здоров’я», затвердженого у Міністерстві юстиції України від 29.10.2009 р № 1003/17019, та пункту 10 протокольного рішення наради під головуванням Прем’єр-міністра України М. Азарова від 16 червня 2010 р. щодо забезпечення доступності для населення якісних лікарських засобів
НАКАЗУЮ:
1. Затвердити Методичні рекомендації з розробки локального формуляра лікарських засобів (далі — Методичні рекомендації), що додаються.
2. Міністру охорони здоров’я Автономної Республіки Крим, начальникам управлінь охорони здоров’я обласних, Київської та Севастопольської міських державних адміністрацій забезпечити використання Методичних рекомендацій в діяльності регіональних формулярних комітетів Міністерства охорони здоров’я Автономної Республіки Крим, управлінь охорони здоров’я обласних, Київської та Севастопольської міських державних адміністрацій та фармакотерапевтичних комісій закладів охорони здоров’я, що належать до сфери їх управління.
3. Начальнику Управління лікарських засобів та медичної продукції Коношевич Л., генеральному директору Державного експертного центру МОЗ Нестерчуку М., голові Центрального формулярного комітету МОЗ України Морозову А. забезпечити супровід впровадження Методичних рекомендацій в діяльність організаційних структур формулярної системи.
4. Контроль за виконанням цього наказу покласти на заступника Міністра охорони здоров’я України — керівника апарату Р. Богачева.
| Віце-прем’єр-міністр України — Міністр | Р.В. Богатирьова |
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони
здоров’я України
УНІФІКОВАНА МЕТОДИКА РОЗРОБКИ,
ПЕРЕГЛЯДУ ТА ОНОВЛЕННЯ ЛОКАЛЬНОГО ФОРМУЛЯРА
ЛІКАРСЬКИХ ЗАСОБІВ ЗАКЛАДУ ОХОРОНИ ЗДОРОВ’Я
Методичні рекомендації
Загальні положення
Список скорочень
АТХ-код –код лікарського засобу за міжнародною анатомо-терапевтчино-хімічною класифікацією
ЗОЗ — заклад охорони здоров’я
ЛЗ — лікарський засіб
ЛФ — локальний формуляр лікарських засобів закладу охорони здоров’я
МНН — міжнародна непатентована назва
ТН — торгова назва
ФС — формулярна система
ФТ — фармакотерапія
ФТК — фармакотерапевтична комісія
DDD — Defined Daily Dose — визначена добова доза
ЛПМД — локальний протокол медичної допомоги
ДФЛЗ — Державний формуляр лікарських засобів
УКПМД — Уніфікований клінічний протокол медичної допомоги
Створення ефективної інфраструктури медикаментозного забезпечення — одна із найскладніших проблем галузі охорони здоров’я, а раціональне використання лікарських засобів (далі — ЛЗ) є пріоритетною складовою цієї проблеми. Для її вирішення необхідний системний підхід із застосуванням комплексу державних, управлінських та навчально-дидактичних заходів, яким, зокрема, є впровадження національної формулярної системи (далі — ФС).
В Україні передбачено створення формулярів 3-х рівнів: державного, регіонального та локального формуляра ЛЗ закладу охорони здоров’я (далі — ЛФ). Розробка та затвердження відповідної нормативно-правової бази, опрацювання та динамічний перегляд Державного формуляру лікарських засобів (далі — Державного формуляра) забезпечили впровадження ФС на державному рівні. Натомість створення та впровадження у практичну медицину регіональних та локальних формулярів ще перебуває на етапі становлення.
З огляду на сучасний стан впровадження ФС в Україні створення методичних рекомендацій з розробки, перегляду та оновлення ЛФ є своєчасним, актуальним та сприятиме організації адекватної роботи фармако-терапевтичної комісії закладу охорони здоров’я (далі — ФТК).
1. НОРМАТИВНО-ПРАВОВИЙ СТАТУС ЛОКАЛЬНОГО ФОРМУЛЯРА ЛІКАРСЬКИХ ЗАСОБІВ ЗАКЛАДУ ОХОРОНИ ЗДОРОВ’Я
Стаття 14–1 Закону України «Про внесення змін до Основ законодавства України про охорону здоров’я щодо удосконалення надання медичної допомоги», який набрав чинності 01.01.2012 року, трактує лікарський формуляр, тобто перелік зареєстрованих в Україні ЛЗ, що включає ліки з доведеною ефективністю, допустимим рівнем безпеки, використання яких є економічно прийнятним, як складову системи галузевих стандартів у сфері охорони здоров’я.
Відповідно до Положення про ЛФ, затвердженого наказом МОЗ України від 22.07.2009 р. № 529 «Про створення формулярної системи забезпечення лікарськими засобами закладів охорони здоров’я», зареєстрованого у Міністерстві юстиції України за № 1007/17022 від 29.10.2009 р., ЛФ — це перелік ЛЗ з найкращою доказовою базою щодо їх ефективності, безпеки та економічно вигідного використання коштів закладу охорони здоров’я (далі — ЗОЗ), що затверджується керівником закладу.
2. ПОРЯДОК РОЗРОБКИ ЛОКАЛЬНОГО ФОРМУЛЯРА ЛІКАРСЬКИХ ЗАСОБІВ ЗАКЛАДУ ОХОРОНИ ЗДОРОВ’Я
Процес розробки ЛФ передбачає поступове виконання наступних етапів:
- Адміністративно-організаційне забезпечення,
- Розробка локального формуляра лікарських засобів,
- Підтримка формулярної системи забезпечення ЛЗ.
2.1. Адміністративно-організаційне забезпечення локального формуляра лікарських засобів
Створення фармако-терапевтичної комісії. З метою опрацювання та постійного оновлення ЛФ, а також для виконання низки інших завдань, у ЗОЗ передбачено створення ФТК відповідно до Положення про ФТК ЗОЗ,4 затвердженого наказом МОЗ України від 22.07.2009 р. № 529. До складу ФТК входять заступники керівника ЗОЗ, відповідальні за надання медичної допомоги, клінічний провізор (у разі його відсутності — особа з вищою медичною або фармацевтичною освітою, яка пройшла спеціалізацію з «клінічної фармації» з отриманням сертифіката встановленого зразка, на яку покладено здійснення моніторингу ефективності та безпеки ЛЗ у стаціонарі), завідувачі відділень лікувального профілю, завідувач організаційно-методичного (статистичного) підрозділу. Головою ФТК призначається один із заступників керівника ЗОЗ, відповідальний за надання медичної допомоги, заступником голови — клінічний провізор. Персональний склад ФТК затверджується наказом керівника ЗОЗ.
На завершення адміністративно-організаційних процедур ФТК має визначитись з питанням класифікації ЛЗ для ЛФ. Базуючись на класифікації Державного та відповідного регіонального формулярів кожний ЗОЗ адаптує систему класифікації ЛЗ для локального формуляра.
В Україні Державний формуляр упорядковано за принципом розподілу за напрямками медицини, при яких переважно застосовується фармакотерапія (далі — ФТ) (кардіологія, психіатрія, неврологія тощо). Такий підхід близький до класифікаційних принципів Британського Національного Формуляра, який розроблено за принципом захворюваності чи органу (шкіра, очі, інфекції тощо).
Для багатопрофільних лікарень (обласних, міських, районних) найбільш зручною є класифікація ЛЗ, представлена у Державному формулярі, яка надає можливість узагальнити інформацію щодо застосування ЛЗ за різними напрямками медицини.
У спеціалізованих закладах (протитуберкульозних, кардіологічних, онкологічних та інших) рекомендується використовувати системи класифікації, що базуються на терапевтичному застосуванні ЛЗ.
У ЗОЗ, що надають медичну допомогу за спеціальністю «Загальна практика — сімейна медицина», у якості ЛФ рекомендовано використовувати Формуляр ЛЗ для первинної медико-санітарної допомоги, що є складовою Державного формуляра (Додаток 10).
2.2 Розробка локального формуляра лікарських засобів закладу охорони здоров’я
Процес розробки, перегляду та оновлення ЛФ відбувається циклічно із залученням завідувача відділення, старшої медичної сестри відділення, клінічного провізора (уповноваженої особи) та інших співробітників закладу (за потребою), що представлено у Таблиці 1.
Таблиця 1.
Порядок розробки локального формуляра та залучення до процесу
персоналу закладу охорони здоров’я
| № з/п | Зміст завдання | Виконавці |
|---|---|---|
| 1. | Формування попереднього переліку ЛЗ, необхідних кожному відділенню ЗОЗ на рік |
Зав. від-ня Ст. м/с від-ня Клінічний провізор чи уповноважена особа |
| 2. | Формування узагальненого переліку ЛЗ для розрахунку річної потреби ЗОЗ у ліках |
Гол. м/с ЗОЗ Клінічний провізор чи уповноважена особа |
| 3. | Проведення ABC/VEN-аналізу закуплених лікарських засобів на предмет раціональності | Клінічний провізор чи уповноважена особа |
| 4. | Оприлюднення проекту ЛФ, збір та аналіз пропозицій та зауважень | ФТК, у її складі клінічний провізор чи уповноважена особа |
| 5. | Затвердження та впровадження ЛФ | ФТК, у її складі клінічний провізор чи уповноважена особа |
2.2.1. Формування попереднього переліку лікарських засобів для забезпечення річних потреб кожного відділення закладу охорони здоров’я.
Формування ЛФ розпочинається з розробки переліку ЛЗ, необхідних для надання допомоги в кожному відділенні ЗОЗ. Цей етап передбачає співпрацю завідувача відділення, старшої медичної сестри відділення з головною медичною сестрою лікарні та клінічним провізором (уповноваженою особою) з метою проведення розрахунку річної потреби відділення в ЛЗ. Кожному відділенню роздруковується перелік ліків, що включені до регіонального/Державного формулярів. Завідувач відділення спільно з лікарями та старшою медичною сестрою відділення проставляють потребу у ЛЗ, необхідних для забезпечення відділення на обумовлений період (рік) з урахуванням клінічних (за наявності локальних) протоколів надання медичної допомоги.
Об’єктивна потреба у ЛЗ базується на результатах аналізу наступних даних:
А) статистичні дані про захворюваність та поширеність хвороб у регіоні обслуговування та/або виписаних зі стаціонару пацієнтів за нозологічними формами (за результатами річного звіту відділення).
Б) результати попередньої діяльності відділення, результати лікування (за результатами річного звіту відділення).
В) чинні документи із стандартизації медичної допомоги — локальні протоколи надання медичної допомоги, що затверджені наказами Управлінь ОЗ обласних, міських мм. Києва та Севастополя державних адміністрацій, а у разі їх відсутності — стандарти та клінічні протоколи надання медичної допомоги, що затверджені наказами МОЗ України.
Аналіз статистичних даних поширеності захворювань у регіоні обслуговування та виписаних із стаціонару пацієнтів за нозологічними формами проводиться окремо у кожному відділенні закладу (за результатами річного звіту відділень) з метою визначення переліку всіх хвороб та станів, у першу чергу, найбільш поширених та соціально значущих, які складають 70- 80% обсягу ліжко-днів у структурі захворюваності.
Для проведення аналізу треба мати точні дані про структуру захворюваності, типові захворювання та категорії пацієнтів (форма №071/о). Результатом аналізу є перелік основних захворювань чи причин госпіталізації з кількістю випадків по кожній нозології за певний період часу (орієнтовно 1/2 — 2/3 кількості нозологій, за якими протягом року надавалась медична допомога у відділенні).
Приклад. За даними форми №071/о аналізуємо за класами хвороб кількість хворих, пролікованих у кардіологічному відділенні стаціонару багатопрофільної лікарні у 2009–2011 рр., що представлено у Табл. 2.
Таблиця 2.
Кількість хворих, пролікованих у кардіологічному відділенні стаціонару у 2009–2011 рр. (за класами хвороб)
| Місце у рейтингу | Класи хвороб | Код | 2009 | 2010 | 2011 | |||
|---|---|---|---|---|---|---|---|---|
| абс. к-сть | % | абс. к-сть | % | абс. к-сть | % | |||
| 1 | Клас 9. Хвороби системи кровообігу | I00-I99 | 449 | 83,3 | 366 | 78,9 | 466 | 82,6 |
| 2 | Клас 6. Хвороби нервової системи | G00-G99 | 76 | 14,1 | 65 | 14,0 | 74 | 13,1 |
| 3 | Клас 13. Хвороби кістково-м’язової системи та сполучної тканини | M00-M99 | 6 | 1,1 | 18 | 3,9 | ||
| 4 | Клас 11. Хвороби органів травлення | K00-K93 | 4 | 0,7 | 3 | 0,6 | 4 | 0,1 |
| 5 | Клас 4. Ендокринні хвороби, розлади харчування та обміну речовин | Е00-Е90 | 3 | 0,6 | 5 | 1,1 | 10 | 1,8 |
| 6 | Клас 10. Хвороби органів дихання | J00-J99 | 1 | 0,2 | 1 | 0,2 | ||
| 7 | Клас 17. Природні вади розвитку, деформації та хромосомні аномалії | Q00-Q99 | 3 | 0,6 | 4 | 0,7 | ||
| 8 | Клас 21. Фактори, що впливають на здоров’я населення та звертання до закладів охорони здоров’я | Z00-Z99 | 2 | 0,4 | ||||
| 9 | Клас 1. Інфекційні та паразитарні хвороби | А00-B99 | 1 | 0,2 | ||||
| 10 | Клас 14. Хвороби сечостатевої системи | N00-N99 | 1 | 0,2 | 3 | 0,5 | ||
| 11 | Клас 2. Новоутворення | С00-D48 | 1 | 0,2 | ||||
| 12 | Клас 12. Хвороби шкіри та підшкірної клітковини | L00-L99 | 1 | 0,2 | ||||
| ВСЬОГО | 539 | 464 | 564 | |||||
Оскільки переважну частку склали пацієнти з хворобами системи кровообігу (від 78,9% до 83,3% за звітний період), для подальшого аналізу обирається Клас 9 (код I00- I99). На наступному етапі аналізуємо кількість хворих, пролікованих у кардіологічному відділенні стаціонару багатопрофільної лікарні у 2009–2011 рр. у розрізі їх розподілу за хворобами, що представлено у Табл. 3.
Таблиця 3.
Кількість хворих, пролікованих у кардіологічному відділенні стаціонару у 2009–2011 рр. (за хворобами)
| Клас 9. Хвороби системи кровообігу — всього | I00-I99 | 2009 | 2010 | 2011 | |||
|---|---|---|---|---|---|---|---|
| абс. к-сть | % | абс. к-сть | % | абс. к-сть | % | ||
| 449 | 100 | 366 | 100 | 466 | 100 | ||
| в тому числі: гострий ревматизм | I00-I02 | 1 | 0,2 | 1 | 0,3 | 3 | 0,6 |
| – хронічні ревматичні хвороби серця | I05-I09 | 7 | 1,6 | 9 | 2,5 | 6 | 1,3 |
| – гіпертонічна хвороба — всього | I10-I15 | 265 | 59,0 | 229 | 65,6 | 279 | 59,9 |
| – ішемічна хвороба серця — всього | I20-I25 | 82 | 18,3 | 87 | 23,8 | 131 | 28,1 |
| з них: стенокардія | I20 | 35 | 7,8 | 40 | 10,9 | 43 | 9,2 |
| інфаркт міокарда | I21-I23 | 8 | 1,8 | 8 | 2,2 | 3 | 0,6 |
| з них: гострі порушення мозкового кровообігу | I60-I64 | 1 | 0,2 | ||||
| – хвороби артерій, артеріол, капілярів | I70-I79 | 8 | 1,8 | 10 | 2,7 | 15 | 3,2 |
| – варикозне розширення вен нижніх кінцівок | I83 | 1 | 0,2 | ||||
| – геморой | I84 | 1 | 0,2 | ||||
Серед пацієнтів з хворобами системи кровообігу основну вибірку склали хворі з гіпертонічною хворобою та ішемічною хворобою серця (від 77,3% до 89,4% за звітний період). Тому потреба даного кардіологічного відділення у ЛЗ формується переважно за рахунок ЛЗ, що спрямовані на лікування зазначених вище патологій.
Відповідно до сформованого переліку хвороб та станів, за якими переважно надається допомога у відділенні, здійснюється пошук та відбір чинних документів із стандартизації медичної допомоги — локальних протоколів медичної допомоги, що затверджені наказами Управлінь охорони здоров’я обласних, Київської та Севастопольської міських державних адміністрацій та клінічних протоколів медичної допомоги, що затверджені наказами МОЗ України.
З метою пошуку чинних клінічних протоколів та розробки в подальшому локальних протоколів медичної допомоги рекомендовано використовувати «Базу стандартів медичної допомоги», яка доступна на сайті МОЗ України та сайті ДП «Державний експертний центр МОЗ України» та оновлюється кожні 3 місяці — режим доступу: http://www.moz.gov.ua/ua/main/?docID=12144 та/або www.pharma-center.kiev.ua/view/b_smd.
Приклад (продовження). З метою формування обґрунтованого переліку ЛЗ, спрямованих на лікування гіпертонічної хвороби та ішемічної хвороби серця з числа чинних наказів МОЗ України, що визначають надання допомоги кардіологічним хворим, проводимо відбір наказів МОЗ України, що визначають лікування гіпертонічної хвороби та ішемічної хвороби серця у дорослих на етапі вторинної медичної допомоги в умовах стаціонару.
а) Гіпертонічна хвороба
- Наказ МОЗ від 24.05.2012 № 384 Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при артеріальній гіпертензії
б) Ішемічна хвороба серця
- Наказ МОЗ від 27.07.1998 №226 Про затвердження Тимчасових галузевих уніфікованих стандартів медичних технологій діагностично-лікувального процесу стаціонарної допомоги дорослому населенню в лікувально-профілактичних закладах України та Тимчасових стандартів обсягів діагностичних досліджень, лікувальних заходів та критерії якості лікування дітей.
- Наказ МОЗ від 03.07.2006 № 436 Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія».
- Наказ МОЗ України від 23.11.2011 №816 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги на засадах доказової медицини»
- Наказ МОЗ від 30.12.1992 № 206 Про заходи щодо поліпшення організації та підвищення якості кардіологічної допомоги населенню України.
Наявність ЛЗ у зазначених вище медико-технологічіних документах свідчить на користь необхідності включення їх до проекту ЛФ.
На основі Державного/регіонального формулярів ЛЗ та результатів аналізу відібраних клінічних протоколів надання медичної допомоги (уніфікованих та локальних), для кожного відділення ЗОЗ окремо формуються переліки рекомендованих ЛЗ (за міжнародними непатентованими назвами — МНН). Відбір ЛЗ та включення їх до ЛФ під МНН — це одне з найважливіших правил у процесі запровадження ФС.
Наявність у ЗОЗ локальних протоколів медичної допомоги, розроблених відповідно до Уніфікованої методики з розробки клінічних настанов, медичних стандартів, уніфікованих клінічних протоколів медичної допомоги, локальних протоколів медичної допомоги (клінічних маршрутів пацієнтів) на засадах доказової медицини (частина друга), затвердженої спільним наказом МОЗ України та НАМН України від 03.11.2009 р. № 798/75, спрощує формування переліку ЛЗ, необхідних для надання допомоги в окремому відділенні/закладі.
Відповідно до вимог наказу МОЗ України від 22.07.2009 р. №529 ЛФ укладається за МНН згідно фармакотерапевтичних груп із формуванням алфавітного покажчика ЛЗ за МНН із зазначенням торгових назв (далі — ТН) ЛЗ. З метою упорядкування переліку МНН використовується присвоєний ЛЗ АТХ-код.
Подальший розрахунок річної потреби базується на звітних даних про роботу відділення, що включають кількість пролікованих хворих із даною патологією за рік, кількість ліжко-днів на всіх хворих з даної патології у звітному році, кількість ЛЗ на 1 добу лікування одного хворого відповідно до протоколів лікування (для ЛЗ тривалість лікування якими перевищує термін перебування у стаціонарі), кількість ЛЗ на курс лікування одного хворого відповідно до протоколів лікування (для ЛЗ тривалість лікування якими коротша за термін перебування у стаціонарі) та інші дані (за потребою).
Для зручності подальшої обробки інформації рекомендовано заповнювати Форму 1 (Додаток 1) у вигляді Exel-документу.
Починаючи з четвертого випуску, Державний формуляр містить цінову характеристику ЛЗ, включених до нього. У Державному формулярі надається інформація про ціну визначеної добової дози (Defined Daily Dose — DDD) або стандартної добової дози, для розрахунку яких використовуються дані реєстру оптово-відпускних цін. DDD — це середня підтримуюча доза на день для ЛЗ, що використовуються за їх основним показанням, для дорослих вагою 70 кг. DDD розраховується Міжнародним Центром співпраці ВООЗ та Інституту Громадського Здоров’я Норвегії з питань методології статистичних досліджень ЛЗ і повинна розглядатися не як «правильна доза», а як міжнародний компроміс, що базується на огляді баз доказової медицини, доступних на момент розрахунку DDD (офіційний сайт зазначеної вище організації — http://www.who.no).
Оскільки не всі ЛЗ, що включені до Державного формуляра, мають DDD для відображення цінової характеристики ЛЗ використовувалась стандартна доза. Інформацію про величину DDD та стандартної дози, використану для розрахунків цінової характеристики ЛЗ, представлено у рубриці формулярної статті «Визначена/стандартна доза».
Подальший вибір ТН ЛЗ із переліку запропонованих МНН обмежується переліком ЛЗ, для яких зареєстрована оптово-відпускна ціна (Реєстр оптово- відпускних цін лікарських засобів — http://www.moz.gov.ua/ua/portal/register_prices_drugs/).
Приклад (продовження) . Відповідно до об’єктивних умов діяльності кардіологічного відділення багатопрофільного стаціонару розраховуємо річну потребу у ЛЗ ЕНАЛАПРИЛ, як це представлено у Табл. 4.
Таблиця 4.
Розрахунок річної потреби у лікарському засобі ЕНАЛАПРИЛ кардіологічного відділення багатопрофільного стаціонару за результатами діяльності 2009 року
| Код захворювання за МКХ-10 | Нозологічна форма | Кількість пролікованих хворих із даною патологією за рік, осіб | Кількість ліжко-днів на всіх хворих з даної патології у | Міжнародна непатентована назва ЛЗ | АТС-код ЛЗ | Торгова назва ЛЗ | Форма випуску | Наявність ЛЗ у Державному формулярі ЛЗ, останній випуск, (відповідно до зазначених показань) | Наявність рекомендацій до застосування ЛЗ у локальному протоколі / клінічному протоколі (за наявності останнього) | VEN-клас | Кількість ЛЗ на 1 добу лікування одного хворого (відповідно до протоколів лікування) | Кількість ЛЗ на курс лікування одного хворого (відповідно до протоколів лікування) | Річна потреба (у табл., амп. або DDD) |
| I10—I15 | гіпертонічна хвороба | 265 | 3005 | Еналаприл | C09AA02 | Енап | табл. по 10 мг | так | так | V/E | 2 табл. по 10 мг | 2 табл. по 10 мг постійно | 6010 табл. по 10 мг ≈ 300,5 уп. №20 табл. |
| I10–I15 | гіпертонічна хвороба | 265 | 3005 | Еналаприл | C09AA02 | БЕРЛІПРИЛ®10 | табл. по 10 мг | так | так | V/E | 2 табл. по 10 мг | 2 табл. по 10 мг постійно | 6010 табл. по 10 мг ≈ 200 уп. №30 табл. |
2.2.2. Формування загального переліку лікарських засобів для забезпечення річних потреб закладу охорони здоров’я
Створені для кожного відділення ЗОЗ переліки ЛЗ об’єднують у один загальний перелік ЛЗ (Додаток 2). Загальний список формується з переліків ЛЗ, рекомендованих для забезпечення кожного з відділень ЗОЗ.
Загальний перелік переглядається та доповнюється згідно результатів аналізу попередньої діяльності закладу з врахуванням результатів ФТ. До ЛФ можуть бути включені ЛЗ, які не зазначені у чинних стандартах ФТ, однак, включені до Державного формуляра, як ефективні та безпечні.
З метою визначення фінансових потреб визначається орієнтовна вартість ЛЗ згідно зведеного переліку. Отриманий зведений перелік МНН ЛЗ порівнюють із Державним формуляром та виключають із переліку ті ліки, що не увійшли до Державного формуляра. За таким же принципом визначається можливість включення до ЛФ комбінованих ЛЗ: якщо комбінований ЛЗ увійшов до Державного формуляра, він може бути включеним до ЛФ.
Державний формуляр у форматі інформаційно-пошукової системи «Електронний формуляр» викладено на сайті МОЗ України та сайті ДП «Державний експертний центр МОЗ України» — режим доступу: http://www.moz.gov.ua/ua/portal/eformular.html та/або http://www.pharmacenter.kiev.ua/view/formylar.
З метою підвищення безпеки ФТ вибір ЛЗ для включення до ЛФ здійснюється із врахуванням результатів аналізу даних, отриманих методом спонтанних повідомлень та моніторингу ефективності та безпеки ЛЗ у даному закладі, тобто при виборі ліків для включення до ЛФ перевагу надають лікам із меншою кількістю побічних реакцій.
Розташовані за алфавітом МНН та ТН ЛЗ згідно Державного та регіонального формулярів формують алфавітний покажчик ЛФ (табл. 5).14
2.2.3. Формування проекту локального формуляра лікарських засобів з урахуванням результатів ABC/VEN-аналізу
З метою подальшого відбору ЛЗ, використання яких може дати найбільший клінічний та економічний ефект, проводиться АВС/VEN-аналіз.
VEN-аналіз дозволяє формалізовано підійти до оцінки призначення ЛЗ у досліджуваній клінічній ситуації та визначити пріоритетні ЛЗ для закупівлі згідно з їх класифікацією на життєвоважливі (Vital), необхідні (Essential) та другорядні (Non-essential), які трактуються наступним чином:
| Життєвоважливі | ЛЗ, необхідні для врятування життя (наприклад, вакцини); |
|---|---|
| (Vital — V) | ЛЗ, що мають небезпечний для життя синдром відміни і є постійно необхідними для підтримання життя (інсулін, стероїди, пропранолол тощо) |
| Необхідні(Essential — E) | ЛЗ ефективні для лікування менш небезпечних, але серйозних захворювань |
| Другорядні(Non-essential — N) | ЛЗ для лікування легких захворювань, а також ЛЗ сумнівної ефективності щодо лікування данної хвороби або стану, дороговартісні ЛЗ симптоматичного спрямування |
Належність ЛЗ до категорії N не означає повне його виключення з формуляра, а лише черговість забезпечення ним ЗОЗ — закупівлю ЛЗ зазначеної категорії необхідно реалізовувати лише після повного задоволення потреб у життєвоважливих ліках (V).
У випадках значних складностей із розподілом за трьома категоріями (життєвоважливі, необхідні, другорядні) можливо застосовувати спрощену схему — формальний VEN-аналіз, тобто розподіл ЛЗ на дві категорії — життєвоважливі та другорядні (V, N).15
Таблиця 5.
Фрагмент алфавітного покажчика лікарських засобів локального формуляра
| МНН | АТС | Торгова назва | Виробник | Форма випуску/сила дії |
|---|---|---|---|---|
| Гідрокортизон | H02AB09 | ГІДРОКОРТИЗОНУ АЦЕТАТ | ВАТ «Фармак» | Суспензія для ін’єкцій 2,5% по 2 мл в ампулах № 5х2, № 10 |
| ГІДРОКОРТИЗОНУ АЦЕТАТ | ПАТ «ФАРМСТАНДАРТ-БІОЛІК», м. Харків, Україна | Суспензія для ін’єкцій, 25 мг/мл по 2 мл в ампулах № 10 | ||
| ГІДРОКОРТИЗОН-РІХТЕР | ВАТ «Gedeon Richter Ltd», Угорщина | Суспензія для ін’єкцій по 5 мл у флаконах №1 | ||
| КОРТ-С | NEON LABORATORIES LIMITED для»American Norton Corporation», Індія/США | Порошок для приготування розчину для ін’єкцій по 100 мг у флаконах № 1 | ||
| СОЛУ-КОРТЕФ | «Pfizer Manufacturing Belgium N.V.» для «Pfizer Inc.», Бельгія/США | Порошок ліофілізований для приготування розчину для ін’єкцій по 100 мг у флаконах № 1, № 25 | ||
| D07AA02 | ГІДРОКОРТИЗОНОВА МАЗЬ 1% | АТ «Ефект» | Мазь для зовнішнього застосування 1% по 10 г у тубах | |
| ГІДРОКОРТИЗОН | ВАТ «Нижфарм» Російська Федерація | Мазь 1% по 10 г у тубах № 1 | ||
| ЛАТИКОРТ | Фармзавод «Єльфа» A.Т., Польща | Крем 0,1% по 15 г у тубах | ||
| ЛАТИКОРТ | Фармзавод «Єльфа» A.Т., Польща | Мазь 0,1% по 15 г у тубах | ||
| ЛОКОЇД КРЕЛО | Теммлер Італіа С.р.Л., Італія | Емульсія нашкірна 0,1% по 30 г у флаконах №1 | ||
| ЛОКОЇД ЛІПОКРЕМ | Теммлер Італіа С.р.Л., Італія | Крем,1 мг/г по 30 г у тубах | ||
| S01BA02 | ГІДРОКОРТИЗОН | Галеніка а.д., Сербія | Мазь очна 1% по 5 г у тубах | |
| ГІДРОКОРТИЗОН | Фармзавод Єльфа A.Т., Польща | Мазь очна, 5 мг/г по 3 г у тубах № 1 | ||
| ГІДРОКОРТИЗОН — ПОС | УРСАФАРМ Арцнайміттель ГмбХ, Німеччина | Мазь очна, 10 мг/г по 2,5 г у тубах16 |
АВС-аналіз — метод оцінки раціональності використання коштів, який базується на маркетинговому принципі (закон Парето), який стверджує, що 80% від загального обсягу продажу досягається за рахунок не більше, ніж 20% продукції (ЛЗ), і, навпаки, 80% продукції (ЛЗ) забезпечують не більше 20% обігу. ABC-аналіз — це розподіл ЛЗ за трьома класами залежно від обсягів споживання протягом року (вартість одиниці помножена на число річного споживання). АВС-аналіз передбачає розподіл ЛЗ за вартістю річного споживання (одиниця відпуску х річне споживання) на групи:
- Група А — найдорожчі ЛЗ, до 20%, на які витрачається 70–80% бюджету;
- Група В — середній рівень споживання (15–20%);
- Група С — ЛЗ, на які витрачається не більше 5% бюджету.
АВС/VEN-аналіз — метод оцінки раціональності використання бюджету на закупівлю клінічно значущих ЛЗ, який використовується у світовій практиці з 1981 року. Завдяки його використанню ФТК отримує необхідні дані для прийняття рішень щодо вилучення ЛЗ із ЛФ або доповнення його новими ЛЗ, а також інформацію про ті ЛЗ, використання яких є недостатнім чи надмірним.
2.2.4. Оприлюднення проекту локального формуляра лікарських засобів, збір та аналіз пропозицій, затвердження локального формуляра лікарських засобів та його впровадження
Оприлюднення проекту ЛФ забезпечує можливість громадського обговорення серед широкого кола фахівців, пацієнтів та інших зацікавлених осіб у регіоні обслуговування. За наявності єдиної комп’ютерної лікарняної мережі або друкованого видання (газети, бюлетеня) проект ЛФ розміщується серед доступних джерел інформації про ліки. У разі відсутності єдиного інформаційного простору — матеріали розповсюджуються через завідувачів відділеннями для ознайомлення та висловлення думки лікарів та всієї команди співробітників закладу.
Зауваження та пропозиції щодо проекту ЛФ подають на розгляд ФТК, яка виносить обґрунтоване рішення про внесення змін до проекту ЛФ або відхилення пропозицій.
За участі фінансово-економічної служби закладу визначають можливості фінансового забезпечення опрацьованого ЛФ. У випадку недостатнього фінансування перелік ЛЗ скорочують, залишаючи пріоритетні для даного ЗОЗ ЛЗ.
Для зручності користування ЛФ рекомендовано розробляти у наступних форматах, які між собою мають бути тотожними за змістом:
- паперовий;
- електронних формат — Word-документ;
- електронних формат — Exel-документ.
Остаточний варіант опрацьованого ЛФ розглядається на засіданні ФТК. ЛФ, схвалений ФТК, затверджується наказом головного лікаря.
При наявності у розпорядженні ЗОЗ необхідних фінансових ресурсів видається формулярний довідник, у якому на основі ЛФ надається стандартизована об’єктивна інформація про ЛЗ у вигляді формулярних статей.
3. ПІДТРИМКА ЛОКАЛЬНОГО ФОРМУЛЯРА ЛІКАРСЬКИХ ЗАСОБІВ
ЗАКЛАДУ ОХОРОНИ ЗДОРОВ’Я
3.1. Перегляд та оновлення локального формуляра лікарських засобів закладу охорони здоров’я
Перегляд ЛФ здійснюється не менше одного разу на рік або частіше у випадку зміни фінансування ЗОЗ, появи нових даних доказової медицини щодо вибору ЛЗ для ФТ захворювань, отримання нових даних щодо прояву побічних реакцій при застосуванні ЛЗ із наступним вибором ЛЗ із меншою кількістю побічних реакцій, а також отримання оновлених результатів АВС/VEN аналізу та можливості перерозподілу коштів на придбання ЛЗ.
Пропонуємо наступний порядок перегляду та оновлення ЛФ (Рис.1).
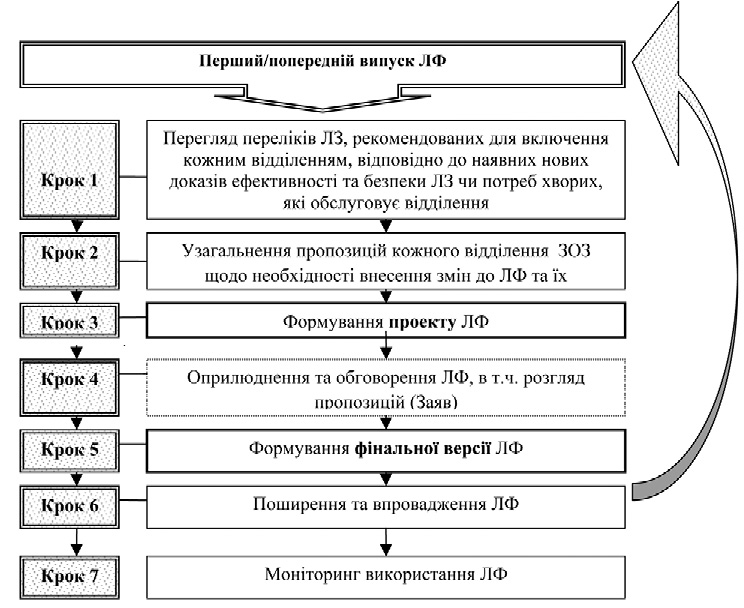
Рис. 1. Етапи перегляду та оновлення ЛФ
Аналіз пропозицій та зауважень стосовно формулярного переліку ЛЗ, на основі заявок щодо включення/виключення ЛЗ до/з ЛФ (далі — Заявка), відповідно до форми визначеної наказом МОЗ України від 22.07.2009 р. №529 р., здійснюється ФТК протягом одного місяця з дня її подання для прийняття вмотивованого рішення.
Заявка заповнюється лікарем даного ЗОЗ державної або комунальної форми власності відповідно до наявної інформації про ефективність та безпечність ЛЗ та з врахуванням потреби у ньому відповідно до структури захворюваності у даному закладі. Про результати розгляду Заявки ФТК інформує заявника листом, що містить копію Заявки із заповненим висновком.
Заповнена Заявка аналізується не лише на предмет можливості включення ЛЗ до ЛФ, а й вилучення формулярного ЛЗ, що використовуються за аналогічними показаннями. Критерії порівняння включають вартість конкурентних ЛЗ, характеристики їх ефективності та безпеки. Важливо врахувати, наскільки використання даного ЛЗ виправдовує витрати на його придбання та застосування, оскільки розробка ЛФ ставить за мету не тільки скорочення витрат на закупівлю ліків, але й загальну економію бюджетних коштів, необхідних для лікування певних захворювань.
Результати порівняльного аналізу обох ЛЗ обговорюється на засіданні ФТК. Заявлений ЛЗ може бути включений до оновленого ЛФ за умови існування обґрунтованої потреби у даному ЛЗ та відсутності терапевтично еквівалентного ЛЗ з числа тих ліків, що вже включені до ЛФ.
Об’єктивну оцінку опрацьованому та впровадженому у медичну практику ЛФ також забезпечують результати АВС/VEN аналізу, які слід враховувати при перегляді ЛФ з метою раціоналізації витрат бюджетних коштів відповідно до важливості призначення ЛЗ для ФТ захворювань.
Використання неформулярних лікарських засобів. Як правило, у ЗОЗ при проведенні ФТ за бюджетні кошти дозволено використовувати лише ті ЛЗ, що увійшли до ЛФ. При сплаті вартості ФТ з інших джерел фінансування (не за кошти ЗОЗ) це правило не працює. Проте, не завжди можна задовольнити терапевтичні потреби окремих пацієнтів лише за рахунок
даного списку. ФТК має регулярно аналізувати усі запити на не формулярні ЛЗ. Якщо в результаті такого аналізу з’ясується, що часто надходять запити на конкретний ЛЗ і він є обґрунтовано кращим за свій формулярний аналог, ФТК може прийняти рішення щодо включення нового ЛЗ до ЛФ замість його попереднього аналога.
І, навпаки, якщо ФТК вирішить, що регулярне використання неформулярного ЛЗ є необгрунтованим, необхідно розробляти та впроваджувати спеціальні програми підготовки для лікарів або направити окремих медичних працівників на курси підвищення кваліфікації.
Вилучення ЛЗ із ЛФ, зазвичай, відбувається достатньо рідко. Як правило, це трапляється в результаті повторного аналізу терапевтичних класів ЛЗ, виконання програм моніторинга побічних реакцій або програм оцінки використання ЛЗ, тобто впровадження інших методів збору інформації щодо раціонального застосування ЛЗ.
Інформування медичного персоналу закладу про усі зміни у ЛФ можна забезпечити кількома шляхами:
- розсилати по відділеннях інформаційні листи чи спеціальні клініко- фармацевтичні повідомлення клінічного провізора про зміни у ЛФ з короткою характеристикою долученого до списку ЛЗ (найбільш надійний спосіб поширення інформації);
- усно розповсюджувати інформацію на конференціях та семінарах;
- розповсюджувати у ЗОЗ протоколи засідань ФТК.
3.2. Інші механізми підтримки локального формуляра лікарських засобів закладу охорони здоров’я
Окрім перегляду та оновлення локального формуляра ефективними є наступні механізми його підтримки:
А) Моніторинг ФС на локальному рівні.
Б) Розробка та впровадження локальних протоколів медичної допомоги.
В) Моніторинг побічних реакцій ЛЗ.
Г) Впровадження програм оцінки використання ЛЗ.
З метою коригування, забезпечення ефективного використання ресурсів ФТ, досягнення запланованих терапевтичних ефектів та мінімізації негативних наслідків, а також визначення можливостей подальшого зростання ефективності впровадження ЛФ у ЗОЗ необхідно здійснювати комплексний моніторинг ФС на локальному рівні. Оскільки ЛФ є інструментом ФС на її локальному рівні, то для вирішення вищевказаних завдань необхідно дотримуватись загальних методичних принципів здійснення моніторингу ФС, визначених наказом МОЗ України від 28.10.2010 р. №918 «Про затвердження Методичних рекомендацій щодо моніторингу та дієвості формулярної системи на етапі її впровадження». Моніторинг ЛФ передбачає визначення та оцінку критеріїв та індикаторів якості впровадження ФС на локальному рівні.
На даний час розробка та впровадження локальних протоколів медичної допомоги (далі — ЛПМД) в Україні здійснюється відповідно до Уніфікованої методики з розробки клінічних настанов, медичних стандартів, уніфікованих клінічних протоколів медичної допомоги, локальних протоколів медичної допомоги (клінічних маршрутів пацієнтів) на засадах доказової медицини (частина друга), що затверджена наказом МОЗ та НАМН України від 03.11.2009 №798/75. Слід зауважити, що медико-технологічні документи, які розробляються на рівні ЗОЗ — ЛФ та ЛПМД — є документами гармонізованими між собою, оскільки ґрунтуються на єдиних джерелах доказової медицини. ЛФ та ЛПМД безпосередньо пов’язані з Державним формуляром та уніфікованим протоколом медичної допомоги (далі — УКПМД).
Моніторинг побічних реакцій ЛЗ як метод збору інформації про безпеку ЛЗ (наказ МОЗ України від 24.07.2009 р. №531, зареєстрований в Міністерстві юстиції України №774/16790 від 17.08.2009 р., наказ МОЗ України від 01.09.2009 №654).
Впровадження програм оцінки використання ЛЗ, яка дозволяє виявити випадки неправильної, нераціональної терапії, а також застосування ліків, що мають невиправдано високу вартість. Програма може бути спланована як для проведення моніторингу використання окремих ліків, так і терапевтичних груп ЛЗ чи лікування окремих захворювань.22
З цією метою ФТК визначаються пріоритетні групи ЛЗ, більш ефективне використання яких може мати найбільший клінічний та економічний ефект.
Це можуть бути ЛЗ з наступними характеристиками:
- ЛЗ, що мають високу вартість або використовуються у великій кількості (за результатами АВС/VEN-аналізу);
- ЛЗ, що застосовуються для лікування пацієнтів груп ризику (літні люди, діти, вагітні, пацієнти відділення інтенсивної терапії тощо);
- ЛЗ, які мають серйозні побічні реакції, вузький терапевтичний діапазон;
- ЛЗ, які застосовуються для лікування найбільш розповсюджених захворювань;
- ЛЗ, які розглядаються на предмет включення до ЛФ;
- нові ЛЗ, які включені до ЛФ.
Загальні підходи до оцінки використання ЛЗ, порядок її здійснення будуть освітлені в подальших методичних рекомендаціях.23
Додаток 1.
Форма 1. Таблиця формування попереднього переліку
ЛЗ для розрахунку річної потреби відділення
у лікарських засобах з обґрунтуванням їх
подальшого включення до локального формуляру
| Код захворювання за МКХ-10 | Нозологічна форма | Кількість пролікованих хворих із даною патологією за рік, осіб | Кількість ліжко-днів на 1 хворого з даної патології у звітному році | Міжнародна непатентована назва ЛЗ | АТС-код ЛЗ | Торгова назва ЛЗ | Форма випуску | Наявність ЛЗ у Державному формулярі ЛЗ, останній випуск, (відповідно до зазначених показань) | Наявність рекомендацій до застосування ЛЗ у локальному протоколі / клінічному протоколі (за наявності останнього) | VEN-клас | Кількість ЛЗ на 1 добу лікування одного хворого (відповідно до протоколів лікування) | Кількість ЛЗ на курс лікування одного хворого (відповідно до протоколів лікування) | Річна потреба (у табл., амп. або DDD) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
Додаток 2.
Форма 2. Зведена таблиця формування переліку ЛЗ
для розрахунку річної потреби закладу охорони здоров’я у
лікарських засобах з обґрунтуванням їх
подальшого включення до локального формуляра
| Фармакотерапевтична група відповідно до АТС-класифікації | Міжнародна непатентована назва ЛЗ | АТС-код | Наявність ЛЗ у Державному формулярі ЛЗ, останній випуск, (відповідно до зазначених показань) | Наявність рекомендацій до застосування ЛЗ у локальному протоколі / клінічному протоколі | Торгова назва ЛЗ | Форма випуску | VEN-клас | АВС-клас | Наявність локальної інформації про безпеку та ефективність ЛЗ | Річна потреба (у табл., амп. або DDD) | Річна потреба, грн. |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
Додаток 3. Форма Заявки щодо
включення/виключення лікарського
засобу до/з Локального формуляра
Голові фармакотерапевтичної комісії
___________________________
(прізвище, ім’я, по батькові)
Заявка щодо включення/виключення лікарського засобу до/з Локального формуляра
(Заповнюється лікарем)
1. Назва лікарського засобу:
1.1. Торгова назва лікарського засобу
1.2. Міжнародна непатентована назва лікарського засобу
2. Лікарська форма і дозування
3. Показання для медичного застосування
___________________________________________________________________________________________
(продовжити, скільки потрібно)
4. Заява про наявність фінансових або інших інтересів щодо заявленого лікарського засобу
5. Заявка подана
___________________________________________________________________________________________
(заклад охорони здоров’я, відділення, лікар — П.І.Б.)
(дата) (підпис)
6. Висновок фармакотерапевтичної комісії закладу охорони здоров’я
______________________________
(дата)
Голова фармакотерапевтичної
Комісії _____________________ ___________________________________
(підпис) (прізвище, ім’я, по батькові, посада)

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим