ПРОЕКТ
Міністерство охорони здоров’я України
ДП «Державний експертний центр МОЗ України»
МОНІТОРИНГ ПОБІЧНИХ РЕАКЦІЙ ПРИ ПРОВЕДЕННІ КЛІНІЧНИХ ВИПРОБУВАНЬ ЛІКАРСЬКИХ ЗАСОБІВ В УКРАЇНІ
Методичні рекомендації
Київ 2014
ЗМІСТ
ВСТУП………………………………………………………………………………………………….3
ВИЗНАЧЕННЯ ТЕРМІНІВ…………………………………………………………………………..5
ОРГАНІЗАЦІЯ ЗБОРУ, ПЕРЕВІРКИ ТА НАДАННЯ ПОВІДОМЛЕНЬ
ПРО ПОБІЧНІ ЯВИЩА/РЕАКЦІЇ…………………………………………………………………..9
2.1. Повідомлення про ПЯ/СПЯ/СПР, які надає відповідальний дослідник/
дослідник до спонсора……………………………………………………………………………..9
2.2. Повідомлення про СПЯ/СПР/ПНСПР, які відповідальний дослідник/
дослідник надає до комісії з питань етики……………………………………………………12
2.3.Повідомлення про ПНСПР та звіти з безпечності ДЛЗ, які спонсор надає
до Центру та до комісії з питань етики………………………………………………………..13
2.4. Повідомлення про ПНСПР, які спонсор надає до відповідального
дослідника/дослідника…………………………………..……………..…………………………17
2.5. Реєстрація та аналіз повідомлень про ПНСПР та звітів з безпечності ДЛЗ
Центром………………………………………………………………………..……………………..18
Додаток 1 Вимоги до складання повідомлення про ПНСПР……………………………19
Додаток 2 Вимоги до структури оновлюваного звіту з безпеки ДЛЗ, що перебуває
у стадії розробки (DSUR)………………………………………………………………………….22
Додаток 3 Схема надання повідомлень про випадки ПНСПР, DSUR та іншу
Інформацію з безпеки ДЛЗ……………………………………………………………………….24
Література……………………………………………………………………………………………..25
ВСТУП
Клінічні випробування (КВ) лікарських засобів (ЛЗ) у всьому світі є невід’ємним етапом розробки лікарських засобів, який передує його реєстрації та широкому медичному застосуванню.
КВ ЛЗ повинні проводитися згідно з етичними принципами Гельсінської декларації, правилами належної клінічної практики і діючими регуляторними вимогами. Необхідною умовою проведення КВ ЛЗ, що покладено в основу принципів належної клінічної практики, є те, що КВ може проводитись лише в тому разі, якщо очікувана користь виправдовує ризик. Тобто, до початку КВ, має бути проведена оцінка співвідношення ризику, що передбачається, та очікуваної користі для суб’єкта випробування та суспільства. При цьому, права, безпека і благополуччя суб’єктів випробування завжди важливіші від інтересів науки і суспільства.
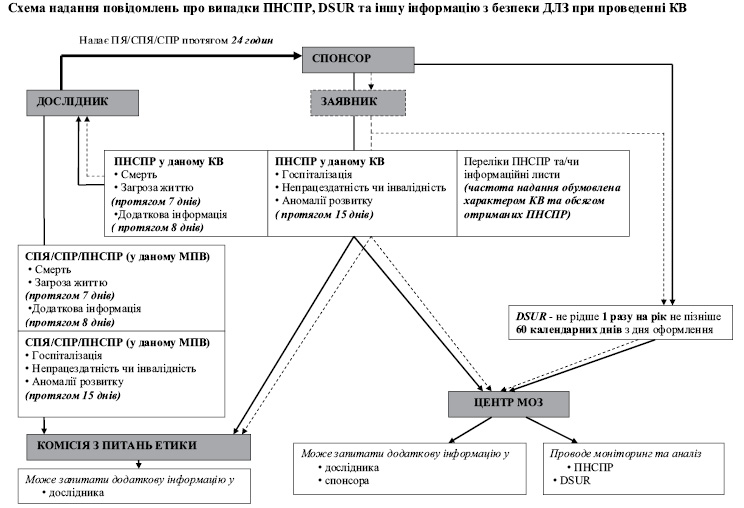
Проведення КВ — складний процес, що включає взаємодію багатьох сторін, зокрема, спонсора КВ, лікаря-дослідника, комісії з питань етики при лікувально-профілактичному закладі, Державного експертного Центру МОЗ України (далі — Центр) та пацієнта, які, серед іншого, в той чи інший спосіб залучаються до моніторингу безпеки лікарських засобів, що досліджуються. Схема надання повідомлень про випадки підозрюваних непередбачуваних серйозних побічних реакцій (ПНСПР), оновлюваного звіту з безпеки ДЛЗ, що перебуває у стадії розробки (DSUR- Development Safety Update Report) та іншої інформацію з безпеки досліджуваного лікарського засобу (ДЛЗ) наведена в додатку 3.
Необхідною умовою отримання адекватних даних щодо безпеки ДЛЗ є ретельно спланований і належним чином представлений в документації збір інформації про побічні реакції (ПР) в ході проведення КВ, їх оцінка та аналіз.
Планування, організація та проведення КВ в Україні здійснюються відповідно до чинної нормативно-правової бази, а саме:
- Закону України «Про лікарські засоби», 1996, ст.7 та 8 зі змінами, внесеними Законом України «Про внесення змін до деяких законодавчих актів України щодо клінічних випробувань лікарських засобів» (затверджений 12.05.2011 р., вступив в силу 05.06.2011 р.);
- Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань та Типового положення про Комісію з питань етики, затвердженими наказом МОЗ України від 23.09.2009 р. за № 690 (зареєстрований в Міністерстві юстиції України 29.10.2009 за № 1010/17026 та 1011/17027) із змінами, внесеними Наказом МОЗ України від 12.07.2012 р. за № 523 (зареєстрований в Міністерстві Юстиції від 20.07.2012 р. за № 1235/21547 та № 1236/21548 (далі — Порядок);
- Настанови з клінічних досліджень 42-7.1:2005. Лікарські засоби. Дослідження біодоступності та біоеквівалентності, затвердженої наказом МОЗ України від 25.04.2005 р. за № 191.;
- Порядку ввезення на територію України незареєстрованих лікарських засобів, стандартних зразків, реагентів, який затверджено наказом МОЗ України від 26.04.2011р за № 237 (зареєстрований в Міністерстві юстиції України від 11.01.2011 р. за № 965/19703);
- Цивільного кодексу України, 2003р. із змінами, внесеними Законом України від 12.05.2011 р. за № 3323-VI;
- Постанови Кабінету Міністрів України «Про затвердження переліку платних послуг, які надаються в державних закладах охорони здоров’я та вищих медичних закладах освіти» від 17.09.1996 р. за № 1138 із змінами;
- Наказу МОЗ України від 09.02.2012 р. № 98 «Про взаємодію Управління розвитку фармацевтичного сектору галузі охорони здоров’я МОЗ України та ДП «Державний експертний центр МОЗ України» із змінами, внесеними Наказом МОЗ України від 07.03.2012 р. за № 158;
- Настанови з клінічних досліджень 42-7.0:2008. Лікарські засоби. Належна клінічна практика, затвердженої наказом МОЗ України від 16.02.2009 за № 95 (далі — Настанова).
Ці методичні рекомендації укладені у відповідності до чинної в Україні нормативно-правової бази, а також з урахуванням положень міжнародних стандартів у галузі проведення КВ:
- Директиви Європейського Парламенту та Ради ЄС 2001/20/ЕС «Про наближення законів, підзаконних актів і адміністративних положень держав-членів стосовно запровадження належної клінічної практики при проведенні КВ ЛЗ для застосування людиною» від 4 квітня 2001 із змінами;
- Директиви Європейського Парламенту та Ради про наближення законів, підзаконних актів та адміністративних положень держав-членів стосовно запровадження належної клінічної практики при проведенні клінічних випробувань лікарських засобів для вживання людиною,ЄС 2001/83/EC з поправками від 4.04.2001 р.;
- Модуля ICH: E2A Оцінка клінічних даних з безпеки: визначення та стандарти для експрес-звітності (Clinical Safety Data Management: Definitions and Standards for Expedited Reporting), червень 1995 р.;
- Модуля ICH: E2F «Оновлюваний звіт з безпеки ліків, що знаходяться в стадії розробки» (DSUR-Development Safety Update Report, EMA/CHMP/ICH/ 309348/2008), серпень 2011 р.;
- Детального керівництва зі збору, перевірки та надання повідомлень про побічні реакції в процесі клінічних випробувань медичних продуктів для вживання людиною (Detailed guidance on the collection, verification and presentation of adverse reaction reports arising from clinical trials on medicinal products for human use, (СТ-3), 2011/C 172/01), 2010 р.
1. ВИЗНАЧЕННЯ ТЕРМІНІВ
У даних методичних рекомендаціях терміни вживаються у такому значенні:
Багатоцентрове клінічне випробування (дослідження) (КВ) — випробування лікарського засобу відповідно до єдиного протоколу клінічного випробування, що проводиться більш ніж в одному місці проведення дослідження;
Брошура дослідника — реферативний виклад доклінічних та клінічних даних про досліджуваний лікарський засіб, які мають значення для його вивчення на людині;
Досліджуваний (суб’єкт дослідження) — пацієнт (здоровий доброволець), який згідно з чинним порядком бере участь у клінічному випробуванні;
Досліджуваний лікарський засіб (ДЛЗ) —лікарська форма активної субстанції або плацебо, що вивчається або використовується для порівняння у клінічних випробуваннях, включаючи препарати, на які вже видане реєстраційне посвідчення, але вони використовуються або виготовляються (складені або упаковані) в інший спосіб порівняно із зареєстрованою лікарською формою, або використовуються за незареєстрованими показами, або ж використовуються для отримання додаткової інформації про зареєстровану форму лікарського засобу;
Дослідник/співдослідник — лікар, який має достатню професійну підготовку та досвід лікування пацієнтів, знає правила належної клінічної практики та відповідні нормативно-правові акти. Дослідник несе відповідальність за проведення у місці дослідження клінічного випробування лікарського засобу. Якщо клінічне випробування проводиться групою осіб у певному місці проведення дослідження, один із дослідників визначається відповідальним керівником дослідницької групи і може називатися відповідальним дослідником;
Заявник клінічного випробування — фізична або юридична особа (наприклад, спонсор, контрактна дослідницька організація), яка подає заяву до Центру для одержання висновку щодо проведення клінічного випробування / щодо суттєвої поправки. Заявник, якщо він не є спонсором, може подавати заяву лише за наявності доручення, виданого спонсором, з чітко визначеними делегованими повноваженнями;
Заклад охорони здоров’я (лікувально-профілактичний заклад) (ЛПЗ) — юридична особа будь-якої форми власності та організаційно-правової форми або її відокремлений підрозділ, основними завданнями яких є забезпечення медичного обслуговування населення на основі відповідної ліцензії та професійної діяльності медичних (фармацевтичних) працівників;
Звіт про клінічне випробування — надані в письмовій формі результати клінічного випробування та їх аналіз;
Ідентифікаційний код досліджуваного/рандомізаційний код — унікальний ідентифікатор, що присвоюється дослідником кожному суб’єкту випробування для забезпечення його анонімності та використовується замість прізвища у матеріалах клінічного випробування;
Клінічне випробування (дослідження) лікарського засобу (КВ) — науково-дослідницька робота, метою якої є будь-яке дослідження за участю людини як суб’єкта дослідження, призначене для виявлення або підтвердження клінічних, фармакокінетичних, фармакодинамічних та/або інших ефектів, у тому числі для вивчення усмоктування, розподілу, метаболізму та виведення одного або кількох лікарських засобів та/або виявлення побічних реакцій на один або декілька досліджуваних лікарських засобів з метою оцінки його (їх) безпечності та/або ефективності;
Комісія з питань етики при лікувально-профілактичному закладі (комісія з питань етики при ЛПЗ) — незалежний орган, що діє при закладі охорони здоров’я (лікувально-профілактичному закладі), де проводяться клінічні випробування, який включає медичних/наукових спеціалістів, осіб інших спеціальностей, представників громадськості, які здійснюють нагляд за дотриманням прав, безпекою, благополуччям досліджуваних пацієнтів (здорових добровольців), етичних та морально-правових принципів проведення клінічного дослідження. На підставі оцінки етичних та морально-правових принципів погоджує проведення клінічного випробування безпосередньо у місці його проведення, що розташовується на базі ЛПЗ, при якому створена і діє ця комісія;
Контрактна дослідницька організація (КДО) — фізична або юридична особа, яка в рамках угоди зі спонсором виконує одну чи більше його функцій (повноважень) у клінічному випробуванні й діє на підставі доручення, виданого спонсором, з чітко визначеними делегованими повноваженнями;
Лікарські засоби (ЛЗ) — речовини або їх суміші природного, синтетичного чи біотехнологічного походження, які застосовуються для запобігання вагітності, профілактики, діагностики та лікування захворювань людей або зміни стану і функцій організму;
Місце проведення випробування (МПВ) — місце, де безпосередньо проводиться основна діяльність, пов’язана з клінічним випробуванням (включення пацієнтів, лікування, спостереження тощо), у лікувально-профілактичному закладі;
Непередбачувана побічна реакція(НПР) — побічна реакція, характер або тяжкість якої не узгоджується з наявною інформацією про лікарський засіб (наприклад, з брошурою дослідника для незареєстрованого лікарського засобу або з інструкцією з медичного застосування / короткою характеристикою для зареєстрованого лікарського засобу);
Пацієнт (здоровий доброволець) — особа, яка може бути залучена як досліджувана до клінічного випробування лікарського засобу;
Побічна реакція (ПР) — у межах клінічного випробування лікарського засобу (оригінального/генеричного) або його вивчення за новим використанням, особливо в разі, якщо терапевтичні дози лікарського засобу не встановлені, до побічних реакцій на лікарський засіб треба відносити всі негативні та непередбачувані відповіді на введення лікарського засобу будь-якої дози. Термін «відповідь на введення лікарського засобу» означає, що існує принаймні припустима вірогідність причинно-наслідкового зв’язку між застосуванням лікарського засобу та побічною реакцією, тобто взаємозв’язок не можна виключити.
Щодо зареєстрованих лікарських засобів цей термін означає всі негативні або непередбачувані реакції, пов’язані із застосуванням лікарського засобу у звичайних дозах з метою профілактики, діагностики або лікування захворювань, відновлення, корекції або впливу на фізіологічні функції;
Побічне явище (ПЯ) — будь-який несприятливий медичний прояв у досліджуваного, який не обов’язково має причинний зв’язок із застосуванням лікарського засобу. Побічним явищем може бути будь-який небажаний та непередбачуваний прояв (у тому числі зміни лабораторних даних), симптом або захворювання, які збігаються за часом із застосуванням (досліджуваного) лікарського засобу, незалежно від того, пов’язано це з прийомом (досліджуваного) лікарського засобу чи ні;
Серйозна побічна реакція або серйозне побічне явище (СПЯ або СПР) — будь-який несприятливий медичний прояв при застосуванні лікарського засобу (незалежно від дозування), який призводить до смерті; являє загрозу життю; вимагає госпіталізації або продовження терміну існуючої госпіталізації; призводить до довготривалої або значної непрацездатності чи інвалідності, до вроджених аномалій чи вад розвитку;
Спонсор — юридична або фізична особа, яка несе відповідальність за ініціацію та організацію клінічного випробування лікарського засобу та/або його фінансування.
Стандартна операційна процедура(СОП) — докладні письмові інструкції, які забезпечують одноманітність здійснення певних функцій.
Файл дослідника — у відповідності з GCP, дослідник повинен зберігати копії усіх документів дослідження (ідентифікаційний список пацієнтів, вихідні документи, підписану фінальну версію протоколу, чисту копію фінальної версії індивідуальної реєстраційної форми) й переписку з Етичним комітетом й компанією-спонсором протягом 15 років.
Інші терміни стосовно проведення клінічних випробувань наведені в Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань»,затвердженого наказом МОЗ України від 23.09.2009 р. № 690 (із змінами, внесеними згідно з Наказом Міністерства охорони здоров’я України № 523 від 12.07.2012).
2. ОРГАНІЗАЦІЯ ЗБОРУ, ПЕРЕВІРКИ ТА НАДАННЯ ПОВІДОМЛЕНЬ ПРО ПОБІЧНІ ЯВИЩА/РЕАКЦІЇ
КВ в Україні може розпочинатися в кожному конкретному МПВ за наявності позитивного висновку експертизи матеріалів щодо проведення КВ, який надається Центром та затверджується Центральним органом виконавчої влади у галузі охорони здоров’я (ЦОВВ), протоколу комісії з питань етики при ЛПЗ щодо погодження КВ і за умови оформлення договірних відносин між усіма юридичними та фізичними особами, які залучені до проведення КВ. [1]
Початком надання повідомлень про випадки ПЯ/СПЯ/СПР/ПНСПР дослідником спонсору, дослідником до комісії з питань етики, спонсором до дослідників та спонсором до комісії з питань етики є дата початку КВ в Україні (підписання першим пацієнтом (здоровим добровольцем) інформованої згоди на участь у КВ)). Закінченням надання повідомлень про ПЯ/СПЯ/СПР/ПНСПР є дата завершення КВ в Україні (дата останнього візиту останнього досліджуваного). [1]
Cпонсор починає надавати повідомлення про випадки ПНСПР до Центру з дати затвердження ЦОВВ висновку Центру щодо проведення КВ та завершує із закінченням КВ в Україні (дата останнього візиту останнього досліджуваного).
Повідомлення про конкретний випадок ПНСПР надаються спонсором до Центру до тих пір, поки цей випадок не закінчиться або не буде переведений до категорії не пов’язаний з ДЛЗ.
Спонсор може делегувати будь-які або всі свої функції, зокрема, надання до комісії з питань етики при ЛПЗ та до Центру повідомлень про випадки ПНСПР, контрактній дослідницькій організації (заявнику КВ). [1]
Спонсор надає до Центру інформацію про випадки ПНСПР, що сталися у всьому світі під час даного КВ ДЛЗ, а саме: [4]
- про випадки ПНСПР, які трапилися в Україні в межах затвердженого КВ, яке проводить саме цей спонсор та які стосуються даного ДЛЗ (у тому числі референтного препарату);
- про випадки ПНСПР, які трапилися у світі в межах цього ж КВ, яке проводить саме цей спонсор та які стосуються даного ДЛЗ (у тому числі референтного препарату);
- інша інформація з безпечності ДЛЗ, яка стала відома даному спонсору КВ (повідомлення про випадки ПНСПР, які трапилися в межах інших КВ, які проводить даний спонсор чи інший спонсор з цим самим ДЛЗ; дані з неінтервенційних КВ, тощо) з метою уникнення дублювання надання інформації про випадки ПНСПР може надаватися до Центру у інформаційних листах стосовно нової інформації з безпечності ДЛЗ чи/та у складі періодичних звітів з безпечності ДЛЗ.
2.1. ПОВІДОМЛЕННЯ ПРО ПЯ/СПЯ/СПР, ЯКІ НАДАЄ ВІДПОВІДАЛЬНИЙ ДОСЛІДНИК / ДОСЛІДНИК ДО СПОНСОРА
2.1.1. Надання дослідником спонсору повідомлень про випадки ПЯ/СПЯ/СПР (звітний період) починається з дати початку КВ у відповідному місці проведення дослідження (підписання першим пацієнтом (здоровим добровольцем) інформованої згоди) та завершується із закінченням КВ у відповідному місці проведення дослідження (дата останнього візиту останнього досліджуваного). [1]
2.1.2. Під час проведення КВ відповідальний дослідник/дослідник терміново повідомляє спонсора про всі ПЯ/СПЯ/СПР (термін надання інформації спонсор зазначає у протоколі та/або брошурі дослідника, який, зазвичай, не перевищує 24 годин від моменту, коли досліднику стало відомо про цей випадок), крім тих, які у протоколі або брошурі дослідника визначені як такі, що не потребують негайного повідомлення. У первинних і наступних повідомленнях досліджувані визначаються за ідентифікаційним (рандомізаційним) кодом досліджуваного, що їм був привласнений під час дослідження. [1]
Важливо: відповідальний дослідник/дослідник повинен заповнити стандартну форму експрес — звіту про випадок ПЯ/СПЯ/СПР та направити його спонсору факсом або на електронну адресу. Допускається попереднє усне повідомлення про випадок ПЯ/СПЯ/СПР, але після цього відповідальний дослідник/дослідник повинен заповнити стандартну форму експрес — звіту про випадок ПЯ/СПЯ/СПР та надіслати спонсору. Зазвичай, стандартну форму експрес-звіту про випадок ПЯ/СПЯ/СПР спонсор надає у протоколі КВ. Вимоги до складання повідомлення про випадок ПЯ/СПЯ/СПР наведені в додатку 1.
2.1.3. Відповідальний дослідник/дослідник повідомляє спонсора також про всі випадки ПЯ та/або відхилення від норми лабораторних показників, визначені у протоколі КВ як критичні для оцінки безпеки відповідно до вимог та в строки, зазначені спонсором у протоколі КВ. [1]
2.1.4. При виникненні випадку ПЯ/ПР досліднику необхідно визначити чи відноситься воно до категорії «серйозного»: призвело до смерті; являло загрозу життю; вимагало госпіталізації або продовження терміну існуючої госпіталізації; призвело до довготривалої або значної непрацездатності чи інвалідності, до вроджених аномалій чи вад розвитку. [4]
У разі смерті досліджуваного відповідальний дослідник/дослідник, крім термінового повідомлення, на вимогу спонсора, Центра та комісії з питань етики при ЛПЗ, надає всю запитувану ними додаткову інформацію. [1]
Важливо: Термінове повідомлення щодо випадку ПЯ/СПЯ/СПР надає спонсору можливість здійснити відповідні заходи для попередження потенційно нових ризиків щодо застосування ДЛЗ у КВ. [4]
Наступне (уточнювальне) повідомлення щодо випадку ПЯ/СПЯ/СПР має надати спонсору можливість визначити чи потребує цей випадок переоцінки співвідношення ризик/користь КВ, якщо інформації у первинному повідомленні було недостатньо для цього. [4]
2.1.5. Випадки ПЯ, які у протоколі КВ або у брошурі дослідника визначені як такі, що не потребують негайного повідомлення, відповідальний дослідник/ дослідник надає у термін, який передбачений протоколом КВ або зазначений у брошурі дослідника в залежності від особливостей КВ. [4]
2.1.6. Досліднику також необхідно визначити причинно-наслідковий зв’язок між випадком ПЯ та ДЛЗ, у тому числі з препаратом порівняння та/або плацебо. Існують різні підходи для опису причинно-наслідкового зв’язку між ДЛЗ та ПЯ, що відображені у відповідних класифікаціях. За якою саме класифікацією дослідники повинні визначати причинно-наслідковий зв’язок між випадком ПЯ та ДЛЗ спонсор зазначає у протоколі та/або брошурі дослідника. При цьому найчастіше використовуються наступні 2 класифікаційні системи:
I класифікаційна система
1) зв’язок достовірний (definite) — зв’язок між ПЯ й ДЛЗ не викликає сумнівів;
2) вірогідний (probable) — ПЯ вірогідно пов’язане з прийомом ДЛЗ;
3) можливий (possible) — ПЯ може бути пов’язане з ДЛЗ;
4) малоймовірний (unlikely) — присутність зв’язку між ПЯ та ДЛЗ викликає сумнів;
5) немає зв’язку (unrelated) — ПЯ не пов’язане з ДЛЗ.
II класифікаційна система
1) визначений зв’язок (definite) — ознаки та перебіг ПЯ, яке виникло після введення ДЛЗ, характерні для цього препарату. Реакція повторюється після повторного введення ДЛЗ;
2) вірогідний зв’язок (probable) — ознаки та перебіг ПЯ, яке виникло після введення ДЛЗ, характерні для цього препарату. Реакція не може бути роз’яснена клінічним станом пацієнта або викликаним супутнім лікуванням;
3) можливий зв’язок (possible) — ознаки та перебіг ПЯ, яке виникло після введення ДЛЗ, характерні для цього препарату. Однак, також існує ймовірність того, що ПЯ викликане клінічним станом пацієнта або супутнім лікуванням;
4) віддалений зв’язок (remote) — зв’язок ПЯ з прийомом ДЛЗ малоймовірний;
5) немає зв’язку (none) — зв’язку між ПЯ та прийомом ДЛЗ немає, явище пов’язане з супутнім лікуванням або клінічним станом пацієнта. [3]
Важливо: Особливе значення мають повідомлення щодо випадків настання вагітності у досліджуваних/їх статевих партнерів у КВ, де вагітність вважається критерієм виключення, а досліджувані дають згоду на використання ефективних методів контрацепції. У випадках наявності вагітності у досліджуваних/їх статевих партнерів досліднику необхідно отримати інформацію щодо перебігу вагітності й пологів, стану новонародженого при народженні та у неонатальний період для виявлення можливих вад розвитку та вроджених аномалій, стану матері після пологів. Якщо у новонародженого буде виявлено дефекти розвитку, то це має розцінюватися як СПЯ, інформацію про яке дослідник надає до відома спонсора у письмовому або електронному вигляді.
2.2. ПОВІДОМЛЕННЯ ПРО СПЯ/СПР/ПНСПР, ЯКІ ВІДПОВІДАЛЬНИЙ ДОСЛІДНИК / ДОСЛІДНИК НАДАЄ ДО КОМІСІЇ З ПИТАНЬ ЕТИКИ
2.2.1. Надання дослідником до комісії з питань етики повідомлень про випадки СПЯ/СПР/ПНСПР (звітний період) починається з дати початку КВ у відповідному місці проведення дослідження (підписання першим пацієнтом (здоровим добровольцем) інформованої згоди) та завершується із закінченням КВ у відповідному місці проведення дослідження (дата останнього візиту останнього досліджуваного). [1]
2.2.2. Відповідальний дослідник / дослідник негайно реєструє і протягом 7 календарних днів з дати, коли це стало йому відомо, повідомляє комісію з питань етики про всі випадки СПЯ/СПР/ПНСПР, що сталися у відповідному місці проведення дослідження та які стосуються ДЛЗ, що призвели до смерті або являли загрозу для життя досліджуваного. Додаткова інформація щодо цього випадку(ів) СПЯ/СПР/ПНСПР надається комісії з питань етики протягом наступних 8 календарних днів. [1]
2.2.3. У разі смерті досліджуваного відповідальний дослідник / дослідник надає спонсору, Центру і комісії з питань етики всю витребувану ними додаткову інформацію стосовно цього смертельного випадку, що стався у відповідному місці проведення дослідження. [1]
Важливо: У разі якщо кінцевий термін надання інформації про випадок СПЯ/СПР/ПНСПР припадає на вихідний або святковий день, інформація повинна бути надана у перший після нього робочий день.
2.2.4. Не пізніше 15 календарних днів з дати, коли це стало йому відомо, відповідальний дослідник / дослідник повідомляє комісію з питань етики про всі інші випадки ПНСПР, що сталися у відповідному місці проведення дослідження та які стосуються ДЛЗ. [1]
Важливо: Поняття «важкість» та «серйозність» не є синонімами. Термін «важке» використовують для опису інтенсивності (вираженості) побічного явища. Термін «серйозне» (див. Розділ «Терміни та визначення») використовується для опису закінчення побічного явища та/або характеру медичного втручання, яке знадобилося для його усунення. Наприклад, головний біль може бути важким явищем, але не мати ознак СПЯ (не вимагати госпіталізації або продовження терміну існуючої госпіталізації; не призводити до довготривалої або значної непрацездатності чи інвалідності і т.п.). У той же час інсульт легкого ступеня важкості, для лікування якого була необхідна госпіталізація, є серйозним побічним явищем. Тобто, саме серйозністю (а не важкістю) явища необхідно керуватися для термінового надання повідомлення про СПЯ/СПР/ПНСПР до комісії з питань етики при ЛПЗ із зазначенням заходів щодо усунення цих явищ. [3]
2.2.5. Процедура надання дослідником до комісії з питань етики повідомлень про випадки СПЯ/СПР/ПНСПР (у паперовому чи електронному вигляді), зокрема, реєстрація, аналіз та термін зберігання повідомлень про випадки СПЯ/СПР/ПНСПР, повинна бути чітко визначена у стандартних операційних процедурах комісії з питань етики при ЛПЗ. Ці стандартні операційні процедури мають відповідати положенням «Настанови Лікарські засоби. Належна клінічна практика СТ-Н МОЗ 42-7.0:2008», затвердженої наказом МОЗ України від 16.02.2009 № 95, та «Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань»,затвердженого наказом МОЗ України від 23.09.2009 р. № 690 (із змінами, внесеними згідно з Наказом Міністерства охорони здоров’я України № 523 від 12.07.2012).
Формат повідомлення може бути довільної форми: SIOMS, Med Watch чи інший формат за умови того, що вся необхідна інформація повинна бути надана у повідомленні про випадок СПЯ/СПР/ПНСПР. Вимоги до складання повідомлення про випадок ПНСПР наведені в додатку 1. [1]
2.2.6. Під час проведення КВ, в яких застосовується сліпий або замаскований метод, інформація про СПЯ/СПР/ПНСПР може надаватися відповідальним дослідником/ дослідником до комісії з питань етики як у «засліпленому», так і у «розліпленому» вигляді. Немає необхідності розсліплювати код лікування, якщо не було спеціального запиту чи у випадку коли розкриття коду було необхідно для усунення безпосередньої загрози життю чи здоров’ю пацієнта. Процедура розсліплення коду описана у протоколі КВ, або може бути надана спонсором окремим документом, який зберігається у файлі дослідника. Коли засліплена інформація стосовно випадку СПЯ/СПР/ПНСПР була розсліплена, дослідник повинен надавати її до комісії з питань етики.
2.3. ПОВІДОМЛЕННЯ ПРО ПНСПР ТА ЗВІТИ З БЕЗПЕЧНОСТІ ДЛЗ, ЯКІ СПОНСОР НАДАЄ ДО ЦЕНТРУ ТА ДО КОМІСІЇ З ПИТАНЬ ЕТИКИ
2.3.1. Надання повідомлень про випадки ПНСПР спонсором у Центр (звітний період) починається з дати затвердження ЦОВВ висновку Центру щодо проведення КВ та завершується із закінченням КВ в Україні (дата останнього візиту останнього досліджуваного).
2.3.2. Надання спонсором до комісії з питань етики повідомлень про випадки ПНСПР (звітний період) починається з дати початку КВ у відповідному місці проведення дослідження (підписання першим пацієнтом (здоровим добровольцем) інформованої згоди) та завершується із закінченням КВ у відповідному місці проведення дослідження (дата останнього візиту останнього досліджуваного).
2.3.3. Спонсор негайно реєструє і протягом 7 календарних днів з дати, коли це стало йому відомо, повідомляє Центр та комісію з питань етики про всі випадки ПНСПР, що стосуються ДЛЗ у даному КВ,які призвели до смерті або являли загрозу для життя досліджуваного. Додаткова інформація щодо цього(цих) випадку(ів) ПНСПР надається до Центру та комісії з питань етики протягом наступних 8 календарних днів.
Вимоги до складання повідомлення про випадок ПНСПР наведені в додатку 1. [1]
2.3.4. Не пізніше 15 календарних днів з дати, коли це стало йому відомо, спонсор повідомляє Центр та комісію з питань етики про всі інші випадки ПНСПР, які стосуються ДЛЗ, у даному КВ.
Важливо: У разі якщо кінцевий термін надання інформації про випадок ПНСПР припадає на вихідний або святковий день, інформація повинна бути надана у перший після нього робочий день
2.3.5. Інша інформація з безпечності ДЛЗ, яка стала відома спонсору (повідомлення про випадки ПНСПР, які трапилися в межах інших КВ, які проводить даний спонсор чи інший спонсор з цим самим ДЛЗ) з метою уникнення дублювання надання інформації про ПНСПР, може надаватися до Центру та до комісії з питань етики у інформаційних листах стосовно нової інформації з безпечності ДЛЗ чи/та у складі періодичних звітів з безпечності ДЛЗ за періоди, які обумовлені характером КВ та обсягом отриманих повідомлень про випадки ПНСПР. Ці переліки повинні супроводжуватися стислою інформацією щодо виявленого профілю безпеки ДЛЗ.
2.3.6. Під час проведення КВ, в яких застосовується сліпий або замаскований метод, інформація про ПНСПР може надаватися спонсором до Центру та до комісії з питань етики як у «засліпленому», так і у «розліпленому» вигляді. Немає необхідності розсліплювати код лікування, якщо не було спеціального запиту чи у випадку коли розкриття коду було необхідно для усунення безпосередньої загрози життю чи здоров’ю пацієнта. Коли засліплена інформація стосовно випадку ПНСПР була розсліплена, інформацію необхідно надавати до Центру та до комісії з питань етики.
Важливо: У випадку, коли до Центру та до комісії з питань етики спочатку надавалися випадки ПНСПР у «засліпленому» вигляді, коли достеменно не було відомо який ДЛЗ отримував досліджуваний (ЛЗ, який вивчається, препарат порівняння чи плацебо), а згодом рандомізаційний код було розкрито та визначено, який ДЛЗ отримував досліджуваний, існує такий алгоритм надання повідомлення про цей випадок:
Якщо визначається, що досліджуваний отримував ЛЗ, який вивчається, та СПР не є передбачуваною, то інформація повинна бути надана до Центру та комісії з питань етики, як про ПНСПР.
Якщо пацієнт приймав препарат порівняння, який є зареєстрованим ЛЗ, то СПР повинна бути повторно оцінена щодо критерію «непередбачуваності» з врахуванням інформації, яка зазначена у інструкції з медичного застосування/короткій характеристиці для зареєстрованого ЛЗ. Якщо реакція виявиться ПНСПР, то інформацію про цей випадок необхідно надати до Центру та комісії з питань етики. Якщо реакція оцінена як передбачувана СПР, то цю додаткову інформацію спонсор одноразово повинен надати до Центру та комісії з питань етики. У подальшому цей випадок передбачуваної СПР не потребує інформування до Центру та комісії з питань етики.
Якщо після розкриття рандомізаційного коду визначається, що досліджуваний приймав плацебо, то цю додаткову інформацію спонсор повинен одноразово надати до Центру та комісії з питань етики. ПЯ, пов’язані з плацебо зазвичай не відповідають критеріям ПНСПР. Однак, якщо явища, пов’язані з плацебо відповідають критеріям ПНСПР (наприклад реакція на допоміжну речовину або домішки), спонсор повинен надавати такі повідомлення до Центру та комісії з питань етики.
Важливо: При проведенні КВ, в яких досліджується лікування при захворюваннях з високою поширеністю чи високою смертністю, при яких кінцеві точки ефективності можуть бути також ПНСПР, або коли смертність чи інший «серйозний» наслідок, який потенційно можна репортувати як ПНСПР, є кінцевою точкою ефективності у КВ, цілісність якого може піддаватися ризику, якщо маскування систематично порушується. У таких випадках спонсор має визначити у протоколі КВ та надати до Центру та до комісії з питань етики інформаційний лист стосовно того, що серйозні побічні реакції можуть розглядатися як пов’язані з захворюванням, і не підлягають систематичному розсліпленню та терміновому поданню. Такі вищезазначені ПНСПР надаються у складі періодичних звітів з безпеки. [4]
2.3.7. Повідомлення про випадки ПНСПР надаються до Центру та до комісії з питань етики у паперовому або електронному вигляді. Надання спонсором до Центру повідомлень про випадок ПНСПР у паперовому вигляді здійснюється безпосередньо до Центру, у електронному вигляді — на електронну адресу Департаменту експертизи матеріалів доклінічних та клінічних випробувань.
2.3.8. Процедура надання спонсором до комісії з питань етики повідомлень про випадок ПНСПР (у паперовому або електронному вигляді) повинна бути чітко визначена у СОП комісії з питань етики.
2.3.9. Формат повідомлення може бути довільної форми: SIOMS, Med Watch чи інший формат за умови того, що вся необхідна інформація повинна бути надана у повідомленні про випадок ПНСПР.
Вимоги до складання повідомлення про випадок ПНСПР наведені в додатку 1. [1]
2.3.10. Повідомлення про випадок ПНСПР можуть надаватися українською або російською або англійською мовами. У супровідному листі до повідомлення про випадок ПНСПР має бути зазначена інформація про ДЛЗ, стосовно якого надається повідомлення про ПНСПР та про КВ, які проводить даний спонсор із використанням цього ДЛЗ в Україні, юридичну/фізичну особу, відповідальну за подання інформації про ПНСПР: найменування юридичної особи/П.І.Б. фізичної особи, місцезнаходження юридичної особи/місце проживання фізичної особи, займана посада, контактний номер телефону та факс, а також дата даного повідомлення.
2.3.11. При проведенні довгострокових КВ спонсор надає до Центру та до комісії з питань етики оновлюваний звіт з безпеки ДЛЗ, що перебувають у стадії розробки (DSUR- Development Safety Update Report) на паперовому або електронних носіях, не рідше одного разу на рік не пізніше 60 календарних днів з дня оформлення звіту згідно з вимогами, наведеними в додатку 2.
2.3.12. Надання спонсором до Центру та до комісії з питань етики DSUR починається з дати затвердження ЦОВВ висновку Центру щодо проведення КВ.
Завершується надання DSUR до Центру та до комісії з питань етики із закінченням КВ в Україні (дата останнього візиту останнього досліджуваного).
При обґрунтованій підозрі щодо підвищення ризику для досліджуваних Центр та комісія з питань етики може зобов’язати спонсора надавати звіт щодо безпеки лікарських засобів, що перебувають у стадії розробки, частіше, наприклад, 1 раз у півроку або частіше.
2.3.13. Надання спонсором до Центру DSUR здійснюється безпосередньо до Центру. Процедура надання спонсором до комісії з питань етики при ЛПЗ DSUR (у паперовому чи електронному вигляді, тощо) повинна бути чітко визначена у СОП комісії з питань етики при ЛПЗ.
Звіт може надаватися українською або російською або англійською мовами, але з обов’язковим наданням українською чи російською мовами стислого резюме (DSUR Executive Summary), в якому описано нову та важливу інформацію з безпечності ДЛЗ та балансу користь/ризик для досліджуваних.
У супровідному листі до DSUR має бути зазначено: інформація про ДЛЗ, стосовно якого надається звіт та КВ, які проводить даний спонсор із використанням цього ж ДЛЗ в Україні і яких стосується цей звіт, інформація стосовно юридичної/фізичної особи, відповідальної за подання звіту: найменування юридичної особи/П.І.Б. фізичної особи, місцезнаходження юридичної особи/місце проживання фізичної особи, займана посада, контактний номер телефону та факс, а також дата даного звіту.
2.3.14. Спонсор також повинен інформувати Центр та комісію з питань етики у вигляді інформаційних листів з безпечності ДЛЗ про ситуації, які впливають на баланс ризик/користь ДЛЗ та на безпеку досліджуваних. До таких ситуацій відносяться:[3]
- для «передбачуваних» СПР — клінічно достовірне підвищення частоти таких реакцій;
- при лікуванні хвороб, які загрожують життю досліджуваних — відсутність ефективності ДЛЗ, що становить високий ризик для досліджуваної популяції;
- СПР, які описані у Брошурі дослідника, як «передбачувані», але відрізняються від них за інтенсивністю чи ступенем тяжкості та, які, таким чином, треба розцінювати, як непередбачувані (наприклад, у брошурі дослідника гепатит зазначено як «передбачувана» ПР, але вперше отримане повідомлення про фульмінантний гепатит слід вважати «непередбачуваною» СПР);
- важлива інформація з безпеки (наприклад, канцерогенність), отримана з нещодавно завершених випробуваннях на тваринах.
Важливо: Комісії з питань етики зберігають документи, що стосуються проведення КВ, протягом не менше трьох років після його завершення, а потім передають в архів ЛПЗ. [5]:
2.4. ПОВІДОМЛЕННЯ ПРО ПНСПР, ЯКІ СПОНСОР НАДАЄ ДО ВІДПОВІДАЛЬНОГО ДОСЛІДНИКА/ДОСЛІДНИКА
2.4.1. Надання спонсором до відповідальних дослідників/дослідників повідомлень про випадки ПНСПР (звітний період) починається з дати початку КВ у відповідному місці проведення дослідження (підписання першим пацієнтом (здоровим добровольцем) інформованої згоди) та завершується із закінченням КВ у відповідному місці проведення дослідження (дата останнього візиту останнього досліджуваного).
2.4.2. Спонсор негайно реєструє і протягом 7 календарних днів з дати, коли це стало йому відомо, повідомляє відповідальному досліднику/ досліднику про всі випадки ПНСПР, що стосуються досліджуваного лікарського засобу у даному КВ, які призвели до смерті або являли загрозу для життя досліджуваного. Додаткова інформація щодо цього випадку ПНСПР надається досліднику протягом наступних 8 календарних днів. Вимоги до складання повідомлення про випадок ПНСПР наведені в додатку 1. [1, 2]
2.4.3. Не пізніше 15 календарних днів з дати, коли це стало йому відомо, спонсор повідомляє відповідальному досліднику/досліднику про всі інші випадки ПНСПР, які стосуються ДЛЗ, у даному КВ.
2.4.4. Інша інформація з безпечності ДЛЗ, яка стала відома спонсору (повідомлення про випадки ПНСПР, які трапилися в межах інших КВ, які проводить даний спонсор чи інший спонсор з цим самим ДЛЗ) з метою уникнення дублювання надання інформації про випадки ПНСПР може надаватися до відповідального дослідника/дослідника у переліках ПНСПР та/чи у інформаційних листах стосовно нової інформації з безпечності ДЛЗ за періоди, які обумовлені характером КВ та обсягом отриманих повідомлень про випадки ПНСПР. Ці переліки повинні супроводжуватися стислою інформацією щодо виявленого профілю безпеки ДЛЗ. [4]
Важливо: Зазвичай, дослідники отримують від спонсора КВ засліплену інформацію про випадки ПНСПР до тих пір, поки надання розліпленої інформації не стане необхідним з причин безпеки. [4]
Важливо: Оцінка причинно-наслідкового зв’язку, що була надана дослідником не повинна занижуватися спонсором. Якщо спонсор не згоден з оцінкою причинно-наслідкового зв’язку дослідника, у повідомленні про випадок ПНСПР потрібно надавати думку обох — дослідника та спонсора. [4]
Оцінку «передбачуваності» зазвичай надає спонсор. «Передбачуваність» СПР оцінюється для зареєстрованого ЛЗ з RSI (референтна інформація з безпечності, яка міститься у ‘SmPC’ (коротка характеристика продукту)), для незареєстрованого ЛЗ — з брошури дослідника. Якщо інформацію щодо «передбачуваності» надав дослідник, вона повинна бути взята до уваги спонсором. [4]
2.5. РЕЄСТРАЦІЯ ТА АНАЛІЗ ПОВІДОМЛЕНЬ ПРО ПНСПР ТА ЗВІТІВ З БЕЗПЕЧНОСТІ ДЛЗ ЦЕНТРОМ
2.5.1. Центр реєструє та моніторує всі випадки ПНСПР, що стали йому відомі, та проводить їх аналіз з метою оцінки співвідношення ризику/користі застосування ДЛЗ.
2.5.2. При підозрі щодо підвищення ризику для досліджуваних Центр може запитати у спонсора додаткову інформацію щодо безпеки підозрюваного ЛЗ, яка має бути надана протягом 7 календарних днів з дня отримання запиту.
Якщо спонсор протягом цього строку не надає такої інформації або листа з обґрунтуванням строків, необхідних для її підготовки, Центр може прийняти рішення про тимчасове або повне зупинення даного КВ, про що письмово повідомляє спонсора та дослідників.
Важливо: Центр зберігає документи, що стосуються проведення КВ, протягом не менше 15 років після його завершення.
Додаток 1 *
ВИМОГИ ДО СКЛАДАННЯ ПОВІДОМЛЕННЯ ПРО ПІДОЗРЮВАНУ НЕПЕРЕДБАЧУВАНУ СЕРЙОЗНУ ПОБІЧНУ РЕАКЦІЮ
1. Ідентифікація клінічного випробування
Ідентифікація клінічного випробування (кодований номер протоколу клінічного випробування, привласненого спонсором, за наявності — номер EudraCT1). **
2. Інформація про досліджуваного
2.1. Ідентифікаційний номер досліджуваного.
2.2. Ініціали кодовані.
2.3. Стать.
2.4. Вік та/або дата народження.
2.5. Вага.
2.6. Зріст.
3. Інформація про підозрюваний лікарський засіб
3.1. Назва досліджуваного лікарського засобу (або торговельна назва).
3.2. Міжнародна непатентована назва.
3.3. Номер серії.
3.4. Показання для призначення або вивчення.
3.5. Лікарська форма, дозування.
3.6. Добова доза та режим призначення.
3.7. Спосіб призначення.
3.8. Дата та час початку лікування.
3.9. Дата та час припинення лікування або тривалість лікування.
3.10. Розкодування: так / ні / не застосовувалось, результати:
оцінка причинно-наслідкового зв’язку, що надана дослідником; ***
оцінка причинно-наслідкового зв’язку, що надана спонсором; **
коментарі фахівців, якщо необхідно (наприклад, якщо оцінка спонсора щодо зв’язку з підозрюваною непередбачуваною серйозною побічною реакцією не збігається з оцінкою дослідника, підозра, що супутні лікарські засоби відіграють роль у розвитку реакції безпосередньо або внаслідок взаємодії).
____________
1 EudraCT (European Union Drug Regulating Authorities Clinical Trials) — Європейська база даних клінічних випробувань.
4. Супутнє лікування
Для супутніх лікарських засобів (враховуючи безрецептурні лікарські засоби) та немедикаментозних засобів лікування надається та сама інформація, що і для досліджуваного лікарського засобу, враховуючи виробника, якщо відомо.
5. Інформація про підозрювану непередбачувану серйозну побічну реакцію
5.1. Повний опис реакції.
5.2. Дата та час початку реакції.
5.3. Дата та час припинення або тривалість реакції.
5.4. Інформація про відміну та повторне призначення підозрюваного лікарського засобу.
5.5. Місце розвитку реакції (клініка, поліклініка, вдома).
5.6. Наслідок: інформація про видужання або будь-які наслідки, будь-які проведені специфічні тести та/або лікування та їх результати.
У разі смерті — її причина та коментарі щодо можливого причинно-наслідкового зв’язку з підозрюваним досліджуваним лікарським засобом.
5.7. Будь-яка інша інформація, що може бути корисна для оцінки підозрюваної непередбачуваної серйозної побічної реакції (супутні захворювання, алергологічний анамнез, алкогольна залежність).
6. Дані про дослідника, що надав первинну інформацію ***
6.1. П. І. Б.
6.2. Місце проведення дослідження.
6.3. Контактний номер телефону.
6.4. Займана посада.
7. Інформація про спонсора/заявника та адміністративні дані **
7.1. Дата даного повідомлення.
7.2. Джерело інформації.
7.3. Дата отримання повідомлення спонсором/заявником.
7.4. Країна, де виникла реакція.
7.5. Тип повідомлення (первинне, додаткове).
7.6. Найменування юридичної особи / П. І. Б. фізичної особи; місцезнаходження юридичної особи / місце проживання фізичної особи.
7.7. П. І. Б., займана посада, контактний номер телефону та факс контактної особи, відповідальної за подання інформації про побічні реакції.
7.8. Номер випадку непередбачуваної серйозної побічної реакції, наданий спонсором/заявником (номер має бути єдиним для первинного та наступних повідомлень про один і той самий випадок).
* розроблений у відповідності до додатку 14 Порядку
**заповнює спонсор КВ
***заповнює відповідальний дослідник/дослідник КВ
Додаток 2 *
ВИМОГИ ДО СТРУКТУРИ ОНОВЛЮВАНОГО ЗВІТУ З БЕЗПЕКИ ДОСЛІДЖУВАНОГО ЛІКАРСЬКОГО ЗАСОБУ, ЩО ПЕРЕБУВАЄ У СТАДІЇ РОЗРОБКИ (ДАЛІ — DSUR)
(DSUR — Development Safety Update Report)
Зміст DSUR складається з 20 розділів [5]:
1. Вступ.
2. Міжнародний ліцензійний/реєстраційний статус.
3. Заходи, прийняті з причин безпеки в звітний період.
4. Зміни у референтній інформації з безпеки.
5. Перелік клінічних випробувань, які проводяться чи завершені у звітний період.
6. Оцінка кумулятивної експозиції (загального впливу):
6.1. Кумулятивна експозиція у програмі розробки.
6.2. Експозиція пацієнта (вплив на пацієнта) на основі маркетингового досвіду.
7. Дані в переліках та зведених таблицях:
7.1. Референтна інформація.
7.2. Переліки серйозних побічних реакцій за звітний період.
7.3. Кумулятивні/загальні зведені таблиці серйозних побічних явищ.
8. Важливі результати клінічних випробувань за звітний період:
8.1. Завершені клінічні випробування.
8.2. Клінічні випробування, які проводяться.
8.3. Довгостроковий контроль (спостереження).
8.4. Інше терапевтичне використання досліджуваного лікарського засобу.
8.5. Нові дані з безпеки, пов’язані з комбінованими методами лікування.
9. Дані з безпеки, отримані під час неінтервенційних випробувань.
10. Інша інформація з безпеки у контексті клінічних випробувань.
11. Дані з безпеки на основі маркетингового досвіду.
12. Неклінічні дані.
13. Література.
14. Інші DSURs.
15. Відсутність ефективності.
16. Інформація, специфічна для регіону.
17. Інформація, яка надійшла пізніше.
18. Сумарна оцінка безпеки:
18.1. Оцінка ризиків.
18.2. Питання співвідношення користі-ризику.
19. Резюме важливих ризиків.
20. Висновки.
* розроблений у відповідності до додатку 15 Порядку
Додаток 3
Література
1. Порядок проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань»,затверджений наказом МОЗ України від 23.09.2009 р. № 690 (із змінами, внесеними згідно з Наказом Міністерства охорони здоров’я України № 523 від 12.07.2012).
2. Настанова Лікарські засоби. Належна клінічна практика СТ-Н МОЗ 42-7.0:2008», затверджена наказом МОЗ України від 16.02.2009 № 95.
3. Модуль ICH: E2A Оцінка клінічних даних з безпеки: визначення та стандарти для експрес-звітності (Clinical Safety Data Management: Definitions and Standards for Expedited Reporting), червень 1995р.
4. Детальне керівництво зі збору, перевірки та надання повідомлень про ПР в процесі КВ медичних продуктів для вживання людиною (Detailed guidance on the collection, verification and presentation of adverse reaction reports arising from clinical trials on medicinal products for human use, (СТ-3), 2011/C 172/01), 2011р.
5. Модуль ICH: E2F «Оновлюваний звіт з безпеки ліків, що знаходяться в стадії розробки» (DSUR-Development Safety Update Report, EMA/CHMP/ICH/ 309348/2008), серпень 2011р.
6. Клінічні випробування ліків/За ред.. В.І.Мальцева, Т.К.Єфімцевой, Ю.Б.Бєлоусова, В.М.Коваленка.-2-е вид., перероб. та доп. — К.:МОРІОН, 2006.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим