МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
НАКАЗ
від 02.04.2020 р. № 762
Про затвердження протоколу «Надання медичної допомоги для лікування коронавірусної хвороби (COVID-19)»
Відповідно до статті 141 Основ законодавства України про охорону здоров’я, Закону України від 30 березня 2020 року № 539-ІХ «Про внесення змін до деяких законів України щодо забезпечення лікування коронавірусної хвороби (COVID-19)», відповідно до пункту 8 Положення про Міністерство охорони здоров’я України, затвердженого постановою Кабінету Міністрів України від 25 березня 2015 року № 267 (у редакції постанови Кабінету Міністрів України від 24 січня 2020 року № 90), на підставі протоколу засідання робочої групи з розробки протоколів надання медичної допомоги хворим на коронавірусну хворобу (COVID-19) від 01 квітня 2020 року № 1
НАКАЗУЮ:
1. Затвердити протокол «Надання медичної допомоги для лікування коронавірусної хвороби (COVID-19)», що додається.
2. Державному підприємству «Державний експертний центр Міністерства охорони здоров’я України» (Думенко Т.) забезпечити внесення документа, затвердженого пунктом 1 цього наказу, до реєстру медико-технологічних документів.
3. Міністерству охорони здоров’я Автономної Республіки Крим, керівникам структурних підрозділів з питань охорони здоров’я обласних, Київської та Севастопольської міських державних адміністрацій забезпечити виконання цього наказу.
Контроль за виконанням цього наказу залишаю за собою.
МіністрМаксим Степанов
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
ПРОТОКОЛ
«НАДАННЯ МЕДИЧНОЇ ДОПОМОГИ ДЛЯ ЛІКУВАННЯ КОРОНАВІРУСНОЇ ХВОРОБИ (COVID-19)»
Вступ
Протокол розроблено відповідно до Закону України від 30 березня 2020 року № 539-ІХ «Про внесення змін до деяких законів України щодо забезпечення лікування коронавірусної хвороби (COVID-19)»
Протокол розроблено відповідно до Закону України від 30 березня 2020 року № 539-IX «Про внесення змін до деяких законів України щодо забезпечення лікування коронавірусної хвороби (COVID-19)» (зі змінами, внесеними Законом України від 19 червня 2020 року № 737-IX «Про внесення зміни до розділу II «Прикінцеві положення» Закону України «Про внесення змін до деяких законів України щодо забезпечення лікування коронавірусної хвороби (COVID-19)» щодо продовження строку дії у зв’язку із загрозою зростання захворюваності населення на коронавірусну хворобу (COVID-19)»), а також відповідно до наказу Міністерства охорони здоровʼя України від 30 червня 2020 року № 1482 «Про затвердження Порядку призначення та застосування лікарських засобів для лікування коронавірусної хвороби (COVID-19)», зареєстрованого в Міністерстві юстиції України 08 липня 2020 року за № 641/34924.
І. Паспортна частина
1. Діагноз. Коронавірусна хвороба (COVID-19).
2. Коди стану або захворювання (МКХ-10 та інших класифікацій) шифр за МКХ-10: U07.1 2019-nCoV гостра респіраторна хвороба [тимчасова назва].
U07.1 – COVID-19 підтверджений лабораторним тестуванням незалежно від тяжкості клінічних ознак або симптомів (вірус ідентифікований);
U07.2 – COVID-19 діагностовано клінічно або епідеміологічно, але лабораторне тестування непереконливе чи недоступне (вірус не ідентифікований).
3. Протокол, призначений для всіх медичних працівників, які надають медичну допомогу пацієнтам з коронавірусною хворобою (COVID-19).
4. Мета протоколу: реалізація порядку призначення та застосування лікарських засобів для лікування груп пацієнтів із підтвердженоюпідтвердженою коронавірусною хворобою (COVID-19). при середньотяжкому, тяжкому, критичному перебігу.
5. Дата складання протоколу: 01.04.2020 р.
6. Дата оновлення протоколу: 13.09.2021 р.1205.04.2021 р.30.12.10.19.11.16.09.14.07.09.04.2020 р.
76. Дата перегляду протоколу: за потреби.
87. Список осіб, які брали участь в розробці протоколу.
|
Микичак Ірина Комаріда Олександр Олегович Садов’як Ірина Дмитрівна
|
ЗаступникПерший заступник Міністра охорони здоров’я, голова робочої групи;
перший заступник Міністра охорони здоров’я=;, голова робочої групи; |
|
Комаріда Олександр Микичак Ірина Володимирівна |
генеральний директор Фармацевтичного директорату, заступник голови робочої групи; заступник Міністра охорони здоров’я, заступник голови робочої групи; |
|
Ліщишина Олена Гаврилюк Андрій Олександрович |
начальник відділу стандартизації медичної допомоги департаменту оцінки медичних технологій Державного підприємства «Державний експертний центр МОЗ України», секретар робочої групи; директор Департаменту реалізації політик; Генеральний директор Директорату якості життя; |
| Ганжа Ірина Миколаївна | в. о. Генерального директоракерівник експертної групи з питань розвитку служби крові та біобезпеки Директорату громадського здоров’я;
керівник експертної групи з питань розвитку служби крові, біобезпеки та оперативного реагування на події, що мають міжнародне значення Директорату громадського здоров’я та профілактики захворюваності; |
|
Гаврилюк Андрій Комаріда Олександр Олегович |
директор Департаменту реалізації політик; Генеральний директор Фармацевтичного директорату; Генеральний директор Директорату фармацевтичного забезпечення; |
| Лясковський Тарас Михайлович |
начальник відділу фармацевтичної діяльності Департаменту реалізації політик; керівник експертної групи з питань реєстрації лікарських засобів та дезінфікуючих засобів Директорату фармацевтичного забезпечення; |
| Ідоятова Євгенія Жумагаліївна |
в.о. генерального директора Директорату медичного забезпечення; |
| Радкевич Ганна Сергіївна |
державний експерт експертної групи з питань якості та доступності лікарських засобів Директорату фармацевтичного забезпечення; |
|
Орабіна Тетяна Миколаївна |
в.о. Генерального директора Директорату медичних кадрів, освіти і науки; |
|
Острополець Наталія Андріївна Руденко Ірина Сергіївна |
заступник директора Департаменту реалізації політик, начальник відділу з питань надання медичної допомоги населенню; заступник директора Департаменту – начальник відділу з питань надання медичних послуг населенню; генеральний директор Директорату громадського здоров’я та профілактики захворюваності; |
| Слонецький Ігор Іванович |
начальник Управління ліцензування та контролю якості надання медичної допомоги; директор Департаменту контролю якості надання медичної допомоги; |
| Орабіна Тетяна Миколаївна |
керівник експертної групи з питань надання первинної медичної допомоги Директорату медичних послуг; |
|
Радкевич Ганна Сергіївна |
державний експерт експертної групи з питань допуску на ринок лікарських засобів Фармацевтичного директорату; державний експерт експертної групи з питань якості та доступності лікарських засобів Директорату фармацевтичного забезпечення; |
|
Георгіянц Маріне Акопівна Дубров Сергій Олександрович |
професор кафедри анестезіології, дитячої анестезіології та інтенсивної терапії, проректор з наукової роботи Харківської медичної академії післядипломної освіти; професор кафедри анестезіології та інтенсивної терапії Національного медичного університету іменіім. О.О. Богомольця; |
| Голубовська Ольга Анатоліївна | завідувач кафедри інфекційних хвороб Національного медичного університету іменіім. О.О. Богомольця; |
| Дубров Сергій Олександрович | професор кафедри анестезіології та інтенсивної терапії Національного медичного університету імені О. О. Богомольця; |
|
Дудар Ірина Олексіївна |
завідувач відділу еферентних технологій ДУ «Інститут нефрології НАМН України» (за згодою); |
| Жовнір Володимир Аполінарійович |
головний лікар ДУ «Науково-практичний центр дитячої кардіохірургії МОЗ України»; |
| Камінський В’ячеслав Володимирович | завідувач кафедри акушерства, гінекології та репродуктології Національної медичної академії післядипломної освіти імені П.Л. Шупика; |
| Колесник Роман Олександрович | завідувач відділу антимікробної резистентності та інфекційного контролю державної установи «Центр громадського здоров’я Міністерства охорони здоров’я України»; |
| Крамарев Сергій Олександрович | завідувач кафедри дитячих інфекційних хвороб Національного медичного університету іменіім. О.О. Богомольця; |
|
Ліщишина Олена Михайлівна |
завідувачпровідний науковий співробітник наукового відділу організації медичної допомоги Державної наукової установи «Науково-практичний центр профілактичної і клінічної медицини» Державного управління справами (за згодою); |
|
Ткаченко Руслан Матюха Лариса Федорівна |
професор кафедри акушерства, гінекології та репродуктології, завідувач циклу з акушерської реанімації Національної медичної академії післядипломної освіти імені П.Л. Шупика; завідувач кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П. Л. Шупика; |
| Мацьков Олександр Григорович |
завідувач відділу антибіотикорезистентності та інфекційного контролю Державної установи «Центр громадського здоров’я МОЗ України»; |
|
Мороз Лариса Василівна |
завідувач кафедри інфекційних хвороб Вінницького національного медичного університету ім. М. І. Пирогова; |
| Нетяженко Василь Захарович
|
завідувач кафедри пропедевтики внутрішньої медицини № 1 Національного медичного університету імені О.О. Богомольця |
|
Пархоменко Олександр Миколайович |
завідувач відділу реанімації та інтенсивної терапії ДУ «Національний науковий центр «Інститут кардіології імені академіка М. Д. Стражеска» НАМН України» (за згодою); |
| Піняжко Ореста Богданівна | директор Ддепартаменту з оцінки медичних технологій Державного підприємства«Державний експертний центр МОЗ України»; |
|
Жовнір Володимир Пришляк Олександра Ярославівна |
головний лікар ДУ «Науково- практичний центр дитячої кардіохірургії МОЗ України». завідувач кафедри інфекційних хвороб та епідеміології Івано-Франківський національний медичний університет; завідувач кафедри інфекційних хвороб та епідеміології Івано-Франківського національного медичного університету; |
|
Дудар Ірина Тарабрін Олег Олександрович |
завідувач відділу еферентних технологій ДУ «Інститут нефрології НАМН України»; завідувач кафедри анестезіології, інтенсивної терапії та медицини невідкладних станів Одеського національного медичного університету; |
|
Ткаченко Руслан Опанасович |
професор кафедри акушерства, гінекології та репродуктології, завідувач циклу з акушерської реанімації Національної медичної академії післядипломної освіти імені П. Л. Шупика; |
| Товкай Олександр Андрійович | директор Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України;; |
|
Чабан Тетяна Володимирівна |
завідувач кафедри інфекційних хвороб Одеського національного медичного університету; |
|
Чоп’як Валентина Володимирівна |
завідувач кафедри клінічної імунології та алергології Львівського національного медичного університету імені Данила Галицького; |
|
Шостакович-Корецька Людмила Романівна |
завідувач кафедри інфекційних хвороб ДЗ «Дніпропетровська медична академія МОЗ України»; професор кафедри інфекційних хвороб ДЗ «Дніпропетровська медична академія МОЗ України»; |
|
Юрко Катерина Володимирівна |
завідувач кафедри інфекційних хвороб Харківського національного медичного університету; |
| Ященко Юрій Борисович |
в.о. заступника директора з наукової роботи Державної наукової установи «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами; завідувач кафедри неонатології Національної медичної академії післядипломної освіти імені П. Л. Шупика; в.о. заступника директора з наукової роботи Державної наукової установи «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами |
|
Пархоменко Олександр Машейко Альона Миколаївна Гуленко Оксана Іванівна |
завідувач відділу реанімації та інтенсивної терапії ДУ «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України». начальник відділу оцінки економічної ефективності лікарських засобів департаменту оцінки медичних технологій Державного підприємства «Державний експертний центр МОЗ України», секретар робочої групи. начальник відділу стандартизації медичної допомоги департаменту оцінки медичних технологій, адміністрування державних реєстрів та моніторингу цін Державного підприємства «Державний експертний центр МОЗ України», секретар робочої групи. |
98. Коротка епідеміологічна інформація. Поширеність коронавірусної хвороби (COVID-19) в Україні в березні — вереснілипніквітні 2020 року характеризується стрімким зростанням. За прогнозними оцінками госпіталізації потребуватиме до 15% пацієнтів, в тому числі тяжкий і критичний перебіг очікується до 5% випадків.
ІІ. Загальна частина
Протокол «Надання медичної допомоги для лікування коронавірусної хвороби (COVID-19)» (далі – Протокол) розроблено відповідно до Закону України від 30 березня 2020 року № 539-IX «Про внесення змін до деяких законів України щодо забезпечення лікування коронавірусної хвороби (COVID-19)» (зі змінами, внесеними Законом України від 04 грудня 2020 року № 1075-IX «Про внесення змін до деяких законів України щодо забезпечення профілактики коронавірусної хвороби (COVID-19)»)(зі змінами, внесеними Законом України від 19 червня 2020 року № 737-IX «Про внесення зміни до розділу II «Прикінцеві положення» Закону України «Про внесення змін до деяких законів України щодо забезпечення лікування коронавірусної хвороби (COVID-19)» щодо продовження строку дії у зв’язку із загрозою зростання захворюваності населення на коронавірусну хворобу (COVID-19)») та Порядку призначення та застосування лікарських засобів для лікування коронавірусної хвороби (COVID-19), затвердженого наказом Міністерства охорони здоровʼя України від 30 червня 2020 року № 1482, зареєстрованого в Міністерстві юстиції України 08 липня 2020 року за № 641/34924 (далі – Порядок).
Цей Ппротокол є частиною нормативно-правових актів, затверджених МОЗ, розроблених України з метою забезпечення протистояння коронавірусній хворобі (COVID-19). Організаційні заходи, більшість клінічних аспектів, зокрема визначеннявиявлення випадку, госпіталізації за клінічними критеріями, групи ризику розвитку ускладнень захворювання, надання неспецифічного лікування тощо врегульовані стандартами медичної та фармацевтичної допомоги, затверджениминаказом МОЗ () України від 28 березня 2020 року № 722 «Організація надання медичної допомоги хворим на коронавірусну хворобу (COVID-19)», та впроваджуються в закладах охорони здоров’я шляхом розробки клінічних маршрутів пацієнтів. та локальних протоколів.
Протокол оновлюється відповідно до накопичення нових даних. ДотеперНа момент оновленнязатвердження протоколу продовжуються клінічні дослідження медичних технологій для=специфічного противірусноговідсутнє специфічне противірусне лікування коронавірусної хвороби (COVID-19), і на момент актуалізації Протоколу в березні 2021 рокулистопаді 2020 року в світі проводиться понад 280024002000500350 клінічних випробувань.досліджень. різних лікарських засобів. Клінічний протокол містить інформацію щодо лікарських засобів, які зареєстровані з іншими показаннями або не зареєстровані в Україні, але застосовуються для лікування окремих груп пацієнтів з коронавірусною хворобою (COVID-19) в в таких країнах, визначених Законом України від 30 березня 2020 року № 539-IX «Про внесення змін до деяких законів України щодо забезпечення лікування коронавірусної хвороби (COVID-19)». (із змінами затвердженими Законом України 737-IX від 19 червня 2020 року).
Згідно з Порядком Протокол застосовується після отримання інформованої згоди пацієнта (його законного представника) на медичну допомогу згідно із протоколом «Надання медичної допомоги для лікування коронавірусної хвороби (COVID-19)», наведеною у додатку 1 до зазначеного Порядку.
Згідно з Порядком, з метою забезпечення моніторингу результатів надання медичної допомоги пацієнтам з коронавірусною хворобою (COVID-19) заповнюється та направляється у встановленому порядку Індивідуальна реєстраційна картка пацієнта, який отримував медичну допомогу згідно з Протоколом «Надання медичної допомоги для лікування коронавірусної хвороби (COVID-19)» за формою, наведеною в додатку 2 до Порядку. Крім того, відсутність ефективності або побічні реакції застосованих лікарських засобів підлягають інформуванню за формою № 137/о «Карта-повідомлення про побічну реакцію лікарського засобу, вакцини, туберкуліну, та/або відсутність ефективності лікарського засобу, та/або несприятливу подію після імунізації/туберкулінодіагностики (НППІ)», затвердженою наказом Міністерства охорони здоров’я України від 27 грудня 2006 року № 898 «Про затвердження Порядку здійснення фармаконагляду», зареєстрованим Міністерством юстиції України 29 січня 2007 року за № 73/13340.
Відповідно до накопичених даних в Протоколі наведено окремо для пацієнтів дитячого та дорослого віку інформацію стосовно призначення противірусної/імуномодулюючої та підтримуючої терапії у дорослих та пацієнтів дитячого віку (пункт 1 частини ІІІ), антикоагулянтної терапії (пункт 2), ранньої підтримуючої терапії за наявності тяжкої гострої респіраторної інфекції (пункт 3), антибактеріальноїпротимікробної терапії бактеріальної ко-інфекції у пацієнтів з COVID-19 (пункт 4), гострого респіраторного дистрес-синдрому і гіпоксемічної дихальної недостатності (пункт 5), сепсису та септичного шоку (пункт 6), використання реконвалесцентної плазми, яка містить нейтралізуючі антитіла класу IgG проти SARS-CoV-2 у високих титрах (пункт 7), мультисистемного запального синдрому при COVID-19 у дітей та підлітків (пункт 8).
ІІІ. Основна частина
1. Противірусна/імуномодулююча та підтримуюча терапія у дорослих та госпіталізованих пацієнтів дитячого віку із підозрою або підтвердженим COVID-19
При госпіталізації обстеження здійснюються для оцінки клінічного стану пацієнта та визначення можливості застосування зазначених в протоколіув Ппротоколі лікарських засобів з огляду на наявність протипоказань та взаємодію лікарських засобів.
Перелік обстежень при госпіталізації:
ЕКГ; з метою виключення подовження інтервалу QT;Q–T;
загальний клінічний аналіз крові з підрахунком форменних елементів, гематокриту;;
загальний клінічний аналіз сечі;
біохімічний аналіз крові; визначення рівня глюкози крові.
ВУ процесі лікування лікарськими засобами гідроксихлорохін, хлорохін, лопінавір/ритонавір повторно оцінюється інтервал QTQ–T пацієнта, з метою контролю виникнення протипоказань.
Призначення лікарських засобів здійснюється з урахуванням індивідуального перебігу захворювання, супутньої патології та наявності протипоказань (таблиці 1, 2–3) та за умови отримання інформованої згоди пацієнта, що додається.
У випадку виникнення несприятливих наслідків застосування лікарських засобів незалежно від статусу реєстрації в Україні, а саме побічної реакції та/або відсутності ефективності лікарського засобу, повідомте про це, заповнивши Карту-повідомлення про побічну реакцію лікарського засобу, вакцини, туберкуліну, та/або відсутність ефективності лікарського засобу, та/або несприятливу подію після імунізації’/туберкулінодіагностики (НППІ) (Форма № 137/о), затверджену наказом Міністерства охорони здоров’я України від 27 грудня 2006 року № 898 «Про затвердження Порядку здійснення фармаконагляду», зареєстрованимзареєстрованого Міністерством юстиції України 29 січня 2007 року за № 73/13340, та направивши її у встановленому Міністерством охорони здоров’я України Порядку здійснення фармаконагляду.
Таблиця 1. Лікування дорослих пацієнтів дорослого віку
| Ступінь тяжкості | ЛікуванняПідтримуюча терапіяЛікувальні заходи | Додаткова терапіяПротипоказання |
|---|---|---|
| COVID-19: легкий ступінь тяжкості (відсутність утруднень дихання)
|
Амбулаторне лікування: 1) надати пацієнту інформацію щодо повноцінного харчування та відповідної регідратації; 2) симптоматичне лікування із застосуванням жарознижуючих засобів (парацетамол, ібупрофен тощо) при лихоманці та болю. Застереження: парацетамол приймати не більше 1 г на прийом і не більше 3 г на добу. Уникати використання високих доз ібупрофену (≥2400 мг на добу) в пацієнтів із неконтрольованою артеріальною гіпертензією, застійною серцевою недостатністю (II–III функціональний клас за критеріями NYHA), діагностованою ішемічною хворобою серця, захворюванням периферичних артерій та/або цереброваскулярними захворюваннями, хронічною хворобою нирок III-V стадій. При застосуванні ібупрофену в низьких дозах (до 1200 мг на добу) не спостерігається збільшення ризику серцево-судинних тромботичних подій. |
|
|
Підтверджений COVID-19 від легкого до помірного перебігу (відсутність утруднень дихання) COVID-19: легкий ступінь тяжкості (відсутність утруднень дихання)
|
Амбулаторне лікування:
1) повноцінне надати пацієнту інформацію щодо повноцінного харчування та відповідна регідратація відповідної регідратації 2) сСимптоматичне лікування із застосуванням жарознижуючих засобів (парацетамол, ібупрофен тощо) при лихоманці та болю., адекватне харчування та відповідна регідратація. Застереження: парацетамол приймати не більше 1 г на прийом і не більше 3 г на добу. Уникати використання високих доз ібупрофену (≥2400 мг на добу) ву пацієнтів із неконтрольованою артеріальною гіпертензією, застійною серцевою недостатністю (II–III функціональний клас за критеріями NYHA), діагностованою ішемічною хворобою серця, захворюванням периферичних артерій та/або цереброваскулярними захворюваннями, хронічною хворобою нирок III-V стадій.. При застосуванні ібупрофену в низьких дозах (до 1200 мг на добу) не спостерігається збільшення ризику серцево-судинних тромботичних подій. |
Не потрібна |
| Підтверджений COVID-19:
середній ступінь тяжкості Підтверджений COVID-19: захворювання середнього ступеню тяжкості, пацієнт належить до групи ризику тяжкого і критичного перебігу Пацієнт належить до груп ризику (вік> 65 років та/або супутні дисфункції органів (легені, серце, печінка тощо), діабет, коронаропатія, хронічна обструктивна хвороба легень, артеріальна гіпертензія) |
Амбулаторне лікування: 1) повноцінне надати пацієнту інформацію щодо повноцінного харчування та відповідна регідратація відповідної регідратації; 2) сСимптоматичне лікування із застосуванням жарознижуючих засобів (парацетамол, ібупрофен тощо) при лихоманці та болю., адекватне харчування та відповідна регідратація. Застереження: парацетамол приймати не більше 1 г на прийом і не більше 3 г на добу. Уникати використання високих доз ібупрофену (≥2400 мг на добу) у пацієнтів із неконтрольованою артеріальною гіпертензією, застійною серцевою недостатністю (II–III функціональний клас за критеріями NYHA), діагностованою ішемічною хворобою серця, захворюванням периферичних артерій та/або цереброваскулярними захворюваннями, хронічною хворобою нирок III-V стадій. При застосуванні ібупрофену в низьких дозах (до 1200 мг на добу) не спостерігається збільшення ризику серцево-судинних тромботичних подій;. 3) не використовуйте кортикостероїди для лікування COVID-19 у пацієнтів, які не потребують кисневої підтримки; 4) антибактеріальніпротимікробні засоби протипоказані та призначаються виключно за наявності лабораторно підтвердженої супутньої бактеріальної інфекції або при обґрунтованій підозрі на неї; 5) при утрудненні дихання рекомендовано перебувати в положенні «лежачи на животі», оскільки це допомагає розкрити альвеоли, що спалися, та підвищити рівень кисню в крові; Стаціонарне лікування: Призначення низькомолекулярних гепаринів (НМГ), якщо це не протипоказано (детальніше – див. пункт 2 частини ІІІ). Варіанти додаткової терапії (за клінічними показаннями): 1 –2) розгляньте ремдесивір для пацієнтів, що належать до груп ризику прогресування до тяжкого або критичного перебігу захворювання та мають ознаки пневмонії. Ризик прогресування до тяжкого або критичного перебігу захворювання мають пацієнти, що належать до групи ризику: вік >65 років та наявність тяжких супутніх патологій в стадії декомпенсації – декомпенсований цукровий діабет, тяжка хронічна патологія дихальної та серцево-судинної систем, імуносупресивні стани, ниркова недостатність. Ремдесивір найкраще призначати ув перші 5 днів від появи перших симптомів захворювання, але можливо ув будь-якійякий термін за наявності клінічних показань. У перший день – навантажувальна доза 200 мг один раз на добу (в/в протягом 30-120 хв), з другого дня – підтримуюча доза 100 мг один раз на добу (в/в протягом 30-120 хв). Тривалість лікування 5 днів. Застереження: Ррекомендовано ретельний моніторинг токсичності ремдесивіру або зменшеної ефективності супутнього препарату. Перед початком та щодня протягом застосування ремдесивіру ув дорослих пацієнтів рекомендовано визначати розрахункову швидкість клубочкової фільтрації (eGFR). Ремдесивір не слід застосовувати пацієнтам із розрахунковою швидкістю клубочкової фільтрації (eGFR) <30 мл/хв/1,73м2. Перед початком та щодня протягом застосування ремдесивіру у дорослих пацієнтів рекомендовано визначати розрахункову швидкість клубочкової фільтрації (eGFR). До початку прийому ремдесивіру кожному пацієнту необхідно провести дослідження функціонального стану печінки та відстежувати його протягом вусього періоду лікування. Ремдесивір слід застосовувати пацієнтам із порушеннями функцій печінки лише в тих випадках, коли потенційна користь перевищує потенційний ризик. Ремдесивір не слід застосовувати пацієнтам, у яких рівень аланінамінотрансферази (АЛТ) у крові більше, ніж у 5 разів перевищує верхню межу норми. Слід припинити застосування ремдесивіруремдисивіру пацієнтами, у яких: АЛТ більше, ніж у 5 разів перевищує верхню межу норми внаслідок лікування ремдесивіром. Прийом можна відновити, коли АЛТ менше, ніж 5 разів перевищує верхню межу норми АБО підвищення рівня АЛТ супроводжується ознаками або симптомами запалення печінки або підвищенням кон’югованого білірубіну, лужної фосфатази або міжнародного нормалізованого відношення (МНВ). Не дозволено застосування ремдесивіру поза межами стаціонару. 2 1) розгляньте фавіпіравір: Фавіпіравір рекомендованонайкраще призначати ув перші 5 днів від появи перших симптомів захворювання за даними епідеміологічного спостереження. Тривалість лікування 5-14 днів. Застереження: Ффавіпіравір має тератогенну дію на плід, тому він протипоказаний при вагітності. Його не можна використовувати також при лактації та гіперчутливості до компонентів, які входять до складу даного лікарського засобу. Препарат заборонений для застосування жінкам і чоловіками без застосування засобів контрацепції. Рекомендується застосовувати надійні засоби контрацепції мінімум 7 днів після останнього прийому препарату. При застосуванні ібупрофену в низьких дозах (до 1200 мг на добу) не спостерігається збільшення ризику серцево-судинних тромботичних подій. Призначення низько молекулярних гепаринів (НМГ), якщо це не протипоказано (детальніше – див. пункт 2 частини ІІІ). Розгляньте фавіпіравір у перший день — навантажувальна доза по 1600 мг 2 рази на добу, надалі — по 600 мг 2 рази на добу протягом 5–14 днів. |
Розгляньте фавіпіравір у перший день – навантажувальна доза по 1600 мг 2 рази на добу, надалі – по 600 мг 2 рази на добу протягом 5-14 днів. Застереження: Фавіпіравір проявляє тератогенну дію на плід, тому він протипоказаний при вагітності. Його не можна використовувати також при лактації та гіперчутливості до компонентів, які входять до складу даного лікарського засобу. Препарат заборонений для застосування жінкам і чоловіками без застосування засобів контрацепції. Рекомендується застосовувати надійні засоби контрацепції мінімум 7 днів після останнього прийому препарату. |
|
Підтверджений COVID-19. зЗахворювання середнього ступеню тяжкості, пацієнт належить до групи ризику тяжкого і критичного перебігу |
Розгляньте при необхідності можливістьпочаток лікування гідроксихлорохіном, якщо немає протипоказання: 400 мг при підозрі/діагнозі; 400 мг через 12 годин;надалі 200 мг двічі на день до 5 днів. Зверніть увагу: припиніть лікування гіроксихлорохіном, якщо спостереження за пацієнтом буде продовжуватися вдома. Якщо немає гідросихлорохінуа, розгляньте можливість застосування препаратів на основі хлорохінуа 600 мг (10мг/кг) при діагнозі та 300мг (5мг/кг) через 12 годин, надалі 300 мг (5 мг/кг) двічі на день до 5 днів або хлорохін фосфат 1000 мг при діагнозі та 500мг через 12 годин, надалі 300 мг двічі на день до 5 днів.протягом дня Або розглянути: фавіпіравір 1-й день 1600 мг, потім 2–3 рази на день 600 мг на добу протягом 5–14 днів. У випадку погіршення стану пацієнта, при загрозі тяжкого перебігу та швидкого прогресування захворювання: лейкопенія та/або лімфопенія в загальному аналізі крові; підвищений рівень С-реактивного білка; підвищений рівень ІЛ-6, ІЛ-2 розглянути призначення тоцилізумабу 4-6 мг/кг, рекомендована доза 400 мг, введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. При потребі повторно через 12 год. Максимальна курсова доза – 3 введення (в середньому на пацієнта – 3 флакони по 400 мг/20 мл). |
Розгляньте при необхідності можливість лікування гідроксихлорохіном, якщо немає протипоказань: 400 мг при підозрі/діагнозі; 400 мг через 12 годин; надалі 200 мг двічі на день до 5 днів. Зверніть увагу: припиніть лікування гідроксихлорохіном, якщо спостереження за пацієнтом буде продовжуватися вдома. Протипоказання: відома алергічна реакція на лікарський засіб. Протипоказання при застосуванні гідроксихлорохіну: відома алергічна реакція на лікарський засіб. Застереження: інтервал QTс >500 мсек; гіпокаліємія; взаємодія лікарських засобів, відповідно до інструкції для медичного застосування. Можлива взаємодія гідросихлорохінуа, ймовірно, така сама як у хлорохінуа: відома недостатність глюкозо-6-фосфат дегідрогенази; важка міастенія; порфірія; патологія сітківки; епілепсія; неконтрольований діабет. Зверніть увагу: вагітність не є протипоказанням, як така (великий досвід безпечного застосування хлорохіну); див. Баланс співвідношення користь/ризик. Робіть ЕКГ щоденно, якщо початковий інтервал QTс 450-500 мсек, та біохімію відповідно до основного захворювання Зверніть увагу: з обережністю використовуйте при ураженні нирок з урахуванням недостатності даних фармакокінетики; зберігайте таку ж навантажувальну дозу як 1-го дня, але зменшіть дози на 2–5 днів до 50%, якщо швидкість клубочкової фільтрації 10–30 мл/хв, і до 25% – якщо швидкість клубочкової фільтрації <10 мл/хв або застосовується діаліз (дуже слабкі докази). Зверніть увагу: Виконуйте ЕКГ щодня, якщо початковий QTc 450–500 мсек та біохімічний аналіз крові (включаючи рівень калію) відповідно до основного захворювання. Якщо можливо, уникайте хінолонів та макролідів або ретельно контролюйте рівень QT, якщо ці антибіотики потрібні. |
|
Підтверджений COVID-19: тяжкий перебіг захворювання ≥1 з наступного: частота дихання ≥30/хв (дорослі); ≥40/хв (діти <5). Насичення киснем крові ≤92%; співвідношення PaO2/FiO2 <300. Інфільтрати в легенях>50% легеневого поля частота дихання ≥30/хв (дорослі); ≥40/хв (діти <5). Насичення киснем крові ≤93-94%; співвідношення PaO2/FiO2 <300. Інфільтрати в легенях >50% легеневого поля Інфільтрати в легенях>50% легеневого поля з наступного: частота дихання ≥30/хв (дорослі); ≥40/хв (діти <5). Насичення киснем крові ≤92%; співвідношення PaO2/FiO2 <300. Інфільтрати в легенях>50% легеневого поля частота дихання ≥30/хв (дорослі); ≥40/хв (діти <5). Насичення киснем крові ≤93-94%; співвідношення PaO2/FiO2 <300. Інфільтрати в легенях>50% легеневого поля Підтверджений COVID-19. Тяжкий перебіг ≥ 1 з наступного: частота дихання ≥30/хв (дорослі); ≥40/хв (діти <5). Насичення киснем крові ≤93-94%; співвідношення PaO2/FiO2 <300. Інфільтрати в легенях>50% легеневого поля |
Оптимальна підтримуюча терапія в лікарняній палаті (або відділенні/палаті інтенсивної терапії). Забезпечте О2. Призначення низько молекулярних гепаринів (НМГ), якщо це не протипоказано (детальніше – див. пункт 2 частини ІІІ) Ретельно розгляньте застосування протимікробних або протигрибкових засобів відповідно до локальної епідеміології за умови приєднання бактеріальної флори (детальніше – див. пункт 4 частини ІІІ) У випадку погіршення стану пацієнта, при загрозі тяжкого перебігу та швидкого прогресування захворювання: лейкопенія та/або лімфопенія в загальному аналізі крові; підвищений рівень С-реактивного білка; підвищений рівень ІЛ-6, ІЛ-2 розглянути призначення тоцилізумабу 4–6 мг/кг, рекомендована доза 400 мг, введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. При потребі повторно через 12 год. Максимальна курсова доза — 3 введення (в середньому на пацієнта — 3 флакони по 400 мг/20 мл). |
1) оптимальна підтримуюча терапія в лікарняній палаті (або відділенні/палаті інтенсивної терапії); 2) киснева підтримка; 3) системні кортикостероїди перорально або внутрішньовенно. Може застосовуватися дексаметазон або інші кортикостероїди, такі як гідрокортизон, метилпреднізолон. Доза дексаметазону 6 мг один раз/добу є еквівалентною (з точки зору глюкокортикоїдного ефекту) 150 мг гідрокортизону (50 мг кожні 8 годин), 32 мг метилпреднізолону (8 мг кожні 6 годин або 16 мг кожні 12 годин) або 150 мг гідрокортизону (50 мг кожні 8 годин) Тривалість лікування до 7–10 днів (або до виписки з лікарні із закладу охорони здоров’я, якщо це відбудеться раніше). У разі прогресування дихальної недостатності та лабораторних ознак запалення можуть бути розглянуті вищі дози системних кортикостероїдів відповідно до інструкції для медичного застосування. Застереження: контролюйте рівень глюкози, незалежно від того, чи відомо, що у пацієнта цукровий діабет. 4) призначення низькомолекулярних гепаринів (НМГ), якщо це не протипоказано (детальніше – див. пункт 2 частини ІІІ). 5) за умови приєднання бактеріальної флори ретельно розгляньте застосування антибактеріальнихпротимікробних або протигрибкових засобів відповідно до локальної епідеміології (детальніше – див. пункт 4 частини ІІІ). Варіанти додаткової терапії (за клінічними показаннями): 1) розгляньте ремдесивір Ремдесивір найкраще призначати у перші 5 днів від появи перших симптомів захворювання, але можливо у будь-якій термін за наявності клінічних показань. У перший день – навантажувальна доза 200 мг один раз на добу (в/в протягом 30-120 хв), з другого дня – підтримуюча доза 100 мг один раз на добу (в/в протягом 30-120 хв). Тривалість лікування: 5 днів для пацієнтів, які не потребують штучної вентиляції легень (ШВЛ) або екстракорпоральної мембранної оксигенації (ЕКМО). При відсутності ефекту або якщо пацієнт перебуває на штучній вентиляції легень (ШВЛ) або екстракорпоральній мембранній оксигенації (ЕКМО) – курс лікування складає 10 днів. Застереження: рРекомендовано ретельний моніторинг токсичності ремдесивіру або зменшеної ефективності супутнього препарату. Перед початком та щодня протягом застосування ремдесивіру у дорослих пацієнтів рекомендовано визначати розрахункову швидкість клубочкової фільтрації (eGFR). До початку прийому ремдесивіру кожному пацієнту необхідно провести дослідження функціонального стану печінки та відстежувати його протягом всього періоду лікування. Ремдесивір слід застосовувати пацієнтам із порушеннями функцій печінки лише в тих випадках, коли потенційна користь перевищує потенційний ризик. Ремдесивір не слід застосовувати пацієнтам, у яких рівень аланінамінотрансферази (АЛТ) у крові більше, ніж у 5 разів перевищує верхню межу норми. Слід припинити застосування ремдисивіру пацієнтами, у яких: АЛТ більше, ніж у 5 разів перевищує верхню межу норми внаслідок лікування ремдесивіром. Прийом можна відновити, коли АЛТ менше, ніж 5 разів перевищує верхню межу норми АБО підвищення рівня АЛТ супроводжується ознаками або симптомами запалення печінки або підвищенням кон’югованого білірубіну, лужної фосфатази або міжнародного нормалізованого відношення (МНВ). 2 3) розгляньте 10% імуноглобулін людини нормальний для внутрішньовенного введення у складі комплексної терапії дорослих пацієнтів з тяжкою пневмонією, яка викликана коронавірусною інфекцією SARS-CoV-2/COVID-19. У хворих з тяжким перебігом захворювання, що супроводжується наростаючими явищами інтоксикаційного синдрому та дихальної недостатності, негативною лабораторною динамікою, а саме: прогресуючим підвищенням рівня С-реактивного білка понад 50 Од, прогресуючою абсолютною лімфопенією, підвищенням рівня ферритину та ІЛ-6 (якщо доступне визначення) розглянути можливість застосування 10% імуноглобуліну людини нормального для внутрішньовенного введення в дозі 0,8-1,0 г/кг один раз на добу протягом 2 діб від початку погіршення стану (курсова доза 1,6-2,0 г/кг ідеальної маси тіла). Кратність інфузій та швидкість введення визначаються лікарем залежно від стану пацієнта. Добова доза може бути скоригована з міркувань неперевищення максимального добового об’єму інфузійної терапії. Обов’язковим є контроль стану системи згортання крові та діурезу, особливо у пацієнтів з надлишковою масою тіла. Застереження: внаслідок лікування препаратами імуноглобуліну може виникнути тромбоз. Фактори ризику: ожиріння, атеросклероз в анамнезі, порушення серцевого викиду, артеріальна гіпертензія, цукровий діабет з наявністю в анамнезі захворювання судин і випадків тромбозу, пацієнти з набутою або спадковою тромбофілією, пацієнти з тяжкою гіповолемією, пацієнти із захворюваннями, які підвищують в’язкість крові, літній вік, тривала іммобілізація, стани гіперкоагуляції, венозний або артеріальний тромбоз в анамнезі, застосування естрогенів, використання постійних центральних катетерів у судинах, підвищена в’язкість крові та ризик серцево-судинних захворювань. Тромбоз також може виникнути навіть у разі відсутності відомих факторів ризику. Слід здійснити загальну оцінку в’язкості крові у пацієнтів з ризиком підвищеної в’язкості, включаючи пов’язану з кріоглобулінами, хіломікронемією голодування/помітно високим рівнем тригліцеролів (тригліцеридів) або моноклональною гамопатією. Для пацієнтів з ризиком виникнення тромбозу практикується введення препаратів імуноглобуліну у мінімальних дозах та з мінімальною швидкістю інфузії. Перед застосуванням препарату слід переконатися у належному рівні гідратації пацієнта. У пацієнтів з ризиком виникнення підвищеної в’язкості слід здійснювати контроль симптомів тромбозу та оцінку в’язкості крові; 2) розгляньте фавіпіравір у перший день – навантажувальна доза по 1600 мг 2 рази на добу, надалі – по 600 мг 2 рази на добу. Тривалість лікування 5-14 днів. Застереження: фавіпіравір має тератогенну дію на плід, тому він протипоказаний при вагітності. Його не можна використовувати також при лактації та гіперчутливості до компонентів, які входять до складу даного лікарського засобу. Препарат заборонений для застосування жінкам і чоловіками без застосування засобів контрацепції. Рекомендується застосовувати надійні засоби контрацепції мінімум 7 днів після останнього прийому препарату. 3) розгляньте тоцилізумаб 3 4) розгляньте тоцилізумаб При прогресуванні захворювання тоцилізумаб призначають не раніше 7-го дня від початку клінічних симптомів або з урахуванням рентгенологічних змін (у деяких хворих клінічні ознаки початкового періоду відсутні). Показання до призначення тоцилізумабу: інтерстиціальна пневмонія з гострою дихальною недостатністю, прогресуюча дихальна недостатність, потреба підключення до неінвазивної або інвазивної вентиляції, наявність позалегеневих уражень органів. Підвищення рівня C-реактивного білка, D-димеру та феритину корелює з підвищенням рівня IL-6 та поганим результатом у пацієнтів з тяжкою інфекцією COVID-19. Якщо визначити рівні IL-6 неможливо, розглянути введення тоцилізумабу у хворих із прогресуючим тяжким перебігом захворювання та зростаючими показниками C-реактивного білку. Тоцилізумаб рекомендовано застосовувати як додаток до терапії кортикостероїдами у пацієнтів, у яких спостерігається швидка декомпенсація дихання: пацієнти, що перебувають на інвазивній механічній вентиляції легень протягом не більше 24 годин; пацієнти із швидко зростаючими потребами в кисні, що потребують неінвазивної механічної вентиляції легень або кисню через носові канюлі з високим потоком, та у яких підвищений рівень С-реактивного білку в 5 разів вище від верхнього референтного значення. При прогресуванні захворювання тоцилізумаб призначають не раніше 7-го дня від початку клінічних симптомів або з урахуванням рентгенологічних змін (у деяких хворих клінічні ознаки початкового періоду відсутні). Рекомендована доза тоцилізумабу становить 8 мг/кг для внутрішньовенної інфузії однократно. Загальна доза не повинна перевищувати 800 мг. Тоцилізумаб слід розводити у 100 мл 0,9% натрію хлориду і вводити впродовж 1 години. Друга доза не повинна розглядатися, враховуючи невизначеність щодо доказів додаткової користі. Оскільки тоцилізумаб пригнічує вироблення С-реактивного білку, зменшення його рівня не слід використовувати як ознаку клінічного поліпшення. Протипоказання до призначення тоцилізумабу: AСТ/AЛТ >5 раз вище норми; кількість нейтрофілів <500; кількість тромбоцитів < 50 000; сепсис не спричинений SARS-CoV-2; підвищений рівень прокальцитоніну більш, ніж в 2 рази; наявність коморбідних станів, що можуть призвести до негативного прогнозу, ускладнений дивертикуліт, піодерміт, негативна відповідь на імуносупресивну терапію. Не дозволено застосування тоцилізумабу поза межами стаціонару. Тоцилізумаб 4-8 мг/кг (рекомендована доза 400 мг), введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. У разі відсутності відповіді на терапію повторна доза може бути введена через 12 год. Максимальна курсова доза – 2 введення (800 мг). Тоцилізумаб не рекомендовано вводити більше 2 разів. Протипоказання відповідно до інструкції для медичного застосування тоцилізумабу. Системні кортикостероїди перорально або внутрішньовенно Може застосовуватися дексаметазон або інші кортикостероїди, такі як гідрокортизон, метилпреднізолон або преднізон. Доза дексаметазону 6 мг один раз/добу є еквівалентною (з точки зору глюкокортикоїдного ефекту) 150 мг гідрокортизону (50 мг кожні 8 годин), 40 мг преднізону, 32 мг метилпреднізолону (8 мг кожні 6 годин або 16 мг кожні 12 годин). Тривалість лікування: до 7–10 днів (або до виписки з лікарні, якщо це відбудеться раніше). Застереження Моніторинг: контролюйте рівень глюкози, незалежно від того, чи відомо, що у пацієнта діабет. Все ще існує обмежена інформація щодо взаємодії лікарських засобів. Оцінку користь/ризик слід проводити індивідуально. Протипоказання відповідно до інструкції для медичного застосування лікарського засобу. |
|
Підтверджений COVID-19. Тяжкий перебіг ≥ 1 з наступного: частота дихання ≥30/хв (дорослі); ≥40/хв (діти <5). Насичення киснем крові ≤93%. сСспіввідношення PaO2/FiO2 <300. Інфільтрати в легенях >50% легеневого поля протягом 24-48 год. |
Оптимальна підтримуюча терапія в лікарняній палаті (або реанімаційному відділенні). Забезпечте О2. Ретельно розгляньте застосування антибіотиків або протигрибкових засобів відповідно до локальної епідеміології. Розгляньте початок лікування гідроксихлорохіном, якщо немає протипоказання: 400 мг при діагнозі; 400 мг через 12 годин; надалі 200 мг двічі на день до 5 днів. Зверніть увагу: якщо немає гідросихлорохінуа, розгляньте можливість застосування препаратів на основі хлорохіна 600 мг (10мг/кг) при діагнозі та 300мг (5 мг/кг) через 12 годин, надалі 300 мг (5 мг/кг) двічі на день до 5 днів або хлорохін фосфат 1000 мг при діагнозі та 500 мг через 12 годин, надалі 300мг двічі на день до 5 днів. Розгляньте застосування лопінавір/ритонавір* 400/100 мг (2 таблетки по 200/50 мг) двічі на день протягом 14 днів), як другий варіант вибору лише якщо гідроксихлорохінгідрохлорохін/хлорохін протипоказані та за умови, що він може застосовуватись протягом 10 днів після початку симптомів (перевірте також взаємодію лікарських засобів); або у дітей <10 кг (після консультації інфекціоніста. (IDS) Або розглянути: фавіпіравір 1-й день 1600 мг, потім 2-3 рази на день 600 мг на добу протягом 5–14 днів. У випадку погіршення стану пацієнта, при загрозі тяжкого перебігу та швидкого прогресування захворювання: лейкопенія та/або лімфопенія в загальному аналізі крові; підвищений рівень С-реактивного білка; підвищений рівень ІЛ-6, ІЛ-2 розглянути призначення тоцилізумабу 4–6 мг/кг, рекомендована доза 400 мг, введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. При потребі повторно через 12 год. Максимальна курсова доза – 3 введення (в середньому на пацієнта – 3 флакони по 400 мг/20 мл) Розглянути ремдесивір у перший день — навантажувальна доза 200 мг один раз на добу (в/в протягом 30-120 хв), з другого дня — підтримуюча доза 100 мг один раз на добу (в/в протягом 30-120 хв). Тривалість лікування: 5 днів для пацієнтів, які не потребують ШВЛ або ЕКМО. При відсутності ефекту або якщо пацієнт перебуває на ШВЛ або ЕКМО — курс лікування складає 10 днів. Тяжкий перебіг захворювання для застосування ремдесивіру визначається, якщо SpO2 ≤94%, виникає потреба у додатковому кисні, ШВЛ або ЕКМО/ Ремдесивір не рекомендується для лікування легкої або середньотяжкої форми COVID-19 поза клінічними дослідженнями. |
Тривалість лікування: 5 днів для пацієнтів, які не потребують штучної вентиляції легень (ШВЛ) або екстракорпоральної мембранної оксигенації (ЕКМО). При відсутності ефекту або якщо пацієнт перебуває на штучній вентиляції легень (ШВЛ) або екстракорпоральній мембранній оксигенації (ЕКМО) – курс лікування складає 10 днів. Застереження Все ще існує обмежена інформація щодо взаємодії лікарських засобів. Оцінку користь/ризик слід проводити індивідуально. Рекомендовано ретельний моніторинг токсичності ремдесивіру або зменшеної ефективності супутнього препарату. Перевірте взаємодію з іншими лікарськими засобами. Зверніть увагу: Передперед початком та щодня протягом застосування ремдесивіру у дорослих пацієнтів рекомендовано визначати розрахункову швидкість клубочкової фільтрації (eGFR). Ремдесивір не слід застосовувати пацієнтам із розрахунковою швидкістю клубочкової фільтрації (eGFR) <30 мл/хв. Протипоказання: відома алергічна реакція на лікарський засіб. Застереження: інтервал QTск > 500 мсек; гіпокаліємія;лікопов’язана взаємодія лікарських засобів, відповідно до інструкції для медичного застосування. Можлива взаємодія гідросихлорохінуа, ймовірно, така сама як у хлорохінуа: відома недостатність глюкозо-6-фосфат дегідрогенази; важка міастенія; порфірія; патологія сітківки;епілепсія; неконтрольований діабет. Зверніть увагу: вагітність не є протипоказанням, як така (великий досвід безпечного застосування хлорохіну); див. співвідношенняБаланс користь/ризик. Зверніть увагу: з обережністю використовуйте при ураженні нирок з урахуванням недостатності даних фармакокінетики; зберігайте таку ж навантажувальну дозу як 1-го дня, але зменшіть дози на 2–5 днів до 50%, якщо швидкість клубочкової фільтрації 10–30 мл/хв, і до 25% — якщо швидкість клубочкової фільтрації <10 мл/хв або застосовується діаліз (дуже слабкі докази). Зверніть увагу: Виконуйте ЕКГ щодня, якщо початковий QTc 450–500 мсек та біохімічний аналіз крові (включаючи рівень калію) відповідно до основного захворювання. Якщо можливо, уникайте хінолонів та макролідів або ретельно контролюйте рівень Q–T, якщо ці антибіотики потрібні. Робіть загальний біохімічний аналіз щоденно та ЕКГ щоденно, якщо початковий інтервал QTс >450 мсек (та інші призначені дослідження). Уникайте хінолонів, якщо можливо, або проводьте ретельний моніторинг інтервалу QT, якщо потрібні ці антибіотики. Якщо слід застосовувати антибіотики, розгляньте додаткове застосування азитроміцину (за умови його можливого синергічного ефекту з гідроксихлорохіном), але з особливою обережністю щодо взаємодій та пролонгації інтервалу QTс (щоденно ЕКГ або моніторинг серця) |
|
Або у разі відсутності ремдесивіру розглянути фавіпіравір у перший день — навантажувальна доза по 1600 мг 2 рази на добу, надалі — по 600 мг 2 рази на добу протягом 5-14 днів. |
Розгляньте фавіпіравір у перший день – навантажувальна доза по 1600 мг 2 рази на добу, надалі – по 600 мг 2 рази на добу протягом 5-14 днів. Застереження Фавіпіравір проявляє тератогенну дію на плід, тому він протипоказаний при вагітності. Його не можна використовувати також при лактації та гіперчутливості до компонентів, які входять до складу даного лікарського засобу. Препарат заборонений для застосування жінкам і чоловіками без застосування засобів контрацепції. Рекомендується застосовувати надійні засоби контрацепції мінімум 7 днів після останнього прийому препарату. Фавіпіравір проявляє тератогенну дію на плід, тому він протипоказаний при вагітності. Його не можна використовувати також при лактації та гіперчутливості до компонентів, які входять до складу даного лікарського засобу. Препарат заборонений для застосування жінкам і чоловіками без застосування засобів контрацепції. Рекомендується застосовувати надійні засоби контрацепції мінімум 7 днів після останнього прийому препарату. |
|
|
У випадку погіршення стану пацієнта, при загрозі тяжкого перебігу та швидкого прогресування захворювання: лейкопенія та/або лімфопенія в загальному аналізі крові; підвищений рівень С-реактивного білка; підвищений рівень ІЛ-6, ІЛ-2 розглянути призначення тоцилізумабу 4-6 мг/кг, рекомендована доза 400 мг, введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. При потребі повторно через 12 год. Максимальна курсова доза — 3 введення (в середньому на пацієнта — 3 флакони по 400 мг/20 мл).
|
При прогресуванні захворювання тоцилізумаб призначають не раніше 7-го дня від початку клінічних симптомів або з урахуванням рентгенологічних змін (у деяких хворих клінічні ознаки початкового періоду відсутні).=Показання до призначення тоцилізумабу: інтерстеціальна пневмонія з гострою дихальною недостатністю, прогресуюча дихальна недостатність, потреба підключення до неінвазивної або інвазивної вентиляції, наявність позалегеневих уражень органів. Підвищення рівня C-реактивного білка, D-димеру та феритину корелює з підвищенням рівня IL-6 та поганим результатом у пацієнтів з тяжкою інфекцією COVID-19. Протипоказання до призначення тоцилізумабу: AСТ/AЛТ >5 раз більше норми Кількість нейтрофілів <500 Кількість тромбоцитів < 50 000 Сепсис не спричинений SARS-CoV-2 Підвищений рівень прокальцитоніну більш, ніж в 2 рази. Наявність коморбідних станів, що можуть призвести до негативного прогнозу, ускладнений дивертикуліт, піодерміт, негативна відповідь на імуносупресивну терапію. Тоцилізумаб 4-6 мг/кг, рекомендована доза 400 мг, введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. При потребі повторно через 12 год. Максимальна курсова доза – 3 введення (в середньому на пацієнта – 3 флакони по 400 мг/20 мл). Протипоказання відповідно до інструкції для медичного застосування тоцилізумабу. Протипоказання відповідно до інструкції для медичного застосування лікарського засобу. |
|
|
Підтверджений COVID-19. Критичний перебіг Критичне захворювання ≥1 з наступного: гострий респіраторний дистрес синдром; сепсис; змінена свідомість; поліорганна недостатність. Підтверджений COVID-19: тяжкий перебіг захворювання ≥1 з наступного: частота дихання ≥30/хв (дорослі); ≥40/хв (діти <5). Насичення киснем крові ≤92%; Співвідношення PaO2/FiO2 <300. Інфільтрати в легенях >50% легеневого поля частота дихання ≥30/хв (дорослі); ≥40/хв (діти <5). Насичення киснем крові ≤93–94%; співвідношення PaO2/FiO2 <300. Інфільтрати в легенях >50% легеневого поля Підтверджений COVID-19: критичний перебіг захворювання ≥ 1 з наступного: гострий респіраторний дистрес синдром; сепсис; змінена свідомість; поліорганна недостатність. |
1) оптимальна підтримуюча терапія у відділенні/палаті інтенсивної терапії; 2) механічна вентиляція легень; 3) призначення низькомолекулярних гепаринів (НМГ), якщо це не протипоказано (детальніше – див. пункт 2 частини ІІІ); 4) системні кортикостероїди внутрішньовенно. Може застосовуватися дексаметазон або інші кортикостероїди, такі як гідрокортизон, метилпреднізолон; Доза дексаметазону 6 мг один раз/добу є еквівалентною (з точки зору глюкокортикоїдного ефекту) 150 мг гідрокортизону (50 мг кожні 8 годин), 32 мг метилпреднізолону (8 мг кожні 6 годин або 16 мг кожні 12 годин) або 150 мг гідрокортизону (50 мг кожні 8 годин). Тривалість лікування до 7–10 днів. У разі прогресування дихальної недостатності та лабораторних ознак запалення можуть бути розглянуті вищі дози системних кортикостероїдів відповідно до інструкції для медичного застосування. Застереження: контролюйте рівень глюкози, незалежно від того, чи відомо, що у пацієнта цукровий діабет. 5) спеціальна профілактика та лікування гострого респіраторного дистрес-синдрому (детальніше – див. пункт 5 частини ІІІ); 6) запобігання подальшому фіброзу легень; 7) за умови приєднання бактеріальної флори ретельно розгляньте застосування антибактеріальнихпротимікробних або протигрибкових засобів відповідно до локальної епідеміології (детальніше – див. пункт 4 частини ІІІ). Відстеження вторинних бактеріальних та опортуністичних інфекцій (Aspergillus). Варіанти додаткової терапії (за клінічними показаннями): Розгляньте 1) розгляньте тоцилізумаб При прогресуванні захворювання тоцилізумаб призначають не раніше 7-го дня від початку клінічних симптомів або з урахуванням рентгенологічних змін (у деяких хворих клінічні ознаки початкового періоду відсутні). Показання до призначення тоцилізумабу: інтерстеціальна пневмонія з гострою дихальною недостатністю, прогресуюча дихальна недостатність, потреба підключення до неінвазивної або інвазивної вентиляції, наявність позалегеневих уражень органів. Підвищення рівня C-реактивного білка, D-димеру та феритину корелює з підвищенням рівня IL-6 та поганим результатом у пацієнтів з тяжкою інфекцією COVID-19. Якщо визначити рівні IL-6 неможливо, розглянути введення тоцилізумабу у хворих із прогресуючим тяжким перебігом захворювання та зростаючими показниками C-реактивного білку. –Протипоказання до призначення тоцилізумабу: AСТ/AЛТ >5 раз вище норми; кількість нейтрофілів <500; кількість тромбоцитів < 50 000; сепсис не спричинений SARS-CoV-2; підвищений рівень прокальцитоніну більш, ніж в 2 рази; наявність коморбідних станів, що можуть призвести до негативного прогнозу, ускладнений дивертикуліт, піодерміт, негативна відповідь на імуносупресивну терапію. Тоцилізумаб 4-8 мг/кг (рекомендована доза 400 мг), введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. У разі відсутності відповіді на терапію повторна доза може бути введена через 12 год. Максимальна курсова доза – 2 введення (800 мг). Тоцилізумаб не рекомендовано вводити більше 2 разів. Протипоказання відповідно до інструкції для медичного застосування тоцилізумабу. 1) розгляньте тоцилізумаб Показання до призначення тоцилізумабу: інтерстиціальна пневмонія з гострою дихальною недостатністю, прогресуюча дихальна недостатність, потреба підключення до неінвазивної або інвазивної вентиляції, наявність позалегеневих уражень органів. Підвищення рівня C-реактивного білка, D-димеру та феритину корелює з підвищенням рівня IL-6 та поганим результатом у пацієнтів з тяжкою інфекцією COVID-19. Якщо визначити рівні IL-6 неможливо, розглянути введення тоцилізумабу у хворих із прогресуючим тяжким перебігом захворювання та зростаючими показниками C-реактивного білку. Тоцилізумаб рекомендовано застосовувати як додаток до терапії кортикостероїдами у пацієнтів, у яких спостерігається швидка декомпенсація дихання: пацієнти, що перебувають на інвазивній механічній вентиляції легень протягом не більше 24 годин; пацієнти із швидко зростаючими потребами в кисні, що потребують неінвазивної механічної вентиляції легень або кисню через носові канюлі з високим потоком, та у яких підвищений рівень С-реактивного білку в 5 разів вище від верхнього референтного значення. При прогресуванні захворювання тоцилізумаб призначають не раніше 7-го дня від початку клінічних симптомів або з урахуванням рентгенологічних змін (у деяких хворих клінічні ознаки початкового періоду відсутні). Рекомендована доза тоцилізумабу становить 8 мг/кг для внутрішньовенної інфузії однократно. Загальна доза не повинна перевищувати 800 мг. Тоцилізумаб слід розводити у 100 мл 0,9% натрію хлориду і вводити впродовж 1 години. Друга доза не повинна розглядатися, враховуючи невизначеність щодо доказів додаткової користі. Оскільки тоцилізумаб пригнічує вироблення С-реактивного білку, зменшення його рівня не слід використовувати як ознаку клінічного поліпшення. Протипоказання до призначення тоцилізумабу: AСТ/AЛТ >5 раз вище норми; кількість нейтрофілів <500 кількість тромбоцитів <50 000; сепсис не спричинений SARS-CoV-2; підвищений рівень прокальцитоніну більш, ніж в 2 рази; наявність коморбідних станів, що можуть призвести до негативного прогнозу, ускладнений дивертикуліт, піодерміт, негативна відповідь на імуносупресивну терапію. Не дозволено застосування тоцилізумабу поза межами стаціонару. 2)2) Ррозгляньте 10% імуноглобулін людини нормальний для внутрішньовенного введення у складі комплексної терапії дорослих пацієнтів з тяжкою пневмонією, яка викликана коронавірусною інфекцією SARS-CoV-2/COVID-19. У хворих з критичним перебігом захворювання, що супроводжується наростаючими явищами інтоксикаційного синдрому та дихальної недостатності, негативною лабораторною динамікою, а саме: прогресуючим підвищенням рівня С-реактивного білка понад 50 Од, прогресуючою абсолютною лімфопенією, підвищенням рівня ферритину та ІЛ-6 (якщо доступне визначення) розглянути можливість застосування 10% імуноглобуліну людини нормального для внутрішньовенного введення в дозі 0,8-1,0 г/кг один раз на добу протягом 2 діб від початку погіршення стану (курсова доза 1,6-2,0 г/кг ідеальної маси тіла). Кратність інфузій та швидкість введення визначаються лікарем залежно від стану пацієнта. Добова доза може бути скоригована з міркувань неперевищення максимального добового об’єму інфузійної терапії. Обов’язковим є контроль стану системи згортання крові та діурезу, особливо у пацієнтів з надлишкою масою тіла. Застереження: Внаслідок лікування препаратами імуноглобуліну може виникнути тромбоз. Фактори ризику: ожиріння, атеросклероз в анамнезі, порушення серцевого викиду, артеріальна гіпертензія, цукровий діабет з наявністю в анамнезі захворювання судин і випадків тромбозу, пацієнти з набутою або спадковою тромбофілією, пацієнти з тяжкою гіповолемією, пацієнти із захворюваннями, які підвищують в’язкість крові, літній вік, тривала іммобілізація, стани гіперкоагуляції, венозний або артеріальний тромбоз в анамнезі, застосування естрогенів, використання постійних центральних катетерів у судинах, підвищена в’язкість крові та ризик серцево-судинних захворювань. Тромбоз також може виникнути навіть у разі відсутності відомих факторів ризику. Слід здійснити загальну оцінку в’язкості крові у пацієнтів з ризиком підвищеної в’язкості, включаючи пов’язану з кріоглобулінами, хіломікронемією голодування/помітно високим рівнем тригліцеролів (тригліцеридів) або моноклональною гамопатією. Для пацієнтів з ризиком виникнення тромбозу практикується введення препаратів імуноглобуліну у мінімальних дозах та з мінімальною швидкістю інфузії. Перед застосуванням препарату слід переконатися у належному рівні гідратації пацієнта. У пацієнтів з ризиком виникнення підвищеної в’язкості слід здійснювати контроль симптомів тромбозу та оцінку в’язкості крові. Оптимальна підтримуюча терапія у відділенні інтенсивної терапії. Механічна вентиляція. Призначення низько молекулярних гепаринів (НМГ), якщо це не протипоказано (детальніше – див. пункт 2 частини ІІІ) Спеціальна профілактика та лікування гострого респіраторного дистрес синдрому. (детальніше – див. пункт 5 частини ІІІ) Запобігання подальшому фіброзу легень. Ретельно розгляньте застосування протимікробних або протигрибкових засобів відповідно до локальної епідеміології (детальніше – див. пункт 4 частини ІІІ) Відстеження вторинних бактеріальних та опортуністичних інфекцій (Aspergillus). Запобігання подальшому фіброзу легень. Розгляньте ремдесивір у перший день — навантажувальна доза 200 мг один раз на добу (в/в протягом 30–120 хв), з другого дня — підтримуюча доза 100 мг один раз на добу (в/в протягом 30–120 хв). Тривалість лікування: 5 днів для пацієнтів, які не потребують ШВЛ або ЕКМО. При відсутності ефекту або якщо пацієнт перебуває на ШВЛ або ЕКМО — курс лікування складає 10 днів. Ремдесивір** (тільки в умовах клінічного дослідження): ударна доза 200 мг (в/в, протягом 30 хв); 100 мг один раз на день від 2 до 10 днів. Якщо ремдесивір відсутній: розгляньте можливість застосування гідроксихлорохінуа, хлорохінуа, при тому ж дозуванні та моніторингу, як вище; замініть ремдесивіром, якщо з’явиться. Гідроксихлорохін, хлорохін з обережністю застосовувати при нирковій/печінковій/серцевій недостатності. Або розглянути: фавіпіравір 1-й день 1600 мг, потім 2–3 рази на день 600 мг на добу протягом 5–14 днів. Розглянути призначення тоцилізумабу пацієнтам групи ризику (визначених в наказі МОЗ №722 від 28.03.2020 р. №722) при загрозі тяжкого перебігу та швидкого прогресування захворювання: лейкопенія та/або лімфопенія в загальному аналізі крові; підвищений рівень С-реактивного білка; підвищений рівень ІЛ-6, ІЛ–2. Тоцилізумаб 4–6 мг/кг, рекомендована доза 400 мг, введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. При потребі повторно через 12 год. Максимальна курсова доза – 3 введення (в середньому на пацієнта – 3 флакони по 400 мг/20 мл). |
Системні кортикостероїди перорально або внутрішньовенно. Може застосовуватися дексаметазон або інші кортикостероїди, такі як гідрокортизон, метилпреднізолон або преднізон. Доза дексаметазону 6 мг один раз/добу є еквівалентною (з точки зору глюкокортикоїдного ефекту) 150 мг гідрокортизону (50 мг кожні 8 годин), 40 мг преднізону, 32 мг метилпреднізолону (8 мг кожні 6 годин або 16 мг кожні 12 годин). Тривалість лікування: до 7–10 днів. Застереження Моніторинг: контролюйте рівень глюкози, незалежно від того, чи відомо, що у пацієнта діабет. Все ще існує обмежена інформація щодо взаємодії лікарських засобів. Оцінку користь/ризик слід проводити індивідуально. Оцінку користь/ризик слід проводити індивідуально. Рекомендовано ретельний моніторинг токсичності ремдесивіру або зменшеної ефективності супутнього препарату. Перевірте взаємодію з іншими лікарськими засобами. Перед початком та щодня протягом застосування ремдесивіру у дорослих пацієнтів рекомендовано визначати розрахункову швидкість клубочкової фільтрації (eGFR). Ремдесивір не слід застосовувати пацієнтам із розрахунковою швидкістю клубочкової фільтрації (eGFR) <30 мл/хв. Перевірте взаємодію з іншими лікарськими засобами. |
|
Розгляньте ремдесивір у перший день – навантажувальна доза 200 мг один раз на добу (в/в протягом 30-120 хв), з другого дня – підтримуюча доза 100 мг один раз на добу (в/в протягом 30-120 хв). Тривалість лікування: 5 днів для пацієнтів, які не потребують штучної вентиляції легень (ШВЛ) або екстракорпоральної мембранної оксигенації (ЕКМО). При відсутності ефекту або якщо пацієнт перебуває на штучній вентиляції легень (ШВЛ) або екстракорпоральній мембранній оксигенації (ЕКМО) – курс лікування складає 10 днів. Застереження Рекомендовано ретельний моніторинг токсичності ремдесивіру або зменшеної ефективності супутнього препарату. Перевірте взаємодію з іншими лікарськими засобами. Зверніть увагу Перед початком та щодня протягом застосування ремдесивіру у дорослих пацієнтів рекомендовано визначати розрахункову швидкість клубочкової фільтрації (eGFR). Ремдесивір не слід застосовувати пацієнтам із розрахунковою швидкістю клубочкової фільтрації (eGFR) <30 мл/хв. |
||
|
Або у разі відсутності ремдесивіру розглянути: фавіпіравір у перший день — навантажувальна доза по 1600 мг 2 рази на добу, надалі — по 600 мг 2 рази на добу протягом 5–14 днів. |
Або у разі відсутності ремдесивіру розглянути: фавіпіравір у перший день – навантажувальна доза по 1600 мг 2 рази на добу, надалі – по 600 мг 2 рази на добу протягом 5-14 днів. Застереження Фавіпіравір проявляє тератогенну дію на плід, тому він протипоказаний при вагітності. Його не можна використовувати також при лактації та гіперчутливості до компонентів, які входять до складу даного лікарського засобу. Препарат заборонений для застосування жінкам і чоловіками без застосування засобів контрацепції. Рекомендується застосовувати надійні засоби контрацепції мінімум 7 днів після останнього прийому препарату. |
|
|
Розглянути призначення тоцилізумабу пацієнтам з групи ризику (визначених в наказі МОЗ № 722 від 28 березня 2020 року) при загрозі тяжкого перебігу та швидкого прогресування захворювання: лейкопенія та/або лімфопенія в загальному аналізі крові; підвищений рівень С-реактивного білка; підвищений рівень ІЛ-6, ІЛ-2. Тоцилізумаб 4-6 мг/кг, рекомендована доза 400 мг, введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. При потребі повторно через 12 год. Максимальна курсова доза — 3 введення (в середньому на пацієнта — 3 флакони по 400 мг/20 мл). |
При прогресуванні захворювання тоцилізумаб призначають не раніше 7-го дня від початку клінічних симптомів або з урахуванням рентгенологічних змін (у деяких хворих клінічні ознаки початкового періоду відсутні). Показання до призначення тоцилізумабу: інтерстеціальна пневмонія з гострою дихальною недостатністю, прогресуюча дихальна недостатність, потреба підключення до неінвазивної або інвазивної вентиляції, наявність позалегеневих уражень органів. Підвищення рівня C-реактивного білка, D-димеру та феритину корелює з підвищенням рівня IL-6 та поганим результатом у пацієнтів з тяжкою інфекцією COVID-19. Протипоказання до призначення тоцилізумабу: AСТ/AЛТ >5 раз більше норми Кількість нейтрофілів <500 Кількість тромбоцитів < 50 000 Сепсис не спричинений SARS-CoV-2 Підвищений рівень прокальцитоніну більш, ніж в 2 рази. Наявність коморбідних станів, що можуть призвести до негативного прогнозу, ускладнений дивертикуліт, піодерміт, негативна відповідь на імуносупресивну терапію. Тоцилізумаб 4-6 мг/кг, рекомендована доза 400 мг, введення дози впродовж 1 години на 100 мл 0,9% фізіологічного розчину. При потребі повторно через 12 год. Максимальна курсова доза – 3 введення (в середньому на пацієнта – 3 флакони по 400 мг/20 мл). Протипоказання відповідно до інструкції для медичного застосування тоцилізумабу. Протипоказання відповідно до інструкції для медичного застосування лікарського засобу. |
Таблиця 2. Варіанти схем лікування для дорослих пацієнтів
| Тяжкість захворювання | Схеми лікування | |||
|---|---|---|---|---|
| Середньотяжкий ступінь у пацієнта групи ризику | Лопінавір/ритонавір + хлорохін або гідроксихлорохін протягом 5–7 днів | Розгляньте застосування лопінавір/ритонавір; тривалість в залежності від моніторингу екскреції вірусу | Розгляньте застосування хлорохіну протягом 5 днів | |
| Тяжкий ступінь | Хлорохін або гідроксихлорохін + ремдесивір протягом 5–20 днів (якщо ремдесивір відсутній: підтримуюча терапія лопінавіром/ритонавіром з хлорохіном) | Ремдесивір, тривалість в залежності від моніторингу екскреції вірусу (жодного варіанту другого вибору) | Хлорохін (600–300мг; день 2-день 5 300 мг двічі на день); лопінавір/ритонавір як варіант другого вибору (протягом 10–14 днів) | Лопінавір/ритонавір |
| Критичний ступінь | Хлорохін або гідроксихлорохін +ремдеcивір протягом 5–20 днів (якщо ремдесивір відсутній: підтримуюча терапія лопінавіром/ритонавіром з хлорохіном) | Ремдесивір; тривалість в залежності від моніторингу екскреції вірусу; лопінавір/ритона вір, як варіант другого вибору (в залежності від кожного конкретного випадку) | Хлорохін (протягом 5 днів) + ремдесивір (протягом 10 днів) | Ремдесивір як варіант першого вибору (протягом 10 днів), Лопінавір/ритонавір (+гідроксихлорохін якщо <65/відсутність супутнього захворювання), як варіант другого вибору (якщо ремдесивір відсутній). |
Таблиця 23.
Рекомендовано для лікування дітей з підозрою або лабораторно підтверджено коронавірусною хворобою (COVID-19), госпіталізованих із тяжким перебігом захворюванняю
Лікування пацієнтів дитячого віку із підтвердженим випадком, підозрілим випадком із клініко-епідеміологічним підтвердженням, тяжким перебігом
Таблиця 2. Рекомендації для лікування пацієнтів дитячого вікудітей з підозрою або лабораторно підтвердженим COVID-19, госпіталізованих із тяжким перебігомтяжким перебігом захворювання
| Лікарський засіб | Особливості застосуванняДозування | Тривалість курсу |
|---|---|---|
| Тяжкий перебіг захворювання | Всі ступені тяжкості | |
|
Гідроксихлорохін Ремдесивір Рекомендовано Ремдесивір для лікування дітей з підозрюваним або лабораторно підтвердженим COVID-19, госпіталізованих із тяжким перебігом захворювання. Тяжке захворювання визначається якщо SpO2 ≤94%, виникає потреба у додатковому кисні, ШВЛ або ЕКМО. Ремдесивір можна розглянути для дітей із середнім ступенем тяжкості захворювання, що належать до груп ризику прогресування до тяжкого або критичного перебігу захворювання та мають ознаки пневмонії. Ремдесивір не рекомендується для лікування легкої або середньотяжкої форми COVID-19. поза клінічними дослідженнями. |
Вік <6 років: гідроксихлорохін сульфат 6,5 мг/кг/добу, розділений на 2 рази на день (максимальна доза — 400 мг/добу) Вік > 6 років: гідроксихлорохін сульфат 10 мг/кг/добу, розділений на 2 рази на день (максимальна доза — 400 мг/добу). Протипоказання: QTc > 500 мсек (ЕКГ перед лікуванням, та раз на день, якщо QTc >450 мсек), важка міастенія, порфірія, захворювання сітківки, епілепсія. Ремдесивір найкраще призначати у перші 5 днів від появи перших симптомів захворювання, але можливо у будь-якій термін за наявності клінічних показань. діти з масою тіла ≥3,5 кг до <40 кг: у перший день навантажувальна доза 5 мг/кг один раз на добу (в/в протягом 30–120 хв), з другого дня — підтримуюча доза 2,5 мг/кг один раз на добу (в/в протягом 30–120 хв). ВУ складі лікарських форм для парентерального введення ремдесивіру є допоміжна речовина натрієва сіль сульфобутилового ефіру-β-циклодекстрину (SBECD). SBECD виводиться нирками і може затримуватися у пацієнтів з порушеною функцією нирок. Ліофілізований порошок ремдесивіру містить 3 г SBECD на 100 мг ремдесивіру, тоді як розчин для ін’єкцій 5 мг/мл містить 6 г SBECD на 100 мг ремдесивіру. Виходячи з більш низького вмісту SBECD, виробник рекомендує застосовувати у педіатричних пацієнтів з масою тіла <40 кг тільки ліофілізований порошок. діти з масою тіла ≥40 кг:у перший день — навантажувальна доза 200 мг один раз на добу (в/в протягом 30–120 хв), з другого дня — підтримуюча доза 100 мг один раз на добу (в/в протягом 30–120 хв). Тривалість лікування: 5 днів для пацієнтів, які не потребують ШВЛ або ЕКМО. При відсутності ефекту або якщо пацієнт перебуває на ШВЛ або ЕКМО – курс лікування складає 10 днів. Безпека та ефективність ремдеcивіру ув дітей віком до 12 років та вагою <40 кг не встановлені. Запропонована схема лікування для дітей до 12 років може бути оновлена, коли дані клінічних досліджень стануть доступними.Перед початком та щодня протягом застосування ремдесивіру у дорослих пацієнтів та дітей старше 28 днів рекомендовано визначати розрахункову швидкість клубочкової фільтрації (eGFR), а новонародженим (від 7 днів до 28 днів включно) рекомендовано визначати креатинін сироватки крові.Ремдесивір не слід застосовувати пацієнтам із розрахунковою швидкістю клубочкової фільтрації (eGFR) <30 мл/хв/1,73м2.. Розгляньте ремдесивір для пацієнтів дитячого віку, госпіталізованих із середньо тяжким перебігом захворювання, що належать до груп ризику прогресування до тяжкого або критичного перебігу захворювання та мають ознаки пневмонії. Ризик прогресування до тяжкого або критичного перебігу захворювання мають діти що належать до групи ризику: 1) довгострокові захворювання органів дихання: a) хронічні захворювання легень, що потребують кисневої підтримки; б) муковісцидоз зі значними респіраторним дефіцитом; в) інтерстиціальні хвороби легень у дітей; г) астма тяжкого ступеню; д) нейрогенні респіраторні ускладнення. 2) імуноскомпроментовані стани (захворювання або лікування): a) лікування злоякісного новоутворення; б) первинний імунодефіцит*; в) прийом імуносупресивних препаратів, включаючи тривалий (>28 днів поспіль) щоденний прийом системних кортикостероїдів**; г) пацієнти після трансплантації (органів або стовбурових клітин) ***; д) аспленія (функціональна або хірургічна, включає серпоподібні клітинні захворювання); 3) гемодинамічно значущі вади та/або вади серця за ціанотичним типом; 4) діти до 1 року життя. * Первинний імунодефіцит комбінований імунодефіцит; CD4-лімфопенія (кількість CD4 <200×106/л) в контексті будь-якого іншого імунодефіциту, включаючи ВІЛ; будь-який первинний імунодефіцит, що потребує лікування профілактичними антибіотиками або імуноглобуліном, та прийом імунодепресивних препаратів. **До імуносупресивних препаратів належать: азатіоприн, лефлуномід, метотрексат, мікофенолат (мікофенолат мофетил або мікофенолова кислота), циклоспорин, циклофосфамід, такролімус, сиролімус. Вони НЕ включають гідроксихлорохін або сульфасалазин окремо або в комбінації. Біологічні/моноколональні препарати включають – ритуксимаб протягом останніх 12 місяців; інгібітори фактору некрозу пухлин (етанерцепт, адалімумаб, інфліксимаб, голімумаб, цертолізумаб та біосиміляри зазначених засобів); тоцилізумаб; абатацепт; белімумаб; анакінра; сейкінумаб; іксекізумаб; устекінумаб; сарилумумаб; канакінумаб; інгібітори кінази Януса (JAK) (барацитиніб, тофацитиніб). *** Для пацієнтів, що перенесли трансплантацію: менше ніж 1 рік після пересадки; які досі приймають препарати, що пригнічують імунітет; які знаходяться на замісній терапії імуноглобуліном; мають тяжкі захворювання легень; мають реакцію «трансплантат проти господаря» |
5 днів Тривалість лікування: 5 днів для пацієнтів, які не потребують ШВЛ або ЕКМО. При відсутності ефекту або якщо пацієнт перебуває на ШВЛ або ЕКМО — курс лікування складає 10 днів. |
| або | ||
| Хлорохіну фосфат |
1-й день 16 мг/кг/1 раз, через 12 годин — 7,6 мг/кг, на 2-й — 5-й день по 7,6 мг/кг/добу Протипоказання QTc >500 мсек (ЕКГ перед лікуванням, та раз на день, якщо QTc >450 мсек), тяжка міастенія, порфірія, захворювання сітківки, епілепсія, аміодарон, кларитроміцин, вориконазол (QT!) |
5 днів |
| Тяжкий перебіг | ||
| або | ||
| Лопінавір/ритонавір (розчин) |
від 7 до 15 кг — 12/3 мг/кг 7 — 10 кг — 1,25 мл> 10 кг < 15 кг — 1,75 мл від 15 до 40 кг — 10/2,5 мг/кг 15-20 кг — 2,25 мл |
7 днів |
|
>2 тижнів життя до 6 місяців 16/4 мг/кг (відповідає 0,2 мл/кг), 300/75 мг/м2 (відповідає 3,75 мл/м2) Двічі на добу під час годування |
7 днів | |
| Лопінавір/ритонавір таблетки, капсули | 400 мг/100 мг двічі на добу | 7 днів |
| Тоцилізумаб
Системні кортикостероїди для лікування дітей з підозрюваним або лабораторно підтвердженим COVID-19, що потребують додаткового кисню, госпіталізованих із тяжким або критичним перебігом захворювання. Глюкортикоїди |
Вага <30 кг: 12 мг/кг в/в (розвести до 50 мл фізіологічним розчином і ввести через 1 годину) Вага ≥30 кг: 8 мг/кг в/в (розвести до 100 мл фізіологічним розчином і ввести через 1 годину). Максимальна доза 800 мг на одну інфузію. Дексаметазон 0,15 мг/кг перорально, або внутрішньовенно, або через назогастральний зонд один раз на добу (максимальна доза 6 мг); преднізолон 1 мг/кг перорально, або через назогастральний зонд один раз на добу (максимальная доза 40 мг); метилпреднізолон 0,8 мг/кг внутрішньовенно один раз на добу (максимальна доза 32 мг). Тривалість лікування до 7–10 днів. Моніторинг: контролюйте рівень глюкози, незалежно від того, чи відомо, що у пацієнта цукровий діабет. |
Однократно
Тривалість лікування: до 7–10 днів. |
| При ко–інфекції вірусу грипу | ||
|
Осельтамівір При ко-інфекції вірусу грипу Озельтамівір
|
Діти віком 0–12 місяців — 3 мг/кг двічі на добу Озельтамівір ефективний тільки проти захворювань, спричинених вірусами грипу. Даних щодо ефективності озельтамівіру при будь-яких захворюваннях, спричинених іншими збудниками, крім вірусів грипу, немає. Озельтамівір не можна призначати пацієнтам з COVID-19 за відсутності встановленої супутньої інфекції вірусу грипу. ВУ сезон грипу озельтамівір призначають при підозрі на ко-інфекцію до виключення діагнозу грипу (2-3 дні). Схема дозування для дітей: Ввік 0 – 12 місяців – 3 мг/кг двічі на добу Ввід 10 кг до 15 кг — 30 мг 2 рази на добу > 15 кг до 23 кг — 45 мг 2 рази на добу; Тривалість лікування 5 днів |
5 днів |
2. Терапія моноклональними антитілами у пацієнтів від 18 років з COVID-19
Терапія моноклональними антитілами проводиться в амбулаторному режимі в умовах ЗОЗ, які надають стаціонарну медичну допомогу хворим на гостру респіраторну хворобу COVID-19, за направленням лікаря загальної практики-сімейного лікаря та лікаря — терапевта.
Моноклональні антитіла можуть призначатися пацієнтам із COVID-19 з легким або середнім ступенем захворювання, але з високим ризиком прогресування до тяжкого захворювання.
Показання для застосування:
Комбінацію препаратів бамланівімаб та етесевімаб слід вводити разом якомога швидше протягом до 5 днів від початку симптомів у пацієнтів, які мають високий ризик прогресування до тяжкого перебігу COVID-19.
Комбінація моноклональних антитіл бамланівімаб та етесевімаб не призначається пацієнтам, які потребують госпіталізації, або знаходяться на лікуванні у стаціонарі.
Медичні працівники повинні враховувати співвідношення “користь-ризик” для кожного окремого пацієнта.
Фактори підвищеного ризику прогресування до тяжкого COVID-19:
старший вік (вік ≥65 років);
надмірна вага (дорослі з ІМТ>25 кг/м2) ;
вагітність;
хронічна хвороба нирок;
цукровий діабет;
вторинний імунодефіцит уточнений (імуносупресивна терапія); первинні імунодефіцити;
серцево-судинні захворювання (включаючи вроджені вади серця) або гіпертонію;
хронічні захворювання легень (наприклад, хронічна обструктивна хвороба легень, астма (від помірної до тяжкої), інтерстиціальна хвороба легень, муковісцидоз та легенева гіпертензія);
серповидноклітинна анемія;
стани, обумовлені порушенням розвитку нервової системи (наприклад, церебральний параліч) або інші стани, що вважаються складними (наприклад, генетичні або метаболічні синдроми та тяжкі вроджені аномалії);
наявність медичної технологічної залежності (наприклад, трахеостомія, гастростомія або вентиляція з позитивним тиском (не пов’язана з COVID-19)).
Дозування
Доза бамланівімабу та етесевімабу для лікування легкого та помірного COVID-19 у дорослих становить:
бамланівімаб 700 мг;
етесевімаб 1400 мг.
Бамланівімаб та етесевімаб необхідно розводити та вводити разом у вигляді одноразової внутрішньовенної інфузії.
Корекція дози для специфічних груп населення
Вагітність або лактація:
Не рекомендується коригувати дозування для вагітних або годуючих жінок
Геріатричне використання (використання у людей похилого віку):
Не рекомендується коригувати дозування для геріатричних пацієнтів (пацієнтів похилого віку)
Порушення функції нирок:
Пацієнтам з нирковою недостатністю не рекомендується коригувати дозу Печінкова недостатність:
Не рекомендується коригувати дозу пацієнтам з легкою печінковою недостатністю. Застосвання бамланівімабу та етесевімабу не досліджувались у пацієнтів з помірною або тяжкою печінковою недостатністю.
Організація проведення і підготовка до проведення інфузії
Процедура введення бамланівімабу та етесевімабу повинна проводитись у спеціально обладнаному приміщенні. Розчин для інфузії бамланівімабу та етесевімабу повинен готувати кваліфікований медичний працівник, використовуючи асептичну техніку. Інфузія повинна проводитись згідно інструкції, з регламентованою швидкістю і часом ( див. Таблиця 1, 2).
Таблиця 1: Рекомендовані інструкції з розведення та введення бамланівімабу та етесевімабу для внутрішньовенної інфузії у пацієнтів з масою тіла 50 кг або більше
| Додайте 20 мл бамланівімабу (1 флакон) та 40 мл етесевімабу (2 флакони) загальною кількістю 60 мл у попередньо наповнений мішок для інфузій та введіть, як зазначено нижче | ||
| Розмір мішка для інфузій, попередньо заповненого розчином натрію хлориду 0,9% | Максимальна швидкість інфузії | Мінімальний час інфузії |
| 50 мл | 310 мл/год | 21 хвилина |
| 100 мл | 310 мл/год | 31 хвилина |
| 150 мл | 310 мл/год | 41 хвилина |
| 250 мл | 310 мл/год | 60 хвилин |
Таблиця 2: Рекомендовані інструкції з розведення та введення бамланівімабу та етесевімабу для внутрішньовенної інфузії у пацієнтів з масою тіла менше 50 кг
| Розмір мішка для інфузій, попередньо заповненого розчином натрію хлориду 0,9% | Максимальна швидкість інфузії | Мінімальний час інфузії |
| 50 мл | 310 мл/год | 21 хвилина |
| 100 мл | 310 мл/год | 31 хвилина |
| 150 мл | 310 мл/год | 41 хвилина |
| 250 мл[1] | 266 мл/год | 70 хвилин |
Протипоказання для введення комбінації бамланівімабу та етесевімабу відсутні, але можливі реакції гіперчутливості, що можуть потребувати невідкладної допомоги.
Ці реакції можуть спостерігатися під час інфузії та до 24 годин, після закінчення інфузії.
Ознаки та симптоми реакцій, пов’язаних з інфузією, можуть включати наступне:
лихоманка, утруднене дихання, зниження насичення киснем, озноб, втома, аритмія (наприклад, фібриляція передсердь, синусова тахікардія, брадикардія), біль або дискомфорт у грудях, слабкість, зміна психічного стану, нудота, головний біль, бронхоспазм, гіпотензія, гіпертонія, ангіоневротичний набряк, подразнення горла, висип, включаючи кропив’янку, свербіж, міалгію, вазовагальні реакції (наприклад, пресинкопальний стан, непритомність), запаморочення та потовиділення.
Моніторинг пацієнтів
Необхідно клінічно слідкувати за пацієнтами під час введення препаратів та спостерігати за пацієнтами протягом щонайменше 1 години після завершення інфузії.
3.2. Антикоагулянтна терапія у пацієнтів з COVID-19
У пацієнтів хворих на коронавірусну хворобу, часто виникають тромботичні ускладнення як венозного, так і артеріального кровообігу, що зумовлене надмірним запаленням, активацією тромбоцитів, ендотеліальною дисфункцією та застоєм крові.
Низькомолекулярні гепарини (НМГ) є препаратами вибору для фармакологічної тромбопрофілактики у хворих пацієнтів, які мають фактори високого ризику розвитку венозних тромботичних ускладнень, за винятком пацієнтів з вираженою дисфункцією нирок (для яких нефракціонований гепарин може розглядатися на основі ретельної оцінки ризик/користь) та у пацієнтів гепарин-індукованою тромбоцитопенією в анамнезі. У таких пацієнтів фондапаринукс (2,5 мг 1 раз підшкірно) розглядається як альтернативне лікування.
Рекомендовано використовувати два різні схематичні алгоритми:
1) Аантикоагулянтна терапія госпіталізованих пацієнтів із COVID-19 та після виписки;
2) Аантикоагулянтна терапія у негоспіталізованих пацієнтів із COVID-19.
1) Аантикоагулянтна терапія госпіталізованих пацієнтів із COVID-19 та після їх виписки
Дане призначення є корисним для більшості пацієнтів, проте у пацієнтів з високим ризиком кровотечі (наприклад, при низькому рівні тромбоцитів, недавніх великих кровотечах, діалізі тощо) ризики та переваги тромбопрофілактики слід зважувати в індивідуальному порядку.
Ризики та переваги тромбопрофілактики оцінюються в індивідуальному порядку Дане призначення є корисним для більшості пацієнтів, проте у пацієнтів з високим ризиком урахуванням високого ризику кровотечі (наприклад, при низькому рівні тромбоцитів, недавніх великих кровотечах, гемодіалізі тощо) ризики та переваги тромбопрофілактики слід зважувати в індивідуальному порядку.
При надходженні пацієнта в заклад охорони здоров’я лікарню:до закладу охорони здоров’я:
Необхідно врахувати можливістьНаголошується на важливості врахування можливості венозних тромбоемболій при діагностиці та протягом усього періоду госпіталізації, а для пацієнтів з високим ризиком венозної тромбоемболії – протягом 4-6 тижнів.
Пацієнтам з раніше призначеною терапевтичною антикоагулянтною терапієюпопереднім показанням до терапевтичної антикоагулянтної терапії слід продовжувати отримувати терапевтичну антикоагулянтну терапію. Перехід на терапевтичну дозу низькомолекулярних гепаринів замість пероральної антикоагулянтної терапії (антагоністи вітаміну К або прямі пероральні антикоагулянти) слід розглядати у таких випадках: для тяжкохворих пацієнтів, пацієнтів із шлунково-кишковими захворюваннями, для пацієнтів із запланованими інвазивними процедурами, пацієнтів із нестабільним міжнародним нормалізованим відношеннямнестабільними міжнародними нормалізованими відношеннями (МНВ) та/або при наявності взаємодій між лікарськими засобами.
Розгляньте призначення профілактичної антикоагулянтної терапіїРекомендується призначати профілактичну антикоагулянтну терапію низькомолекулярними гепаринами пацієнтам, які не мають попередніх показань до антикоагулянтної терапії або мають ризик венозних тромбоемболій при діагностиці за шкалою Падуа ≥4.
Таблиця 3. Оцінка ризику розвитку венозної тромбоемболії за шкалою Падуа
| Фактор ризику | Бали |
| Активний перебіг онкологічних захворювань (локальні або віддалені метастази та/або хіміотерапія або радіотерапія впродовж останніх 6 міс) | 3 |
| Венозна тромбоемболія в анамнезі (за винятком тромбозу поверхневих вен) | 3 |
|
Обмежена рухливість (ліжковий режим протягом ≥ 3 діб з можливістю здійснювати гігієнічні процедури в туалетній кімнаті) через наявні у пацієнта обмеження або за приписом лікаря Відома тромбофілія (дефекти антитромбіну, протеїну С або S, фактора V Лейден, мутація протромбіну G20210A, антифосфоліпідний синдром) |
3 |
|
Відома тромбофілія (дефекти антитромбіну, протеїну С або S, фактора V Лейден, мутація протромбіну G20210A, антифосфоліпідний синдром) |
3 |
| Травма та/або операція ≤1 міс назад | 2
3 |
| Вік ≥70 років | 1
2 |
| Серцева та/або дихальна недостатність | 1 |
| Гострий інфаркт міокарда або ішемічний інсульт | 1 |
| Гостре інфекційне та/або ревматологічне захворювання | 1 |
| Ожиріння (індекс маси тіла ≥30 кг/м2) | 1 |
| Застосування гормональної терапії | 1 |
| Загальна оцінка факторів ризику (сума балів) | 1 |
Сума балів ≥4 вказує на високий ризик венозної тромбоемболії та необхідність призначення фармакологічної тромбопрофілактики
Режим антикоагулянтної терапії у пацієнтів з попереднім показанням до терапевтичної антикоагулянтної терапії:
Для пацієнтів із попереднім показанням до терапевтичної антикоагулянтної терапії (наприклад, фібриляція передсердь, венозна тромбоемболія, штучний клапан серця тощо) рекомендовано продовжити антикоагулянтну терапію в терапевтичній дозі. Якщо пероральна антикоагулянтна терапія переходить на парентеральну, рекомендовано терапевтична доза низькомолекулярних гепаринів 100 МО анти-Ха/кг двічі на добу у пацієнтів з високим ризиком тромботичного ускладнення (штучний клапан серця, недавні венозна тромбоемболія або тромбофілія високого ризику, фібриляція передсердь з попереднім інсультом або з високим балом за шкалою CHADS-VASc). У пацієнтів із меншим ризиком захворювання тромботичні ускладнення або терапевтичні дози, або високі проміжні дози низькомолекулярних гепаринів можна вважати виходячи з тяжкості захворювання та ризику кровотечі.
Антикоагулянтна терапія для тромбопрофілактики у госпіталізованих пацієнтів із COVID-19:
Для пацієнтів, які не перебувають у відділеннях інтенсивної терапії, рекомендується профілактична доза еноксапарину 4000 анти-Ха MO (40 мг; 0,4 мл) один раз на добу за умови кліренсу креатиніну >30 мл/хв. При кліренсі креатиніну від 15 до 30 мл/хв дозу слід НМГ зменшити вдвічі – 2000 анти-Ха (20 мг; 0,2 мл) один раз на добу.
Для пацієнтів, які перебувають у відділеннях інтенсивної терапії, рекомендуються високі профілактичні дози НМГ – еноксапарин 4000 анти-Ха MO (40 мг; 0,4 мл) двічі на добу для пацієнтів з кліренсом креатиніну >30 мл/хв. Для пацієнтів з кліренсом креатиніну від 15 до 30 мл/хв пропонується використовувати зменшену дозу НМГ – еноксапарин 4000 анти-Ха MO (40 мг; 0,4 мл) один раз на добу. У разі вираженої ниркової дисфункції (кліренс креатинину <15 мл/хв) слід розглянути питання про застосування нефракціонованого гепарину (НФГ) 5000 ОД підшкірно 2-3 рази на добу.
Дозування інших низькомолекулярних гепаринів, які зареєстровані в Україні, а саме надропарину, далтепарину та беміпарину, слід визначати відповідно до інструкції для медичного застосування.
Рекомендується обмежувати терапевтичну антикоагулянтну терапію пацієнтам із попереднім показанням до неї або пацієнтам із венозною тромбоемболією. Терапевтична антикоагулянтна терапія у пацієнтів із COVID-19 може бути пов’язана з покращенням результатів у окремих тяжкохворих пацієнтів, особливо у пацієнтів, що знаходяться на ШВЛ, але ця інформація повинна бути зважена із ризиками кровотечі. Тому рекомендується обмежити використання терапевтичної антикоагулянтної терапії у пацієнтів без чітких показань.
У пацієнтів з високим ризиком кровотечі (наприклад, при низькому рівні тромбоцитів, недавніх великих кровотечах, гемодіалізідіалізі тощо) ризики та переваги тромбопрофілактики слід зважувати в індивідуальному порядку.
Протипоказання до медикаментозної профілактики венозної тромбоемболії:
У випадку протипоказань до медикаментозної профілактики венозної тромбоемболії, слід застосовувати механічні заходи профілактики (переміжна пневматична компресія нижніх кінцівок)
- Кількість тромбоцитів <50х109/л
- Високий ризик кровотечі
- Травма з високим ризиком кровотечі
- Активна кровотеча
- Гепарин-індукована тромбоцитопенія
- Геморагічний інсульт
- Гострий бактеріальний ендокардит
- Нестабільна артеріальна гіпертензія: систолічний тиск вище за 180 або діастолічний тиск вище 110 мм рт.ст.
- Печінкова недостатність
Режим антикоагулянтної терапії для лікування венозної тромбоемболії, пов’язаної з COVID‐19:
Пацієнтам, у яких розвивається венозна тромбоемболія під час госпіталізації з діагнозом COVID-19, рекомендується лікування терапевтичними дозами низькомолекулярних гепаринів (100 МО анти-Ха/кг двічі на добу). У пацієнтів з кліренсом креатиніну (КК) <30 мл/хв слід враховувати терапевтичну регульовану дозу низькомолекулярних гепаринів. Пацієнтам з ККкліренсом креатиніну (КК) <15 мл/хв рекомендується використовувати нефракціонованого гепарину (НФГ), якщо є достатній досвід його застосування.
D-димер
Не рекомендується регулярно адаптувати режим антикоагулянтної терапії на основі рівнів D-димеру, оскільки результати можуть змінюватися залежно від використовуваного аналізу. Однак підвищення рівня D-димеру може вказувати на розвиток венозної тромбоемболії і може коригувати рішення стосовно проведення візуалізації венозної тромбоемболії.
Скринінг на венозну тромбоемболію
Систематичний скринінг на венозні тромбоемболії у пацієнтів із COVID-19 не рекомендується, але слід підвищити рівень обізнаності щодо можливого розвитку венозної тромбоемболії під час госпіталізації (звертайте увагу на такі клінічні ознаки, як припухлість нижньої кінцівки, гіпоксемія, непропорційна дихальному стану, гостра правошлуночкова недостатність або розширення правого шлуночка за даними ультразвукового дослідження, проблеми з катетером тощо), судоми у нижніх кінцівках (особливо вночі можуть бути внаслідок тромбозу глибоких вен).
- Візуалізація повинна бути виконана у всіх випадках з підозрою на венозну тромбоемболію. У разі клінічно подібного, але непідтвердженого діагнозу, антикоагулянтна терапія може розглядатися, особливо в відділенні інтенсивної терапії.
Моніторинг анти-Ха
Не рекомендується проводити систематичний моніторинг антикоагулянтної терапії за допомогою визначення рівнів анти-Xa (окрім випадків застосування низькомолекулярних гепаринів в лікувальних дозах). Однак поЗа можливості пропонується провести визначення анти-Xa при підозрі на накопичення низькомолекулярних гепаринів (і, відповідно, при підвищеному ризику виникнення кровотечі) за таких обставин: у пацієнтів з низькою або надмірною вагою тіла (індекс маси тіла <18 або індекс маси тіла >30 кг/м2) або нирковою недостатністю (зниження КК <60 мл/хв) або у пацієнтів з геморагічним діатезом.
Антикоагулянтна терапія після виписки з лікарні із закладу охорони здоров’я
Рекомендовано продовжувати антикоагулянтну терапію після виписки з лікарні із закладу охорони здоров’я:
- уУ пацієнтів з попередніми показаннями до терапевтичної антикоагулянтної терапії рекомендується повернутися до початкової пероральної антикоагулянтної терапії і режиму її застосування.
- пПацієнтам, у яких розвинулася венозна тромбоемболія в період госпіталізації, рекомендується продовжувати терапію низькомолекулярними гепаринами під амбулаторним контролем. Перехід на оральну терапію, наприклад прямі пероральні антикоагулянти (DOAC) можна розглядати тільки у окремих пацієнтів, які знаходяться в задовільному загальному стані і у яких більше немає симптомів COVID-19. Тривалість терапевтичної антикоагулянтної терапії повинна становити не менше трьох місяців (зазвичай).
- уУ пацієнтів без попередніх показань до терапевтичної антикоагулянтної терапії, які отримували тромбопрофілактику під час госпіталізації, пропонується продовжити тромбопрофілактику в дозі (для еноксапарину) 4000 анти-Ха MO один раз на добу протягом двох тижнів. Якщо присутні додаткові чинники ризику для венозних тромбозів та емболій (тобто перебування у відділенні інтенсивної терапії, тромбофілія в анамнезі, ожиріння, куріння, використання високих доз естрогену, іммобілізація, серцева недостатність, дихальна недостатність, вік >70 років, активний перебіг раку, особистий або сімейний анамнез венозної тромбоемболії та/або серйозна операція за останні 3 місяці) пропонується розширена тромбопрофілактика протягом 4-6 тижнів після виписки. Це продовження тромбопрофілактики слід обговорювати відповідно до балансу ризик-користь (ризик кровотечі та інші фактори ризику).
Щоб обмежити контакт з працівниками охорони здоров’я, коли пацієнти повертаються додому, можна розглянути можливість переходу з низькомолекулярних гепаринів на прямі пероральні антикоагулянти (DOAC), якщо пацієнт потребує терапевтичної антикоагулянтної терапії, пероральний прийом можливий і не має порушення функції нирок (ШКФ>15 мл/хв/1,73м2)..
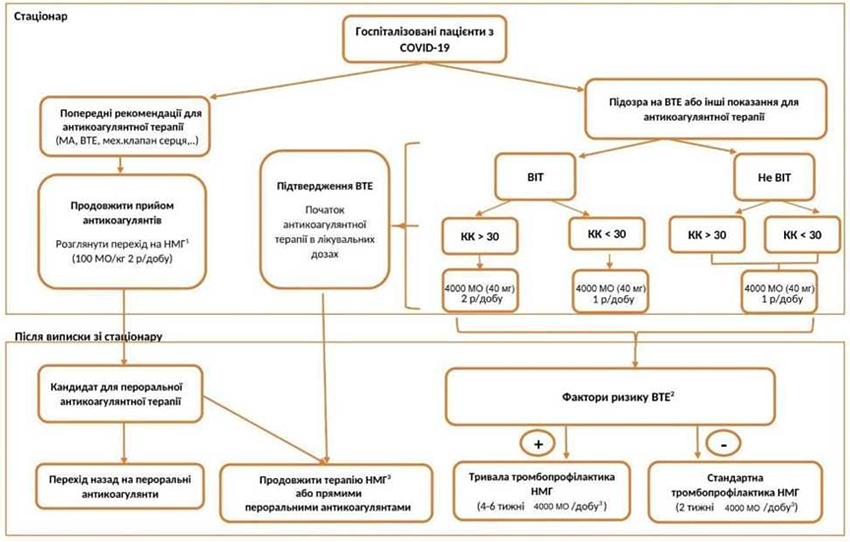
(1) Розгляньте можливість переходу на НМГ при таких умовах: тяжкохворий пацієнт, симптоми зі сторони ШКТ, заплановані інвазивні процедури, нестабільний МНВ та/або наявність взаємодії лікарських препаратів.
(2) перебування в стаціонарному відділенні, тромбофілія, ожиріння, іммобілізація, серцева недостатність, дихальна недостатність, вік >70 років, особистий або сімейний анамнез венозної тромбоемболії, активний перебіг раку та/або велика хірургічна операція за останні 3 місяці
(3) Якщо можливо (прихильність, відповідальний прийом пероральних препаратів тощо), розгляньте лікування прямими пероральними антикоагулянтами або самостійне введення низькомолекулярних гепаринів.
Скорочення:
МА – миготлива аритмія (фібриляція передсердь);
ВТЕ – венозна тромбоемболія;
ВIТ – відділення інтенсивної терапії;
КК – кліренс креатиніну;
НМГ – низькомолекулярні гепарини;
ШКТ – шлунково-кишковий тракт;
МНВ – міжнародне нормалізоване відношення.
*Примітка: дозування інших НМГ надропарин, далтепарин та беміпарин, які зареєстровані в Україні, слід визначати відповідно до інструкції для медичного застосування.
2) Антикоагулянтна терапія у негоспіталізованих пацієнтів з COVID-19
Ризики та переваги тромбопрофілактики оцінюються в індивідуальному порядку Дане призначення є корисним для більшості пацієнтів, проте у пацієнтів з високим ризиком урахуванням високого ризику кровотечі (наприклад, при низькому рівні тромбоцитів, недавніх великих кровотечах, гемодіалізі тощо) недавні великі кровотечі, діаліз тощо) ризики та переваги тромбопрофілактики слід зважувати в індивідуальному порядку.
Дане призначення є корисним для більшості пацієнтів, проте у пацієнтів з високим ризиком кровотечі (наприклад, при низькому рівні тромбоцитів, недавні великі кровотечі, діаліз тощо) ризики та переваги тромбопрофілактики слід зважувати в індивідуальному порядку.
Загальні положення
Якщо стан пацієнта дозволяє, слід стимулювати розширення активності для зниження ризику венозної тромбоемболії.
- Знати про ознаки та симптоми венозної тромбоемболії.
- У разі підозри на венозну тромбоемболію пацієнт повинен бути направлений на відповідне діагностичне тестування. У період очікування результатів діагностичного тестування можна починати терапевтичну антикоагулянтну терапію, якщо клінічна підозра є великою, а ризик кровотечі – низьким.
- Якщо низькомолекулярні гепарини потрібно приймати вдома, слід заохочувати самостійне його застосування пацієнтами, щоб уникнути контакту з працівниками охорони здоров’я.
Пацієнти, які отримують постійну антикоагулянтну терапію:
У всіх випадках антикоагулянтна терапія повинна бути продовжена (якщо це не протипоказано).
- У пацієнтів, що постійно приймають антагоністи вітаміну К, рекомендовано не змінювати стандарт медичної допомоги, за умови, що пацієнт може продовжувати пероральний прийом і має стабільне міжнародне нормалізоване відношення (МНВ).
- У пацієнтів, що постійно приймають прямі пероральні антикоагулянти або низькомолекулярні гепарини, слід розглядати контроль функції нирок у пацієнтів з супутньою хронічною хворобою нирокнирковою недостатністю або у пацієнтів з високою температурою, шлунково-кишковими симптомами та/або зменшенням дози препарату.
Пацієнти з невстановленою венозною тромбоемболією або іншими показаннями для профілактичної антикоагулянтної терапії:
У пацієнтів з підтвердженою інфекцією SARS-CoV-2, які не мають симптомів або мають незначні симптоми, рекомендовано не проводити профілактичну антикоагулянтну терапію.
- Тривалість профілактики у негоспіталізованих пацієнтів (якщо постійна антикоагулянтна терапія не потребується) рекомендується протягом 14 днів. Через 14 днів необхідність в пролонгації профілактичного лікування повинна бути переглянута.
Антикоагулянтна терапія під час вагітності та в післяпологовому періоді у жінок з COVID-19
- Підкреслюється, що ці вказівки не змінюють стандартного антикоагулянтного режиму під час вагітності та після пологів. Вагітність не змінює загальних рекомендацій.
Негоспіталізовані жінки:
- У вагітних з підтвердженою інфекцією SARS-CoV-2 / COVID-19 без важких симптомів не застосовувати тромбопрофілактику, якщо не призначено інше.
- Вагітним з вираженими симптомами COVID-19 (висока температура, іммобілізація тощо) призначається тромбопрофілактика.
Госпіталізовані жінки:
Для госпіталізованих безсимптомних пацієнтів із COVID-19 проводиться стандартна оцінка ризику для тромбопрофілактики в акушерстві. Таку оцінку повторюють при необхідності.
- Для госпіталізованих, які мають симптоматичний перебіг COVID-19, проводиться тромбопрофілактика (якщо вона не протипоказана).
- Якщо підтверджено венозну тромбоемболію, лікування антикоагулянтами (НМГ під час вагітності) продовжують протягом 6 тижнів після пологів та протягом мінімум 3 місяці.
- Профілактику венозних тромбоемболій розглядають у породіль з COVID-19 на основі індивідуальної оцінки ризику.
- Якщо передпологова медикаментозна профілактика не проводилась, післяпологова профілактика не проводиться за відсутності або помірних симптомів, пологи неускладнені та відсутні акушерські показання для післяпологової профілактики венозних тромбоемболій.
- Якщо проводилась передпологова профілактика у зв’язку з COVID-19, продовжуйте профілактику протягом 14 днів. Через 14 днів потребу в антикоагулянтній терапії слід повторно оцінити відповідно до співвідношення ризик-користь (тяжкості зараження COVID-19 та інших факторів ризику).
Антикоагулянтна терапія при COVID‐19 у дітей
Антикоагулянтна терапія у дітей при лікуванні COVID‐19 має наступні особливості:
- Всі діти, які госпіталізовані для лікування інфекції SARS-CoV-2 проходять обстеження при поступленні, а потім щоденно на можливість ризику тромбозів.
- Рекомендується при госпіталізації з наступними моніторингом зробити загальний аналіз крові з підрахунком тромбоцитів, фибриногеном, протромбіновим часом, D-димером.
- Всім пацієнтам з інфекцією SARS-CoV-2, що мають ризик тромбозу, починати за необхідності профілактику.
- Рішення про початок антикоагулянтноїтромболітичної терапії у дитини приймається комісійно за участі фахівців з інтенсивної терапії, гематологів та дитячих інфекціоністів.
- При наявності показань до тромболітичної терапії рекомендується низькомолекулярний гепарин або нефракційний гепарин, враховуючи наявний досвід по застосуванню препаратів гепарину у дітей.
- Не рекомендується застосування пероральних антикоагулянтів прямої дії із-за обмежених даних щодо їх застосування у дітей при COVID‐19.
- Терапевтична антикоагулянтна терапія рекомендується пацієнтам, що отримували її перед госпіталізацією, гемодинамічно нестабільною тромбоемболією легеневої артерії або загрозою тромбозом глибоких вен кінцівок або пацієнтам з підозрою на венозну тромбоемболію
- Призначення антикоагулянтів дітям повинно бути персоніфіковане.
Цільова популяція пацієнтів для проведення антитромботичної профілактики
Пацієнти у віці до 18 років, що госпіталізовані з діагнозом COVID-19, та мають два або більше з наступних критеріїв:
а) госпіталізація у відділення інтенсивної терапії;
б) діагностований мультисистемний запальний синдром (MIS-C);
в) наявність факторів ризику венозної тромбоемболії (ВТЕ):
Фактори ризику тромбозу у дітей:
- тТромбофілія або венозна тромбоемболія в анамнезі=;
- нНаявність венозної тромбоемболії у родичів першої лінії=;
- пПубертатний вік;
- оОпіки;
- аАктивне онкогематологічне захворювання;
- оОзнаки венозного застою або серцевої недостатності;
- нефротичний синдром;
- тТерапія естрогенами;
- аАктивна системна інфекція;
- Загострення хронічного захворювання
- цукровий діабет;
- оОжиріння;
- сСильне зневоднення;
- нНещодавня операція або травма;
- аАвтоімунні захворювання;
- аАнтифосфоліпідний синдром;
- серповидноклітинна анемія;
- тТривала імобілізація пацієнта (проведення неінвазивної або інвазивної вентиляції легень);
- нНаявність внутрішньовенних катетерів;
- значне підвищення рівня D-димеру в плазмі (в ≥5 разів перевищення верхньої межі референтних значень).
Лабораторний моніторинг:
під час госпіталізації та з подальшим лабораторним контролем рекомендований загальний аналіз крові з підрахунком тромбоцитів, фібриногеном, протромбіновим часом, активованим частковим тромбопластиновим часом (АЧТЧ) та D-димером.
Профілактична антикоагулянтна терапія:
1. Низькомолекулярний гепарин (наприклад, еноксапарин) застосовують у пацієнтів, які перебувають у клінічно стабільному стані (наприклад, без порушення гемодинаміки, ниркової недостатності або значущого ризику кровотечі).
Профілактичні дози еноксапарину:
для дітей віком <2 місяці: 0,75 мг/кг 2 рази на добу підшкірно;
для дітей віком від 2 місяців до 18 років: 0,5 мг/кг 2 рази на добу підшкірно.
Скоректуйте дозу для досягнення рівня активності анти-Ха від 0,2 до <0,5 одиниць/мл через 4 години після введення дози.
2. Нефракціонований гепарин (НФГ) застосовують у пацієнтів, які перебувають у клінічно нестабільному стані (наприклад, із порушенням гемодинаміки, нирковою недостатністю або високим ризиком кровотечі). Пацієнтів, які переходять у нестабільний стан під час лікування НМГ, слід перевести на профілактичну дозу НФГ.
Дозування гепарину відповідно до інструкції для медичного застосування.
3. Прямі пероральні антикоагулянти (DOAC) (наприклад, ривароксабан та апіксабан) не рекомендуються для профілактики ВТЕ в умовах стаціонарного лікування через можливість взаємодії з лікарськими засобами, що використовуються для лікування SARS-CoV-2 (включаючи дексаметазон), та обмеженість даних щодо їх застосування у дітей при COVID-19.
4. Антиагрегантні засоби не рекомендуються для профілактики ВТЕ у пацієнтів з SARS-CoV-2.
Профілактична антикоагулянтна терапія після виписки може розглядатися у дітей з факторами ризику розвитку ВТЕ, що мають підвищений рівень D-димеру. За наявності показань рекомендується НМГ у дозах, що зазначені вище. Тривалість профілактичної антикоагулянтної терапії залежить від динаміки стану пацієнта або протягом 30 днів після виписки за відсутності протипоказань або підвищеного ризику кровотеч.
Терапевтична антикоагулянтна терапія:
У пацієнтів з дуже високим ризиком розвитку ВТЕ/мікросудинного тромбозу розгляньте підвищення дози НМГ до терапевтичної.
До пацієнтів з дуже високим ризиком належать:
- пацієнти, які отримували антикоагулянтну терапію до госпіталізації;
- пацієнти з високо підозрюваною або діагностованою ВТЕ;
- пацієнти з високим рівнем D-димеру;
- пацієнти з порушеними параметрами згортання, включаючи пролонгований протромбіновий час, пролонгований АЧТЧ, або знижений фібриноген;
- пацієнти із значуще підвищеними маркерами запалення; та/або з поліорганною недостатністю.
2.4.3. Рання підтримуюча терапія за наявності тяжкої гострої респіраторної інфекції (ТГРІ)
Слід ініціювати кисневу терапію починаючи з 5 л/хв та регулювати швидкість потоку до досягнення цільового рівня SpO2 ≥93% у невагітних дорослих та SpO2 ≥92-95% у вагітних пацієнток. Діти з екстреними ознаками (утруднене чи відсутнє дихання, гострий респіраторний дистрес-синдром, центральний ціаноз, шок, кома або судоми) повинні отримувати кисневу терапію під час реанімаційних заходів до досягнення SpO2 ≥94%; в іншому випадку цільовий SpO2 становить ≥90%. Необхідно використовувати контактні заходи безпеки при роботі із забрудненими кисневими інтерфейсами пацієнтів із COVID-19.
Пацієнтам в тяжкому стані без ознак шоку слід обережно вводити рідини внутрішньовенно (рестриктивна стратегія інфузійної терапії), оскільки швидке введення рідини може погіршити оксигенацію, особливо в умовах обмеженого доступу до механічної вентиляції.
3.5.4. АнтибактеріальнаПротимікробна терапія бактеріальної ко-інфекції та суперінфекції у пацієнтів з COVID-19
Протимікробні препарати не діють на вірус, тому протимікробна терапія повинна застосовуватися у хворих з COVID-19 тільки за наявності підтвердженої бактеріальної ко-інфекції (тобто після отримання результатів позитивного бактеріологічного аналізу крові та/або мокротиння). Але враховуючи те, що результатів аналізу треба чекати кілька днів, антибіотики, за певних показань, можуть призначатися емпірично.
Показанням до емпіричної протимікробної терапії у хворих з COVID-19 є приєднання бактеріальної ко-інфекції (бактеріальна пневмонія, сепсис, септичний шок, інфекція сечовивідних шляхів тощо). Бактеріальна ко-інфекція спостерігається менш ніж у 10% пацієнтів з COVID-19. Пацієнти, які перебувають в палатах інтенсивної терапії, мають вищу ймовірність бактеріальної інфекції порівняно з пацієнтами в інших відділеннях.
Антибактеріальні лікарські засоби для системного застосування (ATC J01) не діють на віруси, тому антибактеріальна терапія повинна застосовуватися у хворих з COVID-19 тільки за наявності обґрунтованої підозри на наявність чи підтвердженої бактеріальної ко-інфекції та/або суперінфекції.
Показанням до емпіричної антибактеріальної терапії у хворих з COVID-19 є приєднання бактеріальної ко-інфекції та/або суперінфекція (бактеріальна негоспітальна пневмонія, вентилятор-асоційована пневмонія, інфекція сечовивідних шляхів, сепсис, септичний шок тощо). Бактеріальна коінфекція та/або суперінфекція спостерігається менш ніж у 8–10% пацієнтів з COVID-19. Пацієнти, які перебувають в палатах інтенсивної терапії, мають вищу ймовірність бактеріальної ко-інфекції та/або суперінфекції порівняно з пацієнтами в інших відділеннях.
Слід зауважити, що недоцільне застосування антибактеріальних препаратів може призвести до розвитку бактеріальної резистентності та інфекції Clostridioides difficile.
Варто зауважити, що недоцільне застосування протимікробних препаратів може призвести до розвитку бактеріальної резистентності та інфекції Clostridioides difficile.
Рекомендовано:
1. Пацієнтам з підозрюваним чи підтвердженим COVID-19 з легким перебігом заборонено призначати антибактеріальні препарати з профілактичною метою. В переважній більшості випадків призначення антибактеріальних препаратів амбулаторним пацієнтам є недоцільним.
2. Пацієнтам з підозрюваним чи підтвердженим COVID-19 з середньотяжким перебігом заборонено призначати антибактеріальні препарати без обґрунтованої клінічної підозри або підтвердження наявності бактеріальної інфекції.
3. Пацієнтам з підозрюваним чи підтвердженим COVID-19 з тяжким перебігом призначення антибактеріальних препаратів за наступних умов:
1) підозрюваний чи встановлений клінічний діагноз (наприклад, негоспітальна чи госпітальна бактеріальна пневмонія/сепсис);
2) оцінка індивідуального ризику розвитку бактеріальної ко-інфекції та/або суперінфекції.
Для прийняття рішення про початок антибактеріальної терапії необхідно враховувати комплекс результатів наступних лабораторних та інструментальних методів дослідження:
- загальний аналіз крові;
- бактеріологічне дослідження мокротиння та/або трахеального аспірату та/або бронхо-альвеолярного лаважу та/або крові та/або сечі та/або ліквору.
Визначення рівня прокальцитоніну є корисним для встановлення бактеріальної інфекції. Надзвичайно високі рівні прокальцитоніну у плазмі крові пацієнтів сильно корелюють зі збільшенням ймовірності бактеріальної інфекції, але найбільш прийнятний мінімальний поріг концентрації прокальцитоніну для розрізнення бактеріальної та вірусної інфекції не було встановлено.
Високий рівень C-реактивного білку не має використовуватись у якості обґрунтування призначення антибактеріальної терапії, оскільки пацієнти з COVID-19 можуть мати високі рівні C-реактивного білку при відсутності бактеріальної інфекції.
Емпіричну антибактеріальну терапію слід розпочинати тільки при наявності комплексної обґрунтованої клінічної підозри на наявність бактеріальної інфекції.
При встановленні діагнозу бактеріальної пневмонії необхідно якнайшвидше розпочати антибактеріальну терапію в межах перших 4 годин.
При встановленні діагнозу сепсису та/або септичного шоку та/або при наявності критеріїв високого ризику, необхідно якнайшвидше розпочати антибактеріальну терапію в межах першої години після встановлення діагнозу.
При призначенні антибактеріальних препаратів необхідно враховувати дані локальної чутливості мікроорганізмів у закладі охорони здоров’я.
Слід проводити оцінку розпочатої антибактеріальної терапії через 72 години та розпочинати деескалацію (зміна антибактеріального препарату з широким спектром дії на інший антибактеріальний препарат, що має вузький спектр дії та/або перехід з комбінованого використання антибактеріальних препаратів на введення одного антибактеріального препарату), із врахуванням тяжкості загального стану пацієнта і результатів мікробіологічних досліджень.
Вибір антибактеріальної терапії має бути спрямованим на етіологічний чинник і, за можливості, передбачати перехід з парентеральної форми введення на пероральну. Тривалість емпіричної антибактеріальної терапії має бути скорочена до мінімально прийнятного терміну (3-7 днів), з наступним призначенням етіологічно спрямованої антибактеріальної терапії після отримання результатів бактеріологічного дослідження та з врахуванням динаміки клінічного стану пацієнта.
Розпочату емпіричну антибактеріальну терапію слід припинити за наявності сукупності таких критеріїв:
1) якщо через 48–96 год не виявлено ознак бактеріального росту при дослідженні зразків біологічних рідин за умови, що зразки для проведення бактеріологічних досліджень були взяті до початку антибактеріального лікування;
2) якщо не було виявлено вогнища бактеріальної інфекції;
3) якщо протягом 48–72 год відсутні клінічні ознаки бактеріальної інфекції.
1. При підозрі чи підтвердженій інфекції COVID-19 з легким перебігом не призначати антибіотики в лікувальних або профілактичних цілях. В переважній більшості випадків призначення антибактеріальних препаратів амбулаторним пацієнтам є недоцільним.
2. При підозрі чи підтвердженій інфекції COVID-19 із середньотяжким перебігом не призначати антибіотики без наявності клінічної підозри на бактеріальну інфекцію.
3. При підозрі чи підтвердженій інфекції COVID-19 з тяжким перебігом призначати антибактеріальні препарати в якості емпіричної терапії проти всіх можливих патогенів на підставі клінічного діагнозу (наприклад, негоспітальна або госпітальна пневмонія), епідеміологічних даних та регіональних/місцевих даних щодо бактеріальної резистентності.
Пацієнтам в тяжкому стані слід починати емпіричну протимікробну терапію з урахуванням всіх ймовірних збудників якомога швидше (по можливості протягом 1 години від встановлення сепсису та протягом 4 годин від встановлення діагнозу бактеріальна пневмонія).
При встановленні діагнозу вторинної бактеріальної пневмонії слід звертати увагу на: погіршення загального стану, лихоманку, появу гнійного мокротиння (може бути запізнілим симптомом). З лабораторних показників найбільш інформативним є рівень прокальцитоніну в крові, якщо він нормальний, показання до антибіотикотерапії, як правило, відсутні. Менш інформативними є такі показники як лейкоцитоз та зсув лейкоцитарної формули вліво. Для встановлення діагнозу бактеріальної пневмонії також застосовують бронхоскопію.
Протимікробну терапію слід коригувати на основі результатів мікробіологічних досліджень і клініко-лабораторних даних (наприклад, рівень прокальцитоніну в крові). Ефективність протимікробної терапії слід оцінювати щодня для своєчасного прийняття рішення про деескалацію.
Емпіричну протимікробну терапію слід скорочувати на підставі результатів мікробіологічного дослідження та клінічної оцінки. Регулярно переглядайте можливість переходу з внутрішньовенного на пероральний шлях введення та забезпечуйте таргетне лікування на основі результатів мікробіологічного аналізу.
Тривалість емпіричної протимікробної терапії повинна бути настільки короткою, наскільки це можливо; як правило, 3-5 діб з наступним призначенням цілеспрямованої антибактеріальної терапії після отримання результатів бактеріологічного дослідження.
Таблиця 4. АнтибактеріальніПротимікробні препарати для дорослих пацієнтів
| Показання | Емпірична антибактеріальнапротимікробна терапія |
| Позалікарняна бактеріальна пневмонія |
Легкий перебіг: Монотерапія захищеними пеніцилінами (амоксицилін/клавуланат, ампіцилін/сульбактам) АБО макролідами (азитроміцин, кларитроміцин) АБО цефалоспоринами ІІ покоління (цефуроксим) Середньотяжкий перебіг: Амоксицилін/клавуланат ПЛЮС макроліди (азитроміцин або кларитроміцин) Цефалоспорини ІІ-ІІІ покоління (цефуроксим, цефтріаксон, цефотаксим, цефтазидим, цефіксим, цефоперазон, цефподоксим) ПЛЮС макроліди (азитроміцин або кларитроміцин) У випадку алергії на бета-лактами: Респіраторні фторхінолони (левофлоксацин або моксифлоксацин) Тяжкий перебіг: Цефалоспорини ІІІ покоління (цефтріаксон, цефотаксим, цефтазидим, цефіксим, цефоперазон, цефподоксим) ПЛЮС макроліди (азитроміцин або кларитроміцин) Респіраторні фторхінолони (левофлоксацин або моксифлоксацин) як монотерапія або в комбінації з цефалоспоринами ІІІ покоління. За необхідності розгляньте захищені цефалоспорини (цефоперазон/сульбактам, цефтріаксон/сульбактам, цефтріаксон/тазобактам, цефотаксим/сульбактам). Застереження при застосуванні Під час терапії фторхінолонами існує підвищений ризик розвитку тендиніту та розриву сухожиль, зокрема, у пацієнтів літнього віку, пацієнтів із порушенням функції нирок, пацієнтів із трансплантацією органів та пацієнтів, які одночасно отримують кортикостероїди. Тому слід уникати одночасного застосування кортикостероїдів. За появи перших симптомів тендиніту (хворобливий набряк, запалення) слід припинити лікування фторхінолонами, забезпечити спокій ураженій(-им) кінцівці(-кам) та негайно звернутися до лікаря-ортопеда-травматолога (за відсутності, хірурга) для отримання консультації. Кортикостероїди не слід застосовувати, якщо з’являються ознаки тендинопатії. При перших симптомах тендиніту (наприклад, хворобливий набряк, запалення) пацієнтам слід припинити лікування фторхінолонами, забезпечити спокій ураженій (-им) кінцівці (-кам) та негайно звернутися до лікаря для отримання відповідного лікування (наприклад накладення шини) ураженого сухожилля. Кортикостероїди не слід застосовувати, якщо з’являються ознаки тендинопатії. У пацієнтів, які отримували пероральні антикоагулянти у поєднанні з антибактеріальними препаратами, в тому числі з фторхінолонами, макролідами та деякими цефалоспоринами, відзначалися численні випадки підвищення антикоагулянтної активності. Факторами ризику є інфекційні захворювання (і супутній запальний процес), вік та загальний стан пацієнта. У зв’язку з цими обставинами важко оцінити, чи спричиняє інфікування або лікування відхилення показника міжнародного нормалізованого відношення (МНВ). Як застережний захід можливий частіший моніторинг МНВ. У разі необхідності слід провести належне коригування дози перорального коагулянта. |
| Нозокоміальна пневмонія |
Рання госпітальна пневмонія: Цефалоспорини ІІІ покоління (цефтріаксон, цефотаксим, цефтазидим, цефіксим, цефоперазон, цефподоксим) ПЛЮС макроліди (азитроміцин або кларитроміцин) Респіраторні фторхінолони (левофлоксацин або моксифлоксацин) як монотерапія або в комбінації з цефалоспоринами ІІІ покоління. Пізня госпітальна пневмонія: При пізній госпітальній пневмонії, якщо антибіотики призначаються емпірично, перш за все необхідно враховувати епідемічну ситуацію у відділенні (яка мікрофлора переважає, та до яких антибіотиків вона чутлива). Необхідно враховувати результати бактеріоскопії (Грам+, Грам-). Цефалоспорини ІІІ покоління (цефтріаксон, цефотаксим, цефтазидим, цефіксим, цефоперазон, цефподоксим) ПЛЮС макроліди (азитроміцин або кларитроміцин) Респіраторні фторхінолони (левофлоксацин або моксифлоксацин) як монотерапія або в комбінації з цефалоспоринами ІІІ покоління. За необхідності розгляньте захищені цефалоспорини (цефоперазон/сульбактам, цефтріаксон/сульбактам, цефтріаксон/тазобактам, цефотаксим/сульбактам) АБО піперацилін/тазобактам. За наявності полірезистентної мікрофлори, необхідно застосовувати 2, або навіть 3 антибактеріальних препарати, карбапенеми (меропенем) або тайгециклін, особливо за умови тяжкого перебігу хвороби. За умови поширення грампозитивної полірезистентної мікрофлори (MRSA) слід призначати ванкоміцин або лінезолід. Карбапенеми слід використовувати емпірично тільки у відділеннях інтенсивної терапії (за рідкісним виключенням – в інших відділеннях, виключно комісійно та з обґрунтуванням) у хворих з тяжким перебігом захворювання. Не слід емпірично застосовувати коломіцин, внутрішньовенний фосфоміцин. Регулярно необхідно оцінювати можливість зменшення інтенсивності антибактеріальноїпротимікробної терапії, тобто переходити на антибіотики менш широкого спектру, а також враховувати можливість переключення з внутрішньовенного на пероральний шлях введення антибактеріальногопротимікробного засобу. |
АнтибактеріальнаПротимікробна терапія бактеріальної ко-інфекції у дітей
Не існує прямих доказів, що підтверджують ефективність протимікробних препаратів у пацієнтів дитячого віку з COVID-19. Не рекомендується застосовувати протимікробні засоби у дітей з COVID-19, коли немає підтвердження наявності бактеріальної ко-інфекції.
Не існує прямих доказів, що підтверджують ефективність антибактеріальних препаратів у пацієнтів дитячого віку з COVID-19. Не рекомендується застосовувати антибактеріальні засоби у дітей з COVID-19 за відсутності підтвердження наявності бактеріальної ко-інфекції.
Дітям, які повністю імунізовані кон’югованими вакцинами проти Haemophilus influenzae типу b та Streptococcus pneumoniae, призначають ампіцилін (150-200 мг/кг/добу на 4 введення або пеніцилін 200000-250000 МО/кг/добу у 4-6 введень); альтернативою може бути призначення цефтриаксону (50-100 мг/кг/добу у 1-2 введення) або цефотаксиму (150 мг/кг/добу у 3 введення); додавання ванкоміцину (40-60 мг/кг/добу у 3-4 введення) або кліндаміцину (40 мг/кг/добу у 3-4 введення при підозрі на Methicillin-resistant Staphylococcus aureus (MRSA).
Не повністю імунізовані діти проти Haemophilus influenzae типу b та Streptococcus pneumoniae в якості стартової емпіричної терапії показано застосування цефтриаксону або цефотаксиму; додавання ванкоміцину або кліндаміцину при підозрі на Methicillin-resistant Staphylococcus aureus (MRSA) у відповідних дозах.
При підозрі на ко-інфекцію атиповими збудниками (мікоплазма, хламідія призначається азитроміцин внутрішньовенно (10 мг/кг/добу у 1-2 введення) при тяжкій пневмонії; при нетяжкій пневмонії – перорально (10 мг/кг/ добу в перший день, 2-5 день – 5 мг/кг/добу у 1 введення).
При сепсисі призначають цефалоспорини ІІІ покоління внутрішньовенно (цефотаксим 50 мг/кг/добу кожні 6 годин, максимум 2 г разова доза або 8 г на добу) або цефтріаксон внутрішньовенно (75 мг/кг/разова доза) кожні 12-24 годин максимум 4 г/добу) з додаванням ванкоміцину внутрішньовенно (15 мг/кг/кожні 6 годин, максимум 500 мг/разова доза) при тяжкому перебігу захворювання.
У дітей без супутніх захворювань можливе призначення антибіотиків у наступних випадках:
1) тяжкий стан при госпіталізації;
2) наявність відомого вогнища інфекції, підтвердженого бактеріологічними дослідженнями (посів крові, сечі, спинномозкової рідини =чи інших біологічних рідин);тощо);
3) підозра на приєднання бактеріальної інфекції (підвищення =рівня прокальцитонінуС-реактивного білку крові, нейтрофільоз в загальному аналізі крові та інші маркери запалення);
4) виявлені на рентгенограмі грудної клітки зміни, які можуть вказувати на бактеріальне ураження дихальних шляхів;
5) наявність клінічних ознак сепсису.
Антибіотикопрофілактика у пацієнтів з COVID-19
Антибіотикопрофілактику у хворих з COVID-19 проводити не слід, оскільки така практика не попереджує появу пізньої госпітальної пневмонії та сприяє розвитку антибіотикорезистентності.
Антибіотикопрофілактику не слід проводити у хворих з COVID-19, виключенням можуть бути хворі з тяжкими супутніми захворюваннями: декомпенсований цукровий діабет, імуносупресія та імунодефіцит, та у хворих, що перебувають на штучній вентиляції легенів.
4.6.5. Гострий респіраторний дистрес-синдром і гіпоксемічна дихальна недостатність у хворих на COVID-19
У хворого на COVID-19 може продовжуватися порушення дихання або гіпоксемія, навіть коли кисень подається через маску для обличчя з резервуарним мішком (швидкість потоку 10-15 л/хв, що, як правило, є мінімальним потоком, необхідним для підтримки інфляції мішка; FiO2 0,60-0,95). Гіпоксемічна дихальна недостатність при гострому респіраторному дистрес-синдромі (ГРДС) зазвичай є наслідком невідповідності внутрішньолегеневої вентиляції та перфузії або шунту і зазвичай потребує механічної вентиляції.
Подача кисню через ніс з високим потоком (НКВП) або неінвазивна вентиляція (НІВ) застосовується лише у деяких пацієнтів з гіпоксемічною дихальною недостатністю. Пацієнти, які отримували терапію НІВ, мають високий ризик неефективності лікування. Пацієнтів, які отримували НКВП або НІВ слід ретельно спостерігати стосовно погіршення клінічного стану.
Системи НКВП можуть подавати 60 л/хв потоку газу і FiO2 до 1,0; педіатричні схеми зазвичай працюють лише до 15 л/хв, і багатьом дітям потрібен контур для дорослих, щоб забезпечити достатній потік. Порівняно зі стандартною терапією киснем, НКВП зменшує потребу в інтубації. Пацієнти з гіперкапнією (загострення обструктивної хвороби легенів, кардіогенний набряк легень), гемодинамічною нестабільністю, поліорганною недостатністю або порушенням психічного стану зазвичай не отримують НКВП, хоча нові дані припускають, що НКВП може бути безпечним для пацієнтів із легкою та помірною гіперкапнією. Пацієнти, які отримують НКВП, повинні знаходитись у контрольованих умовах з досвідченим медичним персоналом, здатним до ендотрахеальної інтубації, якщо стан пацієнта гостро погіршиться або не покращиться після короткого випробування (близько однієї години). При цьому слід враховувати, що доказових рекомендацій щодо НКВП не існує, а повідомлення про НКВП у пацієнтів з близькосхідним коронавірусним респіраторним синдромом обмежені.
Пацієнти, які отримують НІВ, повинні знаходитись у контрольованих умовах та з досвідченим персоналом, здатним до ендотрахеальної інтубації, якщо стан пацієнта гостро погіршиться або не покращиться після короткого випробування (близько однієї години). Пацієнти з гемодинамічною нестабільністю, поліорганною недостатністю або порушенням психічного стану не повинні отримувати НІВ. Останні публікації припускають, що новіші системи НКВП та НІВ з герметичним інтерфейсом не створюють широкої дисперсії повітря, що видихається, і тому вони повинні бути пов’язані з низьким ризиком передавання інфекції повітрям.
Інтубація повинна проводитися навченим та досвідченим лікарем із дотримання повітряних заходів безпеки. Пацієнти з ГРДС, особливо маленькі діти або ті, хто страждає ожирінням, або вагітні, можуть мати швидкі втрати кислотно-основного балансу під час інтубації.
Критерії для переходу на штучну вентиляцію легень:
показаннями для інтубації та переводу на ШВЛ є рефрактерна до НІВ або НКВП гіпоксемія SpO2 менше 85%, порушення свідомості, психомоторне збудження, тахіпное більше 45 дихань/хвилину із залученням допоміжних м’язів вдиху.вдоху.
Попередню оксигенацію 100% FiO2 протягом п’яти хвилин проводять за допомогою маски для обличчя з мішком з резервуаром, клапанною маскою, НКВП або НІВ.
Швидка інтубація є доцільною після оцінки дихальних шляхів, яка не виявляє ознак утрудненої інтубації.
Механічну вентиляцію у дорослих пацієнтів із дихальною недостатністю, слід здійснювати використовуючи менший об’єм вдиху (4–8 мл/кг ідеальної маси тіла (PBW) та нижчий тиск вдиху (плато тиск < 30 см H2O), ПТКВ 8-12 см водяного стовпчика. Початковий об’єм вдиху становить 6 мл/кг PBW; об’єм вдиху до 8 мл/кг PBW дозволений, якщо виникають небажані побічні ефекти (наприклад, дисинхронія, pH <7,15).
Гіперкапнія дозволена, якщо досягається мета pH 7,30-7,45. Для забезпечення синхронізації з апаратом штучної вентиляції легень і досягнення цільових об’ємних показників може знадобитися застосування глибокої седації.
Пацієнтам із вираженим ГРДС рекомендується вентиляція легень у положенні на животі протягом >12 годин на день змінюючи положення тіла кожні 3-4 години. Застосування вентиляції у положенні на животі рекомендується для дорослих та дітей з тяжким ГРДС, але безпечне її виконання можливе виключно за наявності необхідних людських ресурсів та досвіду.
Для хворих на ГРДС без гіпоперфузії тканин використовується поміркована рестриктивна стратегія внутрішньовенних інфузій, головний ефект якої полягає у скороченні тривалості вентиляції.
У пацієнтів із помірним та тяжким ГРДС пропонується вищий PEEP замість нижчого PEEP. Титрування PEEP вимагає врахування переваг (зменшення ателектазів та поліпшення стану альвеол) проти ризиків (кінцеве перенапруження вдиху, що призводить до ураження легень та більш високого опору легеневих судин). Титруванням PEEP на основі FiO2, необхідного для підтримання SpO2, слід проводити за доступними таблицями.
Моніторинг пацієнтів здійснюється з метою виявлення осіб, які реагують на первісне застосування вищого PEEP або іншого протоколу рекрутмент маневру, та пропонується припинити ці втручання у нереагуючих осіб.
У пацієнтів із середньотяжким ГРДС (PaO2/FiO2<150) нервово-м’язову блокаду шляхом безперервної інфузії не слід застосовувати рутинно. Постійна нервово-м’язова блокада може бути розглянута у пацієнтів з ГРДС у певних ситуаціях: виражена десинхронізація з респіратором, незважаючи на седацію, таким чином, що обмеження припливного обсягу не може бути надійно досягнуто; за рефрактерної гіпоксемії або гіперкапнії.
Уникайте відключення пацієнта від ШВЛ, що призводить до втрати PEEP та ателектазу. Використовуйте вбудовані катетери для відсмоктування секрету дихальних шляхів і затискання ендотрахеальної трубки, коли потрібно відключення (наприклад, переведення на транспортну вентиляцію).
5.7.6. Сепсис та септичний шок у хворих на COVID-19
Клінічні ознаки сепсису
Дорослі: дисфункція органів, що загрожує життю, спричинена некерованою відповіддю організму на підозрювану або доведену інфекцію. До ознак дисфункції органів належать: змінений психічний статус, утруднене або швидке дихання, низька киснева сатурація, знижений діурез, швидка ЧСС, слабкий пульс або низький артеріальний тиск, плямистість шкіри або лабораторні свідчення щодо коагулопатії, тромбоцитопенії, ацидозу, високого рівня лактату або гіпербілірубінемії.
Діти: підозрювана або доведена інфекція та критерії синдрому системної запальної відповіді (ССЗВ) у віці ≥2 років, серед яких має бути аномальна температура чи рівень лейкоцитів у крові. Критерії ССЗВ включають в себе: аномальну температуру <36°C або >38,5°C, частоту серцевих скорочень >2 пунктів стандартного відхилення вище норми за віком, або брадикардію, якщо <1 року, частоту дихання > 2 пунктів стандартного відхилення вище норми за віком та аномальну кількість лейкоцитів або > 10% незрілих нейтрофілів.
Клінічні ознаки септичного шоку
Дорослі: персистуюча гіпотензія, незважаючи на поповнення об’єму крові, що циркулює, вимагає використання вазопресорів для підтримки середнього артеріального тиску ≥65 мм рт.ст. і рівню лактату в сироватці крові > 2 ммоль/л.
Діти: Будь-який рівень гіпотензії (середній артеріальний тиск <5-го центілю або >2 пунктів стандартного відхилення нижче норми за віком) або дві-три з наступних ознак: змінений психічний стан; тахікардія або брадикардія (ЧСС <90 уд./хв або > 160 уд./хв у немовлят та ЧСС <70 уд./хв або >150 уд./хв у дітей); симптом блідої плями (>2 сек) або слабкий пульс; тахіпное; плямиста або прохолодна шкіра або петехіальні чи пурпурові висипання; підвищений лактат; олігурія; гіпертермія або гіпотермія
За відсутності можливості визначення лактату використовуйте середній артеріальний тиск (СерАТ) та клінічні ознаки перфузії для діагностики шоку. Стандартна допомога включає раннє розпізнавання та наступні методи лікування протягом однієї години після розпізнавання: антибактеріальна і інфузійна терапія та вазопресори при рефрактерній гіпотензії. Використання центральних венозних та артеріальних катетерів повинно ґрунтуватися на наявності ресурсів та індивідуальних потреб пацієнта.
При інтенсивній терапії септичного шоку дорослим рекомендовано ввести не менше 30 мл/кг ізотонічного кристалоїду протягом перших 3 годин. При інтенсивній терапії дітям септичного шоку рекомендовано ввести 20 мл/кг у вигляді швидкого болюсу та до 40-60 мл/кг у перші години.
Не використовуйте гіпотонічні кристалоїди, крохмалі або желатини для інтенсивної терапії.
Надмірне введення рідини може призвести до об’ємного перевантаження, включаючи дихальну недостатність. Якщо немає реакції на введення рідини і з’являються ознаки перевантаженості об’ємом (наприклад, здуття яремної вени, крепітація при аускультації легень, набряк легень на рентгенівських знімках або гепатомегалія у дітей), то необхідно зменшити або припинити введення рідини. Цей крок є особливо важливим, коли відсутня механічна вентиляція.
Кристалоїди включають звичайний фізіологічний розчин та розчин Рінгера.
Визначте потребу в додаткових болюсних рідинах (250-1000 мл у дорослих або 10-20 мл/кг у дітей) на основі клінічної реакції та покращення перфузійних цілей. Перфузійні цілі включають середній артеріальний тиск (>65 мм. рт.ст. або показники, відповідно віку) у дітей, виділення сечі (> 0,5 мл/кг/год у дорослих, 1 мл/кг/год у дітей) та покращення кольору шкіри, заповнення капілярів, рівень свідомості та лактату. Розгляньте динамічні показники реагування на об’єм, щоб розрахувати об’єм рідини після початкової ресусцитації на основі місцевих ресурсів та досвіду. Ці показники включають пасивне піднімання ніг, оцінку циркулюючого об’єму рідини при серійному вимірюванні або зміни систолічного тиску, пульсового тиску, розміру порожнистої вени, або ударного об’єму у відповідь на зміни внутрішньогрудного тиску під час ШВЛ.
Застосування розчинів ГЕК пов’язане з підвищеним ризиком смерті та гострим ураженням нирок порівняно з кристалоїдами. Ефекти желатинів менш чіткі, але вони дорожчі, ніж кристалоїди. Гіпотонічні (проти ізотонічних) розчини менш ефективні для збільшення внутрішньосудинного об’єму. Рекомендовано використовувати альбумін для ресусцитації, коли пацієнти потребують значної кількості кристалоїдів, але ця умовна рекомендація ґрунтується на доказах низької якості.
Слід використовувати вазопресори, якщо шок зберігається під час або після введення рідини. Початкова ціль для артеріального тиску становить середній артеріальний тиск (СерАТ) ≥ 65 мм. рт.ст. у дорослих та віковий рівень у дітей.
Якщо центральні венозні катетери недоступні, вазопресори можна вводити через периферичну вену, але використовувати вену великого діаметру та ретельно стежити за ознаками екстравазації та локального некрозу тканин. Якщо відбувається екстравазація, припиніть інфузію. Вазопресори також можна вводити через внутрішньокісткові голки.
Якщо ознаки поганої перфузії та серцевої дисфункції зберігаються, незважаючи на досягнення мети середнього артеріального тиску з рідинами та вазопресорами, розгляньте інотроп, такий як добутамін.
Вазопресори (тобто норадреналін, епінефрин, вазопресин та дофамін) найбезпечніше вводити через центральний венозний катетер із суворо контрольованою швидкістю, але також їх можна безпечно вводити через периферичну вену та внутрішньокісткову голку. Часто контролюйте артеріальний тиск і титруйте вазопресор до мінімальної дози, необхідної для підтримки перфузії та запобігання побічних ефектів. Норепінефрин вважається першою лінією у дорослих пацієнтів; Для досягнення мети середнього артеріального тиску можуть бути додані епінефрин або вазопресин. Через ризик виникнення тахіаритмії резервуйте дофамін для окремих пацієнтів з низьким ризиком розвитку тахіаритмії або пацієнтів із брадикардією.
8.7. Використання реконвалесцентної плазми, яка містить нейтралізуючі антитіла класу IgG проти SARS-CoV-2 у високих титрах
Оптимальним є введення плазми на початку захворювання (до появи антитіл), найбільш ефективно — в перші 72 години від появи перших клінічних симптомів.
Реконвалесцентна плазма може бути використана для раннього специфічного лікування COVID-19 лише для пацієнтів, які мають:
лабораторно підтверджений SARS-CoV-2;
тяжкий або критичний перебіг захворювання або мають прогностичні фактори прогресування до тяжкого або критичного стану.
Тяжкий перебіг визначається як один або кілька з наступних факторів:
задишка;
частота дихання ≥30/хв;
насичення крові киснем SaO2 ≤92%;
PaO2/FiO2 <300;
легеневі інфільтрати >50% із їх прогресуванням протягом 24–48 годин.
Критичний перебіг визначається як один або кілька з наступних факторів:
тяжка дихальна недостатність;
септичний шок;
поліорганна недостатність.
Дозування:
Разова доза плазми, що підлягає трансфузії, повинна становити 200 мл, але може бути і більшою (до 500 мл), якщо лікар дійде висновку, що трансфузія більшого об’єму є доцільною. Перша доза становить 200 мл, залежно від тяжкості захворювання чи толерантності до вливань можливе повторне введення однієї чи двох доз по 200 мл. Трансфузії можуть проводитися у будь-який період госпіталізації, зокрема у вигляді непослідовних багаторазових доз.
Об’єм плазми, що підлягає трансфузії, повинен базуватися на вазі пацієнта та наявності супутніх захворювань (наприклад, пацієнти із порушенням функцій серця та серцевою недостатністю можуть потребувати меншого об’єму або тривалішого часу трансфузії).
Протипоказання до застосування реконвалесцентної плазми:
перебіг захворювання більше двох тижнів (14 днів);
в анамнезі алергічна реакція на кров або продукти плазми;
встановлений дефіцит IgA (рівень IgA слід перевіряти перед переливанням, оскільки рівень IgA не повинен бути менше нижньої межі норми);
клінічні стани, при яких надходження додаткового внутрішньосудинного об’єму може бути шкідливим для пацієнта (наприклад, активно декомпенсована застійна серцева недостатність).
Потенційні побічні ефекти застосування реконвалесцентної плазми можуть включати:
легку лихоманку;
легка лихоманка;
алергічні реакції, включаючи в рідкісних випадках сироваткову хворобу;
гостре посттрансфузійне ураження легень (ГПТУЛ).
З метою уникнення ризику розвитку ГПТУЛ потрібно надавати перевагу використанню плазми, забраної від донорів-чоловіків або донорів-жінок, які ніколи не були вагітними (враховуючи аборти).
потенційний ризик передачі гемоконтактного інфекційного захворювання від донора.
Застосування реконвалесцентної плазми повинно відбуватися в умовах організованого рандомізованого контрольованого клінічного дослідження або протокольного обсерваційного дослідження у всіх випадках, коли це можливо. У випадках, коли це неможливо, слід здійснювати забір та зберігання зразків крові донора і реципієнта (перед лікуванням та після його завершення) для ретроспективного аналізу. Необхідно забезпечити моніторинг результатів пацієнтів, враховуючи клінічні та лабораторні показники безпеки й ефективності.
9.8. Мультисистемний запальний синдром при COVID-19 у дітей та підлітків
Мультисистемний запальний синдром (MIS)у дітей та підлітків є рідкісним ускладненням коронавірусної хвороби (COVID-19).
Мультисистемний запальний синдром у дітей та підлітків (MIS-C)
Визначення випадку мультисистемного запального синдрому у дітей та підлітків, асоційованого із коронавірусною хворобою (COVID-19):
Особа 0–21 років із лихоманкою ≥38,0°C тривалістю більше 72 годин, лабораторними ознаками запалення*, доказами тяжкості клінічного перебігу захворювання, яке потребує госпіталізації, з мультисистемним ураженням органів (>2) (серцевої, ниркової, дихальної, системи крові, шлунково-кишкової, покривної або нервової);
ТА дві з наступних ознак:
1) висип або двосторонній негнійний кон’юнктивіт або ознаки запалення слизово-шкірної оболонки (ротової порожнини, рук або ніг);
2) гіпотензія або шок;
3) ознаки міокардіальної дисфункції, перикардиту, вальвуліту або коронарних порушень (включаючи результати ЕКГ або підвищення тропоніну/N-кінцевого пропептиду натрійуретичного гормону B-типу (NT-proBNP));
4) докази коагулопатії (за прототромбіновим часом (PT), частковим (парціальний) тромбопластиновим часом (PTT), підвищеним рівнем D-димеру);
5) гострі шлунково-кишкові проблеми (діарея, блювота або біль у животі).
ТА
Виключення запалення бактеріальної етіології, включаючи бактеріальний сепсис, стафілококовий або стрептококовий синдром токсичного шоку.
ТА
Лабораторне підтвердження COVID-19 (полімеразна ланцюгова реакція з використанням зворотної транскрипції (RT-PCR), тест на антиген або позитивний серологічний тест) або ймовірний контакт з хворими на COVID-19 впродовж останніх 4 тижнів від початку симптомів.
* Лабораторні докази запалення включають, але не обмежуються однією або більше з наступних ознак: підвищений С-реактивний білок, швидкість осідання еритроцитів (ШОЕ), фібриноген, прокальцитонін, D-димер, феритин, лактат дегідрогеназа (ЛДГ) або інтерлейкін 6 (IЛ-6), підвищений рівень нейтрофілів, знижений рівень лімфоцитів та низький рівень альбуміну.
Таблиця 5. Клінічні та лабораторні ознаки для діагностики мультисистемного запального синдрому
| Клінічні ознаки | Лабораторні ознаки |
|---|---|
| У всіх пацієнтів
Стійка лихоманка вище 38,0°C |
У всіх пацієнтів
Підвищений рівень фібриногену Високий рівень С-реактивного білку Високий рівень D-димеру Високий рівень феритину Гіпоальбумінемія Лімфопенія Нейтрофілія у більшості пацієнтів, у деяких пацієнтів можливий нормальний рівень нейтрофілів Підвищена швидкість осідання еритроцитів (ШОЕ) |
| У більшості пацієнтів
Потреба в кисні Гіпотонія |
|
| У деяких пацієнтів
Біль у животі Сплутаність свідомості Кон’юнктивіт Кашель Діарея Головний біль Лімфаденопатія Зміни слизових оболонок Набряк шиї Висип на шкірі Біль у горлі Набряк рук і ніг Синкопе Блювота |
У деяких пацієнтів
Підвищений рівень креатиніну, сечовини (маркери гострого ураження нирок) Анемія Коагулопатія Високий рівень ІЛ-10 (за можливості) Високий рівень ІЛ-6 (за можливості) Нейтрофілія Протеїнурія Підвищений рівень креатинкінази (КК) Підвищений рівень лактатдегідрогенази (ЛДГ) Підвищений рівень тригліцеридів (ТАГ) Підвищений рівень тропоніну Тромбоцитопенія Підвищений рівень трансаміназ (АЛТ, АСТ) Підвищення рівня N-кінцевого пропептиду натрійуретичного гормону B-типу (NT-proBNP) |
Для встановлення мультисистемного запального синдрому у дітей застосовуються наступні інструментальні методи:
ЕКГ та ЕХО серця;
рентгенографія;
КТ грудної клітки.
Мультисистемний запальний синдром у дорослих (MIS-A)
У дорослих пацієнтів з COVID-19, як і у дітей, через декілька днів чи тижнів від початку хвороби можуть розвинутися симптоми мультисистемного запального синдрому у дорослих (MIS-A), що можуть включати:
- лихоманку,
- низький кров’яний тиск, абдомінальний біль, блювоту,
- діарею,
- біль у шиї, висип,
- відчуття здавленості/болі у грудній клітці, відчуття сильної втоми.
Лікування мультисистемного запального синдрому у дітей та підлітків
Пацієнтам з мультисистемним запальним синдромом без симптомів, що загрожують життю, рекомендована підтримуюча терапія та моніторинг клінічного стану без імуномодулюючого лікування.
Імуномодулююче лікування включає:
Перша лінія терапії — імуноглобулін людини нормальний для внутрішньовенного введення в дозі 1–2 мг г/кг, яка може бути введена як єдина доза або розділена залежно від клінічної картини та серцевої функції. Введення другої дози імуноглобуліну може бути розглянуто у пацієнтів, які не відповіли на введення першої дози. До початку введення імуноглобуліну пацієнтам з шоком слід оцінити серцеву функцію та рідинний баланс. Імуноглобулін слід вводити, коли серцева функція буде відновлена.
Застереження: Внаслідок лікування препаратами імуноглобуліну може виникнути тромбоз. Перед застосуванням препарату слід переконатися у належному рівні гідратації пацієнта. У пацієнтів з ризиком виникнення підвищеної в’язкості слід здійснювати контроль симптомів тромбозу та оцінку в’язкості крові. Ризик виникнення побічних явищ зростає із збільшенням дози та швидкості вливання імуноглобуліну людини нормального для внутрішньовенного введення, особливо при інфузії першої дози.
Друга лінія терапії – розгляньтеРозгляньте можливість застосування системних кортикостероїдів у пацієнтів, у яких відсутній ефект через 24 години після введення імуноглобуліну людини нормального для внутрішньовенного введення (тахікардія, необхідність вазоактивної підтримки), особливо при наявності лихоманки.(наприклад, метилпреднізолон 2–30 мг/кг/добу) (незалежно від потреби в кисні)як засіб другої лінії у пацієнтів, у яких відсутній ефект через 24 години після введення імуноглобуліну (тахікардія, необхідність вазоактивної підтримки), особливо у дітей з лихоманкою.
КортикостероїдиГлюкокортикоїди в низьких та середніх дозах можуть розглядатися для лікування мультисистемного запального синдрому. Пульс-терапія глюкокортикоїдами у високих дозах може бути розглянута для лікування пацієнтів із загрожуючими для життя ускладненнями, такими як шок, а особливо, якщо пацієнту потрібні високі або повторні дози інотропів та/або вазопресорів.
Терапію системними кортикостероїдами слід розпочинати внутрішньовенно із застосуванням метилпреднізолону в дозі 2 мг/кг/добу розділену на 2 введення. У разі тяжкого мультисистемного запального синдрому (шок, значні системні прояви) слід розглянути внутрішньовенне введення метилпреднізолону у якості пульс-терапії в дозі 10–30 мг/кг/добу (не більше 1 г).
Одночасне застосування метилпреднізолону та імуноглобуліну людини нормальним для внутрішньовенного введення рекомендується пацієнтам із:
- тяжким або рефрактерним шоком;
- клінічним перебігом, що повністю або частково відповідає хворобі Кавасакі ТА є фактори ризику резистентності до імуноглобуліну людини нормального, які полягають у змінах коронарних артерій або віці менше 12 місяців;
- стійкою лихоманкою та динамічно зростаючими маркерами запалення (С-реактивний білок, D-димери, феритин) під час введення імуноглобуліну людини нормального.
Тривалість лікування метилпреднізолоном для внутрішньовенного введення становить 5 днів або до тих пір, поки стан пацієнта стабілізується та дозволить перейти на пероральний шлях введення кортикостероїдів (наприклад, преднізолону).
Після застосування метилпреднізолону для внутрішньовенного введення лікування продовжують перорально преднізолоном із поступовим зменшенням дози.
Загальна тривалість лікування кортикостероїдами зазвичай становить 15 днів, але може тривати до 6 тижнів, якщо хвороба триває довго.
Якщо терапію кортикостероїдами починають з метилпреднізолону у пульс-дозі, то відбувається перехід на пероральну терапію преднізолоном у дозі 1 мг/кг/добу розділену на 2 рази. Для подальшого поступового зменшення кортикостероїдів бажана консультація ревматолога.
Пацієнти, у яких було діагностовано мультисистемний запальний синдром, повинні проходити амбулаторне кардіологічне спостереження протягом 6 тижнів після виписки із закладу охорони здоров’я.
Дозування кортикостероїдів має поступово знижуватися впродовж 2–3-тижнів на підставі результати лабораторних аналізів та оцінки стану серця.
При Кавасакі-подібному синдромі існує високий ризик несприятливого перебігу у дітей молодше 12 місяців і дітей з змінами коронарних артерій. У таких випадках внутрішньовенні кортикостероїди можуть бути призначені як варіант першої лінії терапії у поєднанні з внутрішньовенним імуноглобуліном.
Пацієнти, у яких було діагностовано мультисистемний запальний синдром, повинні проходити амбулаторне педіатричне кардіологічне спостереження протягом 6 тижнів після виписки з лікарні із закладу охорони здоров’я.
IV. Перелік літературних джерел, використаних при розробці клінічного Ппротоколу медичної допомоги медичної допомоги.
1. World Health Organization (WHO). Off-label use of medicines for COVID-19, 31.03.2020. https://www.who.int/news-room/commentaries/detail/off-label-use-of-medicines-for-covid-19
2. World Health Organization (WHO). Clinical management of COVID-19, 27.05.2020. https://www.who.int/publications-detail/clinical-management-of-covid-19
3. World Health Organization (WHO). COVID-19 Clinical management: living guidance, 25.01.2021. https://www.who.int/publications/i/item/WHO-2019-nCoV-clinical-2021-1
4. World Health Organization (WHO). Living guidance “Corticosteroids for COVID-19”, 02.09.2020.
https://www.who.int/publications/i/item/WHO-2019-nCoV-Corticosteroids-2020.1
5. World Health Organization (WHO). Living guidance “Therapeutics and COVID-19: living guideline”, 17.12.2020.
https://www.who.int/publications/i/item/WHO-2019-nCoV-therapeutics-2021.1
6. Всесвітня організація охорони здоров’я (ВООЗ). Клінічна допомога при важкій гострій респіраторній інфекції: інструментарій. Адаптовано до COVID-19.
https://apps.who.int/iris/bitstream/handle/10665/333001/WHO-2019-nCoV-SARI-toolkit-2020.1-ukr.pdf?sequence=1&isAllowed=y
7. World Health Organization (WHO). Tackling antimicrobial resistance in the COVID-19 pandemic
https://www.who.int/bulletin/volumes/98/7/20-268573/en/#:~:text=The%20guidance%20does%20not%20recommend,of%20a%20bacterial%20infection%20exist.
8. European Medicines Agency (EMA) provides recommendations on compassionate use of remdesivir for COVID-19, 03.04.2020.
https://www.ema.europa.eu/en/news/ema-provides-recommendations-compassionate-use-remdesivir-covid-19
9. European Medicines Agency (EMA) Summary on compassionate use Remdesivir, 03.04.2020.
https://www.ema.europa.eu/en/documents/other/summary-compassionate-use-remdesivir-gilead_en.pdf
10. EMA recommends expanding remdesivir compassionate use to patients not on mechanical ventilation, 11.05.2020.
https://www.ema.europa.eu/en/news/ema-recommends-expanding-remdesivir-compassionate-use-patients-not-mechanical-ventilation
11. European Medicines Agency (EMA). First COVID-19 treatment Remdesivir recommended for EU authorisation, 25.06.2020.
https://www.ema.europa.eu/en/news/first-covid-19-treatment-recommended-eu-authorisation
12. European Medicines Agency (EMA). Summary of product characteristics of Veklury (remdesivir)
https://www.ema.europa.eu/en/medicines/human/EPAR/veklury
13. European Medicines Agency (EMA) EU authorities agree new measures to support availability of medicines used in the COVID-19 pandemic, 06.04.2020:
https://www.ema.europa.eu/en/news/eu-authorities-agree-new-measures-support-availability-medicines-used-covid-19-pandemic
14. European Medicines Agency (EMA) Compassionate use
https://www.ema.europa.eu/en/human-regulatory/research-development/compassionate-use
15. U.S. Food and Drug Administration (FDA). FDA issued an emergency use authorization for the investigational antiviral drug remdesivir for the treatment of suspected or laboratory- confirmed COVID-19 in adults and children hospitalized with severe disease, 01.05.2020.
https://www.fda.gov/media/137564/download
16. U.S. Food and Drug Administration (FDA). FDA Approves First Treatment for COVID-19 Veklury (remdesivir), 22.10.2020.
https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/214787Orig1s000lbl.pdf
17. U.S. Food and Drug Administration (FDA). Fact sheet for health care providers emergency use authorization (EUA) of remdesivir (GS-5734™) https://www.fda.gov/media/137566/download
18. U.S. Food and Drug Administration (FDA). FDA Revokes Emergency Use Authorization for Chloroquine and Hydroxychloroquine, 15.06.2020.
https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-use-authorization-chloroquine-and
19. U.S. Food and Drug Administration (FDA) Expanded Access.
https://www.fda.gov/news-events/public-health-focus/expanded-access
20. U.S. Food and Drug Administration (FDA). FDA Warns of Newly Discovered Potential Drug Interaction That May Reduce Effectiveness of a COVID-19 Treatment Authorized for Emergency Use (co-administration of remdesivir and chloroquine phosphate or hydroxychloroquine sulfate is not recommended), 15.06.2020
https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-warns-newly-discovered-potential-drug-interaction-may-reduce
21. U.S. Food and Drug Administration (FDA). Expanded Access to Convalescent Plasma for the Treatment of Patients with COVID-19, 03.08.2020
https://www.uscovidplasma.org/-/media/kcms/gbs/patient-consumer/documents/2020/05/27/21/23/covid-19-plasma-eap.pdf
22. U.S. Department of Health and Human Services. Coronavirus Disease 2019 (COVID-19). Treatment Guidelines
https://files.covid19treatmentguidelines.nih.gov/guidelines/covid19treatmentguidelines.pdf
23. Interim clinical guidance for adults with suspected or confirmed COVID- 19 in Belgium
https://epidemio.wiv-isp.be/ID/Documents/Covid19/COVID-19_InterimGuidelines_Treatment_ENG.pdf
24. Recommandations pour le traitement des enfants atteints de COVID-19 Belgian Pediatric Covid-19 Task Force (Adaptation du protocole original de la KULeuven
http://gbs-vbs.org/fileadmin/user_upload/Unions/PED/Belg_Recomm_COVID_ped_31mar_FR.pdf.
25. French legal order. Decree No. 2020-314 of March 25, 2020 supplementing Decree No. 2020-293 of March 23, 2020 prescribing the general measures necessary to deal with the COVID-19 epidemic in the context of the state of health emergency.
https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000041755775&categorieLien=id
26. World Health Organization (WHO). Targeted Update: Safety and efficacy of hydroxychloroquine or chloroquine for treatment of COVID-19, 17.06.2020
https://www.who.int/publications/m/item/targeted-update-safety-and-efficacy-of-hydroxychloroquine-or-chloroquine-for-treatment-of-covid-19
27. World Health Organization (WHO). Hydroxychloroquine (HCQ) arm of the Solidarity Trial to find an effective COVID-19 treatment was being stopped, 17.06.2020:
https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-clinical-trial-for-covid-%2019-treatments
28. Centers for Disease Control and Prevention (CDC) Interim Clinical Guidance for Management of Patients with Confirmed Coronavirus Disease (COVID-19).
https://www.cdc.gov/coronavirus/2019-ncov/hcp/clinical-guidance-management-patients.html
29. CDC Information for Clinicians on Therapeutic Options for COVID-19 Patients.
https://www.cdc.gov/coronavirus/2019-ncov/hcp/therapeutic-options.html
30. U.S. National Institutes of Health. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines
https://www.covid19treatmentguidelines.nih.gov/whats-new/
31. Infectious Diseases Society of America. Guidelines on the Treatment and Management of Patients with COVID-19. https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management
32. Polish Association of Epidemiologists and Infectiologists. Management of SARS-CoV-2 infection: recommendations of the Polish Association of Epidemiologists and Infectiologists. Annex no. 2 as of October 13, 2020
https://www.mp.pl/paim/issue/article/15658
33. Austrian Society for Internistic and General Intensive Care Medicine and Emergency Medicine, ÖGARI). ICU Therapy guideline for the treatment of patients with a SARS CoV2 infection.
https://www.anaesthesie.news/wp-content/uploads/%C3%96GARI-FASIM-%C3%96GIAIN-Guideline-NEU-Covid19-290320.pdf
34. Сhina National Health Commission of the People’s Republic of China. Diagnosis and Treatment Protocol for COVID-19 Patients (Trial Version 8).
http://en.nhc.gov.cn/2020-09/07/c_81565.htm
35. Chinese Centre for Disease Control and Prevention. Diagnosis and treatment. COVID-19 Prevention and Control.
http://www.chinacdc.cn/en/COVID19/202002/P020200310326343385431.pdf
36. Circolare del ministero con raccomandazioni per persone immunodepresse:
Raccomandazioni per la gestione dei pazienti immunodepressi residenti nel nostro Paese in corso di emergenza da COVID-19.
https://www.trovanorme.salute.gov.it/norme/renderNormsanPdf?anno=2020&codLeg=73753&parte=1%20&serie=null
37. Lietuvos Respublikos sveikatos apsaugos ministro 2020 m. kovo 17 d. įsakymu Nr. V-383: SUAUGUSIŲJŲ COVID-19 LIGOS (KORONAVIRUSO INFEKCIJOS) DIAGNOSTIKOS IR GYDYMO TVARKOS APRAŠAS) http://sam.lrv.lt/uploads/sam/documents/files/COVID-19_dgn%20ir%20gydymo%20aprasas%20SUVESTINIS.pdf
38. Protocole pour la prise en charge de Patients ayant une infection COVID-19 confirmёe ou suspectee, CONSEIL SUPERIEUR DES MALADIES INFECTIEUSES
https://sante.public.lu/fr/espace-professionnel/recommandations/direction-sante/000-covid-19/index.html
39. De Stichting Werkgroep Antibiotica Beleid (SWAB). Medicamenteuze behandelopties bij patiёnten met COVID-19 (infecties met SARS-CoV-2), De Stichting Werkgroep Antibiotica Beleid
https://swab.nl/nl/covid-19
40. Center for Disease Prevention and Control of the Republic of Latvia. REKOMENDACIJAS SARS-CoV-2 infekcijas un COVID-19 epidemiologija, diagnostika, kliniskas norises un komplikacijas, 2021
https://www.spkc.gov.lv/sites/spkc/files/media_file/covid_19_rekomendacijas_marts-gatavs-1.pdf
Agencia Espanola de Medicamentos y Productos Sanitarios (AEMPS). Tratamientos disponibles para el manejo de la infeccion respiratoria por SARS-CoV-2
42. National Public Health Organization (NPHO), Ministry of Health of Greece. Агаїїка фарряка каї (кралгш acOsvrov li; /oiLiokl ano to vso kopovoi’o SARS-CoV-2.
https://eody.gov.gr/wp-content/uploads/2020/03/covid-19-odigies-therapeias.pdf
43. The First Affiliated Hospital, Zhejiang University School of Medicine. Handbook of COVID-19 Prevention and Treatment, 2020: https://covid-19.alibabacloud.com/
44. Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVID-19).
https://www.esicm.org/wp-content/uploads/2020/03/SSC-COVID19-GUIDELINES.pdf
45. Ministry of Health, labour and Welfare of Japan. Clinical Management of Patients with COVID-19. A guide for front-line healthcare workers (Version 2.1). https://www.mhlw.go.jp/content/000646531.pdf
46. Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. A trial of Lopinavir-ritonavir in adults hospitalized with severe Covid-19. N Engl J Med. 2020. https://doi.org/10.1056/NEJMoa2001282.
https://www.nejm.org/doi/full/10.1056/NEJMoa2001282
47. Goldman JD, Lye DCB, Hui DS, Marks KM, Bruno R, Montejano R, et al. Remdesivir for 5 or 10 days in patients with severe Covid-19. N Engl J Med. (2020). doi: 10.1056/NEJMoa2015301.
https://www.nejm.org/doi/full/10.1056/NEJMoa2015301?query=featured_coronavirus
48. Wang Y, Zhang D, Du G, et al. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet (2020);395:1569-1578.
doi: 10.1016/S0140-6736(20)31022-9
https://www.thelancet.com/pdfs/journals/lancet/PIIS0140-6736(20)31022-9.pdf
49. J.H. Beigel, K.M. Tomashek, L.E. Dodd, A.K. Mehta, B.S. Zingman, A.C. Kalil, et al. Remdesivir for the treatment of covid-19—preliminary report. N Engl J Med (2020) https://doi.org/10.1056/netjmoa2007764
https://www.nejm.org/doi/full/10.1056/NEJMoa2007764?source=nejmfacebook&medium=organic-social&fbclid=IwAR1nvgVskaoitXDSLCA6YfMC-+bhn80A5XtLQyo0HCaJhxlEdld1Nd6opDK0#article_citing%20_articles
50. Statement from the Chief Investigators of the Randomised Evaluation of COVid-19 thERapY (RECOVERY) Trial on lopinavir-ritonavir, 29.06.2020
https://www.recoverytrial.net/files/lopinavir-ritonavir-recovery-statement-29062020_final.pdf
51. Statement from the Chief Investigators of the Randomised Evaluation of COVid-19 thERapY (RECOVERY) Trial on hydroxychloroquine, 5.06.2020
https://www.recoverytrial.net/files/hcq-recovery-statement-050620-final-002.pdf
52. RETRACTED: Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31180-6/fulltext?fbclid=IwAR0unXed9JIjtou-tTSC8iM3NBoXQRYdslK34VZZgiuNxmKE3FSc3Fo9z5A#section-3d6acba1-acea-4be2-8dc9-b7e14e5b6583
53. Cai, Q. et al. Experimental treatment with Favipiravir for COVID-19: an open-label control study. Engineering. https://doi.org/10.1016/j.eng.2020.03.007 https://www.sciencedirect.com/science/article/pii/S2095809920300631
54. Yohei D et al. Preliminary Report of the Favipiravir Observational Study in Japan https://www.kansensho.or.jp/uploads/files/topics/2019ncov/covid19_casereport_en_200529.pdf
55. Uno studio randomizzato multicentrico in aperto per valutare l’efficacia della somministrazione precoce del Tocilizumab (TCZ) in pazienti affetti da polmonite da COVID-19, 17.06.2020
https://www.aifa.gov.it/documents/20142/1123276/studio%20RE%20Toci%2017.06.2020.pdf/c32ed144-ce26-d673-6e4d-11d5d0d84836
56. American Society of Health-System Pharmacists (ASFP). Assessment of Evidence for COVID-19-Related Treatments
https://www.ashp.org/-/media/assets/pharmacy-practice/resource-centers/Coronavirus/docs/ASHP-COVID-19-Evidence-Table.ashx
57. Interactions with Experimental COVID-19 Therapies https://www.covid19-druginteractions.org/
58. Belgian Society on Thrombosis and Haemostasis (BSTH). Anticoagulation management in COVID-19 positive patients BSTH consensus guideline
https://covid-19.sciensano.be/sites/default/files/Covid19/COVID-19_Anticoagulation_Management.pdf
59. COVID-19 anticoagulation recommendations in children, 18.06.2020
https://onlinelibrary.wiley.com/doi/10.1002/pbc.28485
60. Thromboembolism and anticoagulant therapy during the COVID-19 pandemic: interim clinical guidance from the anticoagulation forum, 21.05.2020
https://link.springer.com/article/10.1007/s11239-020-02138-z
61. Groupe d’intёrёt en I lemostase Perioperatoire (GIHP) and the Groupe Francais d’etudes sur FI lemostase et la Thrombose (GFHT). Prevention of thrombotic risk in hospitalized patients with COVID-19 and hemostasis monitoring, 19.06.2020
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7303590/
62. Ministarstvo zdravstva Republike Hrvatske. Smjernice za lijecenje oboljelih od koronavirusne bolesti 2019 (COVID-19) verzija 2 od 19. studenoga 2020. https://www.hzjz.hr/wp-content/uploads/2020/03/Smjernice_COVID_19_27_11_2020.pdf
63. Rawson T. et al. Bacterial and fungal co-infection in individuals with coronavirus: A rapid review to support COVID-19 antimicrobial prescribing, 02.05.2020 https://pubmed.ncbi.nlm.nih.gov/32358954/
64. National Institute for Health and Care Excellence (NICE). COVID-19 rapid guideline: antibiotics for pneumonia in adults in hospital, 01.05.2020, Last updated: 09.10.2020 https://www.nice.org.uk/guidance/ng173
65. Infectious Diseases Society of America. IDSA Guidelines on the Treatment and Management of Patients with COVID-19, 18.03.2021.
https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management
66. Infectious Diseases Society of America. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America, 10.01.2019
https://www.idsociety.org/practice-guideline/community-acquired-pneumonia-cap-in-adults/
67. The Dutch Working Party on Antibiotic Policy. Recommendations for antibacterial therapy in adults with COVID-19 – an evidence based guideline, 30.09.2020.
https://www.clinicalmicrobiologyandinfection.com/article/S1198-743X(20)30594-2/fulltext
68. British Paediatric Society. Guidance for the clinical management of children admitted to hospital with suspected COVID-19
https://www.rcpch.ac.uk/sites/default/files/2020-03/bprs_management_of_children_admitted_to_hospital_with_covid19_-_20200319.pdf
69. Efficacy and safety of antibiotic agents in children with COVID-19: a rapid review, 08.05.2020 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7290645/
70. The Management of Community-Acquired Pneumonia in Infants and Children Older Than 3 Months of Age: Clinical Practice Guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America
https://academic.oup.com/cid/article/53/7/e25/424286#74161858
71. The acute management of paediatric coronavirus disease 2019 (COVID-19), 20.04.2020
https://www.cps.ca/en/documents/position/the-acute-management-of-paediatric-coronavirus-disease-2019covid-19
72. Coronavirus disease 2019 (COVID-19): Management in children, 14.09.2020
https://www.uptodate.com/contents/covid-19-management-in-children
73. HSE Interim Guidance for the use of Tocilizumab in the Management of Patients who have Severe COVID-19 with Suspected Hyperinflammation, 02.09.2020
https://www.hse.ie/eng/about/who/acute-hospitals-division/drugs-management-programme/interim-recommendations-for-the-use-of-tocilizumab-in-the-management-of-patients-who-have-severe-covid-19-with-suspected-hyperinflammation-version-4.pdf
74. HSE Interim Guidance for the Use of Antiviral Therapy in the Clinical Management of Acute Respiratory Infection with SARS-CoV-2 (COVID-19). Version number: 5.0, 09.09.2020:
https://www.hse.ie/eng/about/who/acute-hospitals-division/drugs-management-programme/specific-antiviral-therapy-in-the-clinical-management-of-acute-respiratory-infection-with-sars-cov2-covid19.pdf
75. HSE Interim Guidance for the use of Systemic Corticosteroids in the Management of Hospitalised Patients with Severe COVID-19 Disease, 17.09.2020 https://www.hse.ie/eng/about/who/acute-hospitals-division/drugs-management- programme/hse-interim-guidance-for-the-use-of-systemic-corticosteroids-in-the- management-of-hospitalised-patients-with-severe-covid-19-disease.pdf
76. HSE Rapid Evidence Review. Clinical evidence for the use of intravenous immunoglobulin in the treatment of COVID19. Version 2, 14.05.2020
https://www.hse.ie/eng/about/who/acute-hospitals-division/drugs-management-programme/evidence-review-group-for-medicines-rer-intravenous-immunoglobulin-in-the-treatment-of-covid19-version-1.pdf
77. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America
https://www.atsjournals.org/doi/full/10.1164/rccm.201908-1581ST
78. National Centre for Pharmacoeconomics (NCPE), Medicines Management Programme (MMP), the National Medicines Information Centre (NMIC). Clinical evidence for the use of intravenous immunoglobulin in the treatment of COVID-19, 14.05.2020 http://www.ncpe.ie/wp-content/uploads/2020/05/Intravenous-immunoglobulin-for-the-treatment-of-COVID-19-A-Rapid-Evidence-Review-V2.pdf
79. Standiger Arbeitskreis der Kompetenz- und Behandlungszentren fur Krankheiten durch hochpathogene Erreger am Robert Koch-Institut, STAKOB. Hinweise zu Erkennung, Diagnostik und Therapie von Patienten mit COVID-19”, 01.03.2021
https://www.rki.de/DE/Content/Kommissionen/Stakob/Stellungnahmen/Stellungnahme-Covid-19_Therapie_Diagnose.pdf;jsessionid=B252C67B9CC8E7B4BC530A7EA2D09F5B.internet102?__blob=publicationFile
80. Australian National COVID-19 Clinical Evidence Taskforce. Australian guidelines for the clinical care of people with COVID-19 https://app.magicapp.org/#/guideline/4550
81. National Centre for Infectious Diseases (NCID) Singapore. Interim Treatment Guidelines for COVID-19. Version 4.0, dated 31 August 2020.
https://www.ncid.sg/Documents/Interim%20Treatment%20Guidelines%20for%20COVID- 19%20v4%20%2831%20Aug%202020%29-%20final.docx%20for%20upload.pdf
82. Centers for Disease Control and Prevention (CDC). Multisystem Inflammatory Syndrome in Children (MIS-C) Associated with Coronavirus Disease 2019 (COVID-19).
https://emergency.cdc.gov/han/2020/han00432.asp
83. Centers for Disease Control and Prevention (CDC). Multisystem Inflammatory Syndrome in Adults (MIS-A). 13.11.2020
84. Royal College of Paediatrics and Child Health. Paediatric multisystem inflammatory syndrome temporally associated with COVID-19 (PIMS). 01.05.2020 https://www.rcpch.ac.uk/resources/paediatric-multisystem-inflammatory-syndrome-temporally-associated-covid-19-pims-guidance
85. Stanford Medicine. Multisystem Inflammatory Syndrome in Children (MIS-C) Pathway. 10.06.2020
https://med.stanford.edu/content/dam/sm/school/documents/rambam/Saraswati_Multisystem%20Inflammatory%20Syndrome%20in%20Children%20(MIS-C).pdf
86. American College of Rheumatology. Clinical Guidance for Pediatric Patients with Multisystem Inflammatory Syndrome in Children (MIS-C) Associated with SARS-CoV-2 and Hyperinflammation in COVID-19, 23.07.2020 https://www.rheumatology.org/Portals/0/Files/ACR-COVID-19-Clinical-Guidance- Summary-MIS-C-Hyperinflammation.pdf
87. American Academy of Pediatrics. Multisystem Inflammatory Syndrome in Children (MIS- C) Interim Guidance.
https://services.aap.org/en/pages/2019-novel-coronavirus-covid-19-infections/clinical-guidance/multisystem-inflammatory-syndrome-in-children-mis-c-interim-guidance/
88. A national consensus management pathway for paediatric inflammatory multisystem
syndrome temporally associated with COVID-19 (PIMS-TS): results of a national Delphi
process, 18.09.2020 https://www.thelancet.com/journals/lanchi/article/PIIS2352-4642(20)30304-7/fulltext#%20
89. The British Paediatric Allergy, Immunity and Infection Group (BPAIIG). Position Statement: Management of novel coronavirus (SARS-CoV-2) infection in paediatric patients in the UK and Ireland, 17.04.2020.
https://www.bpaiig.org/sites/default/files/National_paediatric_COVID19%20treatment%20v1.2_0.pdf
90. Belgian Pediatric Covid-19 Task Force. Recommandations pour le traitement des enfants atteints de COVID-19. (Adaptation du protocole original de la KULeuven). Prise en charge a l’hopital des enfants atteints de COVID-19, 31.03.2020
http://gbs-vbs.org/fileadmin/user_upload/Unions/PED/Belg_Recomm_COVID_ped_31mar_FR.pdf
91. The International Society of Blood Transfusion (ISBT). Points to consider in the preparation and transfusion of COVID-19 convalescent plasma
http://www.isbtweb.org/fileadmin/user_upload/Points_to_consider_in_the_preparation_of_COVID_convalescent_plasma_-_200331_ISBT_WP_GBS_Final.pdf
92. European Network for Health Technology Assessment (EUnetHTA). “Rolling Collaborative Review” of Covid-19 treatments. Favipiravir for the treatment of COVID-19. Proiect ID: RCR11. https://eunethta.eu/rcr11/
93. European Network for Health Technology Assessment (EUnetHTA). “Rolling Collaborative Review” of Covid-19 treatments. Tocilizumab for the treatment of COVID-19. Proiect ID: RCR03. https://eunethta.eu/rcr03/
94. European Network for Health Technology Assessment (EUnetHTA). “Rolling Collaborative Review” of Covid-19 treatments. Dexamethasone and other corticosteroids for the treatment of COVID-19. Project ID: RCR08. https://eunethta.eu/rcr08/
95. European Network for Health Technology Assessment (EUnetHTA). Rapid Collaborative Review. Dexamethasone for the treatment of hospitalised patients with COVID-19. Proiect ID: PTRCR18. https://eunethta.eu/ptrcr18/
96. European Network for Health Technology Assessment (EUnetHTA). “Rolling Collaborative Review” of Covid-19 treatments. Convalescent Plasma Therapy for the treatment of Covid- 19. Project ID: RCR01. https://eunethta.eu/rcr01/
97. European Network for Health Technology Assessment (EUnetHTA). Rapid Collaborative Review. Remdesivir for hospitalised patients with COVID-19. Project ID: PTRCR15. https://eunethta.eu/ptrcr15/
98. U.S. National Institutes of Health. The COVID-19 Treatment Guidelines Panel’s Statement on the Use of Tocilizumab for the Treatment of COVID-19, 05.03.2021 https://www.covid19treatmentguidelines.nih.gov/statement-on-tocilizumab/
99. United Kingdom National Health Service (NHS). Interim Clinical Commissioning Policy: Tocilizumab for hospitalised patients with COVID-19 pneumonia (adults), 22.02.2021 https://www.england.nhs.uk/coronavirus/wp-content/uploads/sites/52/2021/02/C1143- interim-clinical-commissioning-policy-tocilizumab-rps-v2.pdf
100. National Institute for Health and Care Excellence (NICE). COVID-19 rapid guideline: Managing COVID-19, 25.03.2021. https://app.magicapp.Org/#/guideline/L4Qb5n/section/jb45gn
1. World Health Organization (WHO) Off-label use of medicines for COVID-19, 31.03.2020. https://www.who.int/news-room/commentaries/detail/off-label-use-of-medicines-for-covid-19
2. World Health Organization (WHO). Clinical management of COVID-19, 27.05.2020. https://www.who.int/publications-detail/clinical-management-of-covid-19
3. World Health Organization (WHO). Living guidance «Corticosteroids for COVID-19», 02.09.2020. https://www.who.int/publications/i/item/WHO-2019-nCoV-Corticosteroids-2020.1
3. World Health Organization (WHO). COVID-19 Clinical management: living guidance, 25.01.2021. https://www.who.int/publications/i/item/WHO-2019-nCoV-clinical-2021-1
4. World Health Organization (WHO). Living guidance «Corticosteroids for COVID-19», 02.09.2020.
https://www.who.int/publications/i/item/WHO-2019-nCoV-Corticosteroids-2020.1
5. World Health Organization (WHO). Living guidance «Therapeutics and COVID-19: living guideline», 17.12.2020.
https://www.who.int/publications/i/item/therapeutics-and-covid-19-living-guideline
6.4. Всесвітня організація охорони здоров’я (ВООЗ). Клінічна допомога при важкій гострій респіраторній інфекції: інструментарій. Адаптовано до COVID-19. https://apps.who.int/iris/bitstream/handle/10665/333001/WHO-2019-nCoV-SARI-toolkit-2020.1-ukr.pdf?sequence=1&isAllowed=y
7.5. World Health Organization (WHO). Tackling antimicrobial resistance in the COVID-19 pandemic https://www.who.int/bulletin/volumes/98/7/20-268573/en/#:~:text=The%20guidance%20does%20not%20recommend,of%20a%20bacterial%20infection%20exist.
2. European Medicines Agency (EMA) Update on treatments and vaccines against COVID-19 under development, 31.03.2020. https://www.ema.europa.eu/en/news/update-treatments- vaccines-against-covid- 19-under-development
3.6. European Medicines Agency (EMA) COVID-19: chloroquine and hydroxychloroquine only to be used in clinical trials or emergency use programmes, 01.04.2020. https://www.ema.europa.eu/en/news/covid-19-chloroquine-hydroxychloroquine-only-be-used-clinical-trials-emergency-use-programmes
4.8.7. European Medicines Agency (EMA) provides recommendations on compassionate use of remdesivir for COVID-19, 03.04.2020.
https://www.ema.europa.eu/en/news/ema-provides-recommendations-compassionate-use-remdesivir-covid-19
5.9.8. European Medicines Agency (EMA) Summary on compassionate use Remdesivir, 03.04.2020. https://www.ema.europa.eu/en/documents/other/summary-compassionate-use- remdesivir-gilead_en.pdf
6.10.9. EMA recommends expanding remdesivir compassionate use to patients not on mechanical ventilation, 11.05.2020. https://www.ema.europa.eu/en/news/ema-recommends-expanding-remdesivir-compassionate-use-patients-not-mechanical-ventilation
7.11.10. European Medicines Agency (EMA). First COVID-19 treatment Remdesivir recommended for EU authorisation, 25.06.2020. https://www.ema.europa.eu/en/news/first-covid-19-treatment-recommended-eu-authorisation
8.12.11. European Medicines Agency (EMA). Summary of product characteristics of Veklury (remdesivir) https://www.ema.europa.eu/en/medicines/human/EPAR/veklury
9.6.13.12. European Medicines Agency (EMA) EU authorities agree new measures to support availability of medicines used in the COVID-19 pandemic, 06.04.2020: https://www.ema.europa.eu/en/news/eu-authorities-agree-new-measures-support-availability-medicines-used-covid- 19-pandemic
10.7.14.13. European Medicines Agency (EMA) Compassionate use
https://www.ema.europa.eu/en/human-regulatory/research-development/compassionate-use
11.15.14. U.S. Food and Drug Administration (FDA). FDA issued an emergency use authorization for the investigational antiviral drug remdesivir for the treatment of suspected or laboratory-confirmed COVID-19 in adults and children hospitalized with severe disease, 01.05.2020. https://www.fda.gov/media/137564/download
16.15. U.S. Food and Drug Administration (FDA). FDA Approves First Treatment for COVID-19 Veklury (remdesivir), 22.10.2020. https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/214787Orig1s000lbl.pdf
12.17.16. ІВUS. Food and Drug Administration (FDA). Fact sheet for health care providers emergency use authorization (EUA) of remdesivir (GS-5734™)
https://www.fda.gov/media/137566/download
13.8.17. U.S. Food and Drug Administration (FDA) Emergency Use Authorization (EUA) of chloroquine phosphate and hydroxychloroquine sulfate for treatment of COVID-19, 28.03.2020. https://www.fda.gov/media/136534/download
14.18. U.S. Food and Drug Administration (FDA). FDA Revokes Emergency Use Authorization for Chloroquine and Hydroxychloroquine, 15.06.2020. https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-use-authorization-chloroquine-and
15.9.19. U.S. Food and Drug Administration (FDA) Expanded Access. https://www.fda.gov/news- events/public-health-focus/expanded-access
16.20. U.S. Food and Drug Administration (FDA). FDA Warns of Newly Discovered Potential Drug Interaction That May Reduce Effectiveness of a COVID-19 Treatment Authorized for Emergency Use (co-administration of remdesivir and chloroquine phosphate or hydroxychloroquine sulfate is not recommended), 15.06.2020 https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-warns-newly-discovered-potential-drug-interaction-may-reduce
21. U.S. Food and Drug Administration (FDA). Expanded Access to Convalescent Plasma for the Treatment of Patients with COVID-19, 03.08.2020 https://www.uscovidplasma.org/-/media/kcms/gbs/patient-consumer/documents/2020/05/27/21/23/covid-19-plasma-eap.pdf
22. U.S. Department of Health and Human Services. Coronavirus Disease 2019 (COVID-19). Treatment Guidelines https://files.covid19treatmentguidelines.nih.gov/guidelines/covid19treatmentguidelines.pdf
17.10.23. Interim clinical guidance for adults with suspected or confirmed COVID- 19 in Belgium https://epidemio.wiv-isp.be/ID/Documents/Covid19/COVID-19_InterimGuidelines_Treatment_ENG.pdf
18.11.24. Recommandations pour le traitement des enfants atteints de COVID-19 Belgian Pediatric Covid-19 Task Force (Adaptation du protocole original de la KULeuven http://gbs- vbs.org/fileadmin/user_upload/Unions/PED/Belg_Recomm_COVID_ped_31mar_FR.pdf.
19.12.25. French legal order. Decree No. 2020-314 of March 25, 2020 supplementing Decree No. 2020-293 of March 23, 2020 prescribing the general measures necessary to deal with the COVID-19 epidemic in the context of the state of health emergency.
https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000041755775&categorieLien=id
13. Office for Registration of Medicinal Products, Medical Devices and Biocidal Products of Poland. Information on product information sheets for the product Arechin (Chloroquini phosphas), 250 mg, tablets, 14.03.2020. http://urpl.gov.pl/pl/informacja-w-sprawie- druk%C3%B3w-informacyjnych-do-produktu-arechin-chloroquini-phosphas-250-mg-tabletki#
14. World Health Organization (WHO) Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected (13.03.2020): https://www.who.int/publications-detail/clinical-management-of-severe-acute-respiratory-infection-when-novel-coronavirus-(ncov)-infection-is-suspected
20.26. World Health Organization (WHO). Targeted Update: Safety and efficacy of hydroxychloroquine or chloroquine for treatment of COVID-19, 17.06.2020 https://www.who.int/publications/m/item/targeted-update-safety-and-efficacy-of-hydroxychloroquine-or-chloroquine-for-treatment-of-covid-19
21.27. World Health Organization (WHO). Hydroxychloroquine (HCQ) arm of the Solidarity Trial to find an effective COVID-19 treatment was being stopped, 17.06.2020: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-clinical-trial-for-covid-19-treatments
22.15.28. Centers for Disease Control and Prevention (CDC) Interim Clinical Guidance for Management of Patients with Confirmed Coronavirus Disease (COVID-19). https://www.cdc.gov/coronavirus/2019-ncov/hcp/clinical-guidance-management-patients.html
23.16.29. CDC Information for Clinicians on Therapeutic Options for COVID-19 Patients. https://www.cdc.gov/coronavirus/2019-ncov/hcp/therapeutic-options.html
24.30. U. S. National Institutes of Health. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines https://www.covid19treatmentguidelines.nih.gov/whats-new/
25.31. Infectious Diseases Society of America. Guidelines on the Treatment and Management of Patients with COVID-19. https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management
32. Polish Association of Epidemiologists and Infectiologists. Management of SARS-CoV-2 infection: recommendations of the Polish Association of Epidemiologists and Infectiologists. Annex no. 2 as of October 13, 2020 https://www.mp.pl/paim/issue/article/15658
26.17.33. Austrian Society for Internistic and General Intensive Care Medicine and Emergency Medicine, ÖGARI). ICU Therapy guideline for the treatment of patients with a SARS CoV2 infection, 29.03.2020 https://www.anaesthesie.news/wp-content/uploads/%C3%96GARI- FASIM-%C3%96GIAIN-Guideline-NEU-Covid19-290320.pdf
27.18.34. Сhina National Health Commission of the People’s Republic of China. Diagnosis and Treatment Protocol for COVID-19 Patients (Trial Version 8). http://en.nhc.gov.cn/2020-09/07/c_81565.htm
China National Health Commission. Diagnosis and Treatment Protocol for Novel Coronavirus Pneumonia (Trial Version 7), https://www.chinadaily.com.cn/pdf/2020/1.Clinical.Protocols.for.the.Diagnosis.and.Treatment.of.COVID-19.V7.pdf
03.03.2020: https://www.chinadaily.com.cn/pdf/2020/1.Clinical.Protocols.for.the.Diagnosis. and.Treatment.of.COVID-19.V7.pdf
28.19. 35. Chinese Centre for Disease Control and Prevention). Diagnosis and treatment. COVID-19 Prevention and Control, 2020:
http://www.chinacdc.cn/en/COVID19/202002/P020200310326343385431.pdf
29.20.36. Circolare del ministero con raccomandazioni per persone immunodepresse: Raccomandazioni per la gestione dei pazienti immunodepressi residenti nel nostro Paese in corso di emergenza da COVID-19,
http://www.trovanorme.salute.gov.it/norme/renderNormsanPdf?anno=2020&codLeg=73753&parte=1%20&serie=null
30.21.37. Lietuvos Respublikos sveikatos apsaugos ministro 2020 m. kovo 17 d. įsakymu Nr. V-383: SUAUGUSIŲJŲ COVID-19 LIGOS (KORONAVIRUSO INFEKCIJOS) DIAGNOSTIKOS IR GYDYMO TVARKOS APRAŠAS) http://sam.lrv.lt/uploads/sam/documents/files/COVID-19_dgn%20ir%20gydymo%20aprasas%20SUVESTINIS.pdfLietuvos Respublikos sveikatos apsaugos ministro 2020 m. kovo 17 d. jsakymu Nr. V-383: SUAUGUSIVJV COVID-19 LIGOS (KORONAVIRUSO INFEKCIJOS) DIAGNOSTIKOS IR GYDYMO TVARKOS APRASAS)
http://sam.lrv.lt/uploads/sam/documents/files/COVID-19_dgn%20ir%20gydymo%20aprasas%20SUVESTINIS.pdf
31.22.38. Protocole pour la prise en charge de Patients ayant une infection COVID-19 confirmёe ou suspectee, CONSEIL SUPERIEUR DES MALADIES INFECTIEUSES https://sante.public.lu/fr/espace-professionnel/recommandations/direction-sante/000-covid- 19/index.html
32.23.39. De Stichting Werkgroep Antibiotica Beleid (SWAB). Medicamenteuze behandelopties bij patiёnten met COVID-19 (infecties met SARS-CoV-2), De Stichting Werkgroep Antibiotica Beleid (SWAB) https://swab.nl/nl/covid-19
40. Center for Disease Prevention and Control of the Republic of Latvia. REKOMENDACIJAS SARS-CoV-2 infekcijas un COVID-19 epidemiologija, diagnostika, kliniskas norises un komplikacijas, 2021
https://www.spkc.gov.lv/sites/spkc/files/media_file/covid_19_rekomendacijas_marts-gatavs-1.pdf
41. Agencia Espanola de Medicamentos y Productos Sanitarios (AEMPS). Tratamientos disponibles para el manejo de la infection respiratoria por SARS-CoV-2
33.24.40. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Tratamientos disponibles para el manejo de la infection respiratoria por SARS-CoV-2 (AEMPS) https://www. aemps. gob. es/la-aemps/ultima-informacion-de-la-aemp s-acerca-del- covid%E2%80%9119/tratamientos-disponibles-para-el-maneio-de-la-infeccion-respiratoria-por-sars-cov-2/
34.25.AvuuKa фарцака каї Ospantia acOsvtiv цє /ошо/п ano то vso королоїо SARS-CoV-2 14 Мартюи 2020, 41. National Public Health Organization, NPHO, Ministry of Health of Greece. Αντιιϊκά φάρμακα και θεραπεία ασθενών με λοίμωξη από το νέο κορωνοϊό SARS-CoV-2: https://eody.gov.gr/wp-content/uploads/2020/03/covid-19-odigies-therapeias.pdf
35.26.42. The First Affiliated Hospital, Zhejiang University School of Medicine. Handbook of COVID-19 Prevention and Treatment, 2020: https://covid-19.alibabacloud.com/
36.43. Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVID-19). https://www.esicm.org/wp-content/uploads/2020/03/SSC-COVID19-GUIDELINES.pdf
37.44. Ministry of Health, labour and Welfare of Japan. Clinical Management of Patients with COVID-19. A guide for front-line healthcare workers (Version 2.1). https://www.mhlw.go.jp/content/000646531.pdf
38.45. Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. A trial of Lopinavir-ritonavir in adults hospitalized with severe Covid-19. N Engl J Med. 2020. https://doi.org/10.1056/NEJMoa2001282. https://www.nejm.org/doi/full/10.1056/NEJMoa2001282
27. Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al.A Trial of Lopinavir- Ritonavir in Adults Hospitalized with Severe Covid-19. N Engl J Med 2020; :NEJMoa2001282 https://www.nejm.org/doi/full/10.1056/NEIMoa2001282
39.46. Goldman JD, Lye DCB, Hui DS, Marks KM, Bruno R, Montejano R, et al. Remdesivir for 5 or 10 days in patients with severe Covid-19. N Engl J Med. (2020). doi: 10.1056/NEJMoa2015301. https://www.nejm.org/doi/full/10.1056/NEJMoa2015301?query=featured_coronavirus
40.47. Wang Y, Zhang D, Du G, et al. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet (2020);395:1569-1578. doi: 10.1016/S0140-6736(20)31022-9 https://www.thelancet.com/pdfs/journals/lancet/PIIS0140-6736(20)31022-9.pdf
41.48. J. H. Beigel, K.M. Tomashek, L.E. Dodd, A.K. Mehta, B.S. Zingman, A.C. Kalil, et al. Remdesivir for the treatment of covid-19—preliminary report. N Engl J Med (2020) https://doi.org/10.1056/netjmoa2007764 https://www.nejm.org/doi/full/10.1056/NEJMoa2007764?source=nejmfacebook&medium=organic-social&fbclid=IwAR1nvgVskaoitXDSLCA6YfMC-bhn80A5XtLQyo0HCaJhxlEdld1Nd6opDK0#article_citing_articles
42.49. Statement from the Chief Investigators of the Randomised Evaluation of COVid-19 thERapY (RECOVERY) Trial on lopinavir-ritonavir, 29.06.2020 https://www.recoverytrial.net/files/lopinavir-ritonavir-recovery-statement-29062020_final.pdf
43.50. Statement from the Chief Investigators of the Randomised Evaluation of COVid-19 thERapY (RECOVERY) Trial on hydroxychloroquine, 5.06.2020 https://www.recoverytrial.net/files/hcq-recovery-statement-050620-final-002.pdf
44.51. RETRACTED: Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31180-6/fulltext?fbclid=IwAR0unXed9JIjtou-tTSC8iM3NBoXQRYdslK34VZZgiuNxmKE3FSc3Fo9z5A#section-3d6acba1-acea-4be2-8dc9-b7e14e5b6583
45.52. Cai, Q. et al. Experimental treatment with Favipiravir for COVID‐19: an open‐label control study. Engineering. https://doi.org/10.1016/j.eng.2020.03.007 https://www.sciencedirect.com/science/article/pii/S2095809920300631
46.53. Yohei D et al. Preliminary Report of the Favipiravir Observational Study in Japan http://www.kansensho.or.jp/uploads/files/topics/2019ncov/covid19_casereport_en_200529.pdf
47.54. Uno studio randomizzato multicentrico in aperto per valutare l’efficacia della somministrazione precoce del Tocilizumab (TCZ) in pazienti affetti da polmonite da COVID-19, 17.06.2020 https://www.aifa.gov.it/documents/20142/1123276/studio_RE_Toci_17.06.2020.pdf/c32ed144-ce26-d673-6e4d-11d5d0d84836
48.55. American Society of Health-System Pharmacists (ASFP). Assessment of Evidence for COVID-19-Related Treatments https://www.ashp.org/-/media/assets/pharmacy-practice/resource-centers/Coronavirus/docs/ASHP-COVID-19-Evidence-Table.ashx
49.28.56. Interactions with Experimental COVID-19 Therapies https://www.covid19- druginteractions.org/
57. Belgian Society on Thrombosis and Haemostasis (BSTH). Anticoagulation management in COVID-19 positive patients BSTH consensus guideline https://covid-19.sciensano.be/sites/default/files/Covid19/COVID-19_Anticoagulation_Management.pdf
58. Brigham and Women’s Hospital COVID-19 Clinical Guidelines. Thrombotic Disease. https://covidprotocols.org/protocols/hematology/#thrombotic-disease
59. COVID‐19 anticoagulation recommendations in children, 18.06.2020 https://onlinelibrary.wiley.com/doi/10.1002/pbc.28485
60. Thromboembolism and anticoagulant therapy during the COVID-19 pandemic: interim clinical guidance from the anticoagulation forum, 21.05.2020 https://link.springer.com/article/10.1007/s11239-020-02138-z
61. Groupe d’intérêt en Hémostase Périopératoire (GIHP) and the Groupe Français d’études sur l’Hémostase et la Thrombose (GFHT). Prevention of thrombotic risk in hospitalized patients with COVID-19 and hemostasis monitoring, 19.06.2020 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7303590/
62. Rawson T. et al. Bacterial and fungal co-infection in individuals with coronavirus: A rapid review to support COVID-19 antimicrobial prescribing, 02.05.2020 https://pubmed.ncbi.nlm.nih.gov/32358954/
63. National Institute for Health and Care Excellence (NICE). COVID-19 rapid guideline: antibiotics for pneumonia in adults in hospital, 01.05.2020 https://www.nice.org.uk/guidance/ng173
64. British Paediatric Society. Guidance for the clinical management of children admitted to hospital with suspected COVID-19 https://www.rcpch.ac.uk/sites/default/files/2020-03/bprs_management_of_children_admitted_to_hospital_with_covid19_-_20200319.pdf
65. Efficacy and safety of antibiotic agents in children with COVID-19: a rapid review, 08.05.2020 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7290645/
66. The Management of Community-Acquired Pneumonia in Infants and Children Older Than 3 Months of Age: Clinical Practice Guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America https://academic.oup.com/cid/article/53/7/e25/424286#74161858
67. The acute management of paediatric coronavirus disease 2019 (COVID-19), 20.04.2020 https://www.cps.ca/en/documents/position/the-acute-management-of-paediatric-coronavirus-disease-2019covid-19
68. Coronavirus disease 2019 (COVID-19): Management in children, 14.09.2020 https://www.uptodate.com/contents/coronavirus-disease-2019-covid-19-management-in-children
69. HSE Interim Guidance for the use of Tocilizumab in the Management of Patients who have Severe COVID-19 with Suspected Hyperinflammation, 02.09.2020 https://www.hse.ie/eng/about/who/acute-hospitals-division/drugs-management-programme/interim-recommendations-for-the-use-of-tocilizumab-in-the-management-of-patients-who-have-severe-covid-19-with-suspected-hyperinflammation-version-4.pdf
70. HSE Interim Guidance for the Use of Antiviral Therapy in the Clinical Management of Acute Respiratory Infection with SARS-CoV-2 (COVID-19). Version number: 5.0, 09.09.2020: https://www.hse.ie/eng/about/who/acute-hospitals-division/drugs-management-programme/specific-antiviral-therapy-in-the-clinical-management-of-acute-respiratory-infection-with-sars-cov2-covid19.pdf
71. HSE Interim Guidance for the use of Systemic Corticosteroids in the Management of Hospitalised Patients with Severe COVID-19 Disease, 17.09.2020 https://www.hse.ie/eng/about/who/acute-hospitals-division/drugs-management-programme/hse-interim-guidance-for-the-use-of-systemic-corticosteroids-in-the-management-of-hospitalised-patients-with-severe-covid-19-disease.pdf
72. HSE Rapid Evidence Review. Clinical evidence for the use of intravenous immunoglobulin in the treatment of COVID19. Version 2, 14.05.2020 https://www.hse.ie/eng/about/who/acute-hospitals-division/drugs-management-programme/evidence-review-group-for-medicines-rer-intravenous-immunoglobulin-in-the-treatment-of-covid19-version-1.pdf
73. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America https://www.atsjournals.org/doi/full/10.1164/rccm.201908-1581ST
74. National Centre for Pharmacoeconomics (NCPE), Medicines Management Programme (MMP), the National Medicines Information Centre (NMIC). Clinical evidence for the use of intravenous immunoglobulin in the treatment of COVID-19, 14.05.2020
http://www.ncpe.ie/wp-content/uploads/2020/05/Intravenous-immunoglobulin-for-the-treatment-of-COVID-19-A-Rapid-Evidence-Review-V2.pdf
75. Ständiger Arbeitskreis der Kompetenz- und Behandlungszentren für Krankheiten durch hochpathogene Erreger am Robert Koch-Institut, STAKOB. Hinweise zu Erkennung, Diagnostik und Therapie von Patienten mit COVID-19», 09.10.2020 https://www.rki.de/DE/Content/Kommissionen/Stakob/Stellungnahmen/Stellungnahme-Covid-19_Therapie_Diagnose.pdf;jsessionid=B252C67B9CC8E7B4BC530A7EA2D09F5B.internet102?__blob=publicationFile
76. Australian National COVID-19 Clinical Evidence Taskforce. Australian guidelines for the clinical care of people with COVID-19 https://app.magicapp.org/#/guideline/4550
77. National Centre for Infectious Diseases (NCID) Singapore. Interim Treatment Guidelines for COVID-19. Version 4.0, dated 31 August 2020. https://www.ncid.sg/Documents/Interim%20Treatment%20Guidelines%20for%20COVID-19%20v4%20%2831%20Aug%202020%29-%20final.docx%20for%20upload.pdf
78. Centers for Disease Control and Prevention (CDC). Multisystem Inflammatory Syndrome in Children (MIS-C) Associated with Coronavirus Disease 2019 (COVID-19). https://emergency.cdc.gov/han/2020/han00432.asp
79. Royal College of Paediatrics and Child Health. Paediatric multisystem inflammatory syndrome temporally associated with COVID-19 (PIMS). 01.05.2020 https://www.rcpch.ac.uk/resources/paediatric-multisystem-inflammatory-syndrome-temporally-associated-covid-19-pims-guidance
80. American College of Rheumatology. Clinical Guidance for Pediatric Patients with Multisystem Inflammatory Syndrome in Children (MIS-C) Associated with SARS-CoV-2 and Hyperinflammation in COVID-19, 23.07.2020 https://www.rheumatology.org/Portals/0/Files/ACR-COVID-19-Clinical-Guidance-Summary-MIS-C-Hyperinflammation.pdf
81. American Academy of Pediatrics. Multisystem Inflammatory Syndrome in Children (MIS-C) Interim Guidance. https://services.aap.org/en/pages/2019-novel-coronavirus-covid-19-infections/clinical-guidance/multisystem-inflammatory-syndrome-in-children-mis-c-interim-guidance/
82. A national consensus management pathway for paediatric inflammatory multisystem syndrome temporally associated with COVID-19 (PIMS-TS): results of a national Delphi process, 18.09.2020 https://www.thelancet.com/journals/lanchi/article/PIIS2352-4642(20)30304-7/fulltext#%20
83. The International Society of Blood Transfusion (ISBT). Points to consider in the preparation and transfusion of COVID-19 convalescent plasma http://www.isbtweb.org/fileadmin/user_upload/Points_to_consider_in_the_preparation_of_COVID_convalescent_plasma_-_200331_ISBT_WP_GBS_Final.pdf
83.The British Paediatric Allergy, Immunity and Infection Group (BPAIIG). Position Statement: Management of novel coronavirus (SARS-CoV-2) infection in paediatric patients in the UK and Ireland, 17.04.2020.
https://www.bpaiig.org/sites/default/files/National_paediatric_COVID19%20treatment%20v1.2_0.pdf
84.Belgian Pediatric Covid-19 Task Force. Recommandations pour le traitement des enfants atteints de COVID-19. (Adaptation du protocole original de la KULeuven). Prise en charge à l’hôpital des enfants atteints de COVID-19, 31.03.2020
http://gbs-vbs.org/fileadmin/user_upload/Unions/PED/Belg_Recomm_COVID_ped_31mar_FR.pdf
85.The International Society of Blood Transfusion (ISBT). Points to consider in the preparation and transfusion of COVID-19 convalescent plasma
http://www.isbtweb.org/fileadmin/user_upload/Points_to_consider_in_the_preparation_of_COVID_convalescent_plasma_-_200331_ISBT_WP_GBS_Final.pdf
1. Interim clinical guidance for adults with suspected or confirmed COVID- 19 in Belgium
2. Liu Y, Yan L-M, Wan L, Xiang T-X, Le A, Liu J-M, et al.Viral dynamics in mild and severe cases of COVID-19. The Lancet Infectious Diseases2020; 0. doi:10.1016/S1473- 3099(20)30232-2
3. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al.Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet Published Online First: 11 March 2020. doi:10.1016/S0140-6736(20)30566-3
4. Agostini ML, Andres EL, Sims AC, Graham RL, Sheahan TP, Lu X, et al.Coronavirus Susceptibility to the Antiviral Remdesivir (GS-5734) Is Mediated by the Viral Polymerase and the Proofreading Exoribonuclease. mBio 2018; 9. doi:10.1128/mBio.00221-184 Sheahan TP, Sims AC, Graham RL, Menachery VD, Gralinski LE, Case JB, et al.Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses. Sci Transl Med 2017; 9:eaal3653.
5. Sheahan TP, Sims AC, Leist SR, Schäfer A, Won J, Brown AJ, et al.Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Commun 2020; 11:222.
6. Gordon CJ, Tchesnokov EP, Feng JY, Porter DP, Gotte M. The antiviral compound remdesivir potently inhibits RNA-dependent RNA polymerase from Middle East respiratory syndrome coronavirus. J Biol Chem 2020; :jbc.AC120.013056.
7. Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al.Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Research 2020; :1–3.
8. Brown AJ, Won JJ, Graham RL, Dinnon KH, Sims AC, Feng JY, et al.Broad spectrum antiviral remdesivir inhibits human endemic and zoonotic deltacoronaviruses with a highly divergent RNA dependent RNA polymerase. Antiviral Res 2019; 169:104541.
9. Vincent MJ, Bergeron E, Benjannet S, Erickson BR, Rollin PE, Ksiazek TG, et al.Chloroquine is a potent inhibitor of SARS coronavirus infection and spread. Virology Journal 2005; 2:69.
10. Keyaerts E, Vijgen L, Maes P, Neyts J, Van Ranst M. In vitro inhibition of severe acute respiratory syndrome coronavirus by chloroquine. Biochem Biophys Res Commun2004; 323:264–268.
11. De Wilde AH, Jochmans D, Posthuma CC, Zevenhoven-Dobbe JC, van Nieuwkoop S, Bestebroer TM, et al.Screening of an FDA-Approved Compound Library Identifies Four Small-Molecule Inhibitors of Middle East Respiratory Syndrome Coronavirus Replication in Cell Culture. Antimicrob Agents Chemother 2014; 58:4875–4884.
12. Barnard DL, Day CW, Bailey K, Heiner M, Montgomery R, Lauridsen L, et al.Evaluation of immunomodulators, interferons and known in vitro SARS-coV inhibitors for inhibition of SARS-coV replication in BALB/c mice. Antivir Chem Chemother 2006; 17:275–284.
13. Multicenter collaboration group of Department of Science and Technology of Guangdong Province and Health Commission of Guangdong Province for chloroquine in the treatment of novel coronavirus pneumonia. [Expert consensus on chloroquine phosphate for the treatment of novel coronavirus pneumonia]. Zhonghua Jie He He Hu Xi Za Zhi 2020; 43:E019.
14. Biot C, Daher W, Chavain N, Fandeur T, Khalife J, Dive D, et al.Design and Synthesis of Hydroxyferroquine Derivatives with Antimalarial and Antiviral Activities. J Med Chem 2006; 49:2845–2849.
15. Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, et al.In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Clin Infect Dis Published Online First: 9 March 2020. doi:10.1093/cid/ciaa237
16. Gautret P, Lagier J-C, Parola P, Hoang VT, Meddeb L, Mailhe M, et al.Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open- label non-randomized clinical trial. International Journal of Antimicrobial Agents 2020; :105949.
17. Chen F, Chan KH, Jiang Y, Kao RYT, Lu HT, Fan KW, et al.In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds. J Clin Virol2004; 31:69–75.
18. Yamamoto N, Yang R, Yoshinaka Y, Amari S, Nakano T, Cinatl J, et al.HIV protease inhibitor nelfinavir inhibits replication of SARS-associated coronavirus. Biochem Biophys Res Commun2004; 318:719–725.
19. Chu CM, Cheng VCC, Hung IFN, Wong MML, Chan KH, Chan KS, et al.Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings. Thorax 2004; 59:252–256.
20. Chan JFW, Chan K-H, Kao RYT, To KKW, Zheng B-J, Li CPY, et al.Broad-spectrum antivirals for the emerging Middle East respiratory syndrome coronavirus. Journal of Infection2013; 67:606–616.
21. Chan JF-W, Yao Y, Yeung M-L, Deng W, Bao L, Jia L, et al.Treatment With Lopinavir/Ritonavir or Interferon-β1b Improves Outcome of MERS-CoV Infection in a Nonhuman Primate Model of Common Marmoset. J Infect Dis 2015; 212:1904–1913.
22. The Efficacy of Lopinavir Plus Ritonavir and Arbidol Against Novel Coronavirus Infection
– Full Text View — ClinicalTrials.gov. https://clinicaltrials.gov/ct2/show/NCT04252885 (accessed 24 Mar2020).
23. Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al.A Trial of Lopinavir– Ritonavir in Adults Hospitalized with Severe Covid-19. N Engl J Med 2020;
:NEJMoa2001282.
24. Dobson J, Whitley RJ, Pocock S, Monto AS. Oseltamivir treatment for influenza in adults: a meta-analysis of randomised controlled trials. The Lancet 2015; 385:1729–1737.
25. Kamal MA, Gieschke R, Lemenuel-Diot A, Beauchemin CAA, Smith PF, Rayner CR. A Drug-Disease Model Describing the Effect of Oseltamivir Neuraminidase Inhibition on Influenza Virus Progression. Antimicrobial Agents and Chemotherapy 2015; 59:5388–5395.
26. Organization WH. Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected: interim guidance, 13 March 2020. Published Online First: 2020.https://apps.who.int/iris/handle/10665/331446 (accessed 16 Mar2020).
27. Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet 2020; 395:473–475.
28. Schwartz DA. An Analysis of 38 Pregnant Women with COVID-19, Their Newborn Infants, and Maternal-Fetal Transmission of SARS-CoV-2: Maternal Coronavirus Infections and Pregnancy Outcomes. Arch Pathol Lab MedPublished Online First: 17 March 2020. doi:10.5858/arpa.2020-0901-SA
29. Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al.Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. The Lancet 2020; 395:809–815.
30. Qiao J. What are the risks of COVID-19 infection in pregnant women?The Lancet 2020; 395:760–762.
31. CDC. Coronavirus Disease 2019 (COVID-19). Centers for Disease Control and Prevention. 2020.https://www.cdc.gov/coronavirus/2019-ncov/prepare/children.html (accessed 24 Mar2020).
32. Dong Y, Mo X, Hu Y, Qi X, Jiang F, Jiang Z, et al.Epidemiological Characteristics of 2143 Pediatric Patients With 2019 Coronavirus Disease in China. Pediatrics 2020; :e20200702.
33. CDC. Coronavirus Disease (COVID-19) and Breastfeeding. Centers for Disease Control and Prevention.
2020. https://www.cdc.gov/breastfeeding/breastfeeding-special-circumstances/maternal-or — infant-illnesses/covid-19-and-breastfeeding.html (accessed 24 Mar2020)
34. Lu X, Zhang L, Du H, Zhang J. SARS-CoV-2 InfectioninChildren. N Engl J Med. 2020 Mar 18. doi: 10.1056/NEJMc2005073.
35. Zimmermann P, Nigel C. Coronavirus Infectionsin Children Including COVID-19 An Overview of the Epidemiology, Clinical Features, Diagnosis, Treatmentand Prevention Options in Children. The Pediatric Infectious Disease Journal: March 12, 2020, doi: 10.1097/INF.0000000000002660.
Додаток
до Протоколу «Надання медичної допомоги для лікування коронавірусної хвороби (COVID-19)»
ФОРМА
інформованої згоди пацієнта на проведення діагностики та лікування згідно з Протоколом «Наданняклінічним протоколом медичної допомоги для лікування коронавірусної хвороби «COVID-19»
|
Найменування міністерства, іншого органу виконавчої влади, підприємства, установи, організації, до сфери управління якого належить заклад охорони здоров’я Найменування та місцезнаходження (повна поштова адреса) закладу охорони здоров’я, де заповнюється форма Код за ЄДРПОУ |
МЕДИЧНА ДОКУМЕНТАЦІЯ |
| ЗАТВЕРДЖЕНО
Наказ МОЗ України |
|
| _______________ №_________ |
| ІНФОРМОВАНА ДОБРОВІЛЬНА ЗГОДА ПАЦІЄНТАНА ПРОВЕДЕННЯ ДІАГНОСТИКИ, ЛІКУВАННЯ ЗГІДНО ІЗ
ПРОТОКОЛОМ «Надання медичної допомоги для лікування коронавірусної хвороби «COVID-19» КЛІНІЧНИМ ПРОТОКОЛОМ МЕДИЧНОЇ ДОПОМОГИ «COVID-19» Я, __________________________________________________________________________________________________________________, одержав(ла) у ___________________________________________________________________________________________________________________ (найменування закладу охорони здоров’я) інформацію про характер мого (моєї дитини) захворювання, особливості його перебігу, діагностики та лікування. Мені надано інформацію щодо можливості застосування Протоколу «Надання медичної допомоги для лікування коронавірусної хвороби «COVID-19»нового клінічного протоколу для проведення діагностики та лікування мого (моєї дитини) захворювання та роз’яснено особливості застосування лікарських засобів.різницю між уніфікованим та новим клінічним протоколом. Засвідчую свою згоду на застосування Протоколу «Надання медичної допомоги для лікування коронавірусної хвороби «COVID-19»нового клінічного протоколу _________________________________________________________________ (назва нового клінічного протоколу) (підпис)_________________________ПІБ_______________________________ Я ознайомлений(а) з планом обстеження і лікування. Отримав(ла) в повному обсязі роз’яснення про характер, мету, орієнтовну тривалість діагностично-лікувального процесу та про можливі несприятливі наслідки під час його проведення, про необхідність дотримання визначеного лікарем режиму в процесі лікування. Зобов’язуюсь негайно повідомляти лікуючого лікаря про будь-яке погіршення самопочуття (стан здоров’я дитини). Я проінформований(а), що недотримання рекомендацій лікуючого лікаря, режиму прийому призначених препаратів, безконтрольне самолікування можуть ускладнити лікувальний процес та негативно позначитися на стані здоров’я. Мені надали в доступній формі інформацію про ймовірний перебіг захворювання і наслідки у разі відмови від лікування. Я мав(ла) можливість задавати будь-які питання, які мене цікавлять, стосовно стану здоров’я, перебігу захворювання і лікування та одержав(ла) на них відповіді. Я погоджуюсь із використанням та обробкою моїх персональних даних за умови дотримання їх захисту відповідно до вимог Закону України «Про захист персональних даних». Інформацію надав лікар _________________ «____» ___________ 20___ року _____________ (П.І.Б.) (дата) (підпис) Я, _______________________________________, згодний(а) із запропонованим планом лікування |
|
______________________ (підпис) |
«____»________________________ 20___ року (дата) |

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим