С тех пор как «высоко влиятельный респираторный патоген» стал частью нашей действительности, с возникшими вызовами невозможно справляться без систем лабораторной диагностики. Именно с ними связывают свой успех страны, успешно контролирующие вспышку COVID-19: Китай, Южная Корея и др. Экспертами из США массовое тестирование также рассматривается как один из «ключей к успеху» в амбициозной попытке за 10 нед переломить кривую роста заболеваемости (Fineberg H.V., 2020). «Больше тестов — больше открытость экономики», — приводит «New York Times» высказывание одного из официальных лиц одноименного штата. Недавно количество проводимых здесь тестов увеличилось до 100 тыс. в день. Помимо выявления РНК вируса в организме, долговременное планирование противоэпидемических мероприятий также собираются проводить при помощи лабораторной оценки популяционного иммунитета к COVID-19. Масса производителей выразили готовность удовлетворить растущий спрос, при этом за короткий срок выполнить в достаточной степени требования регуляторов не представлялось возможным. В такой ситуации и в Европе, и в США согласились допускать на рынок тесты, полагаясь, по большей части, на декларации самих производителей. Однако возникающие проблемы с качеством вызывают необходимость пересмотра данного временного подхода.
Типы тестов и их валидация в ЕС
Европейская комиссия подготовила рабочий документ, в котором предлагается предварительное определение критериев качества средств для диагностики COVID-19 (European Commission, 2020). Как отмечено в документе, тесты, используемые при COVID-19, можно разделить на две группы:
1. Призванные выявить наличие самого вируса (РНК и антигенов); их применяют с целью верификации диагноза COVID-19, для скрининга в критически важных целевых группах (медицинские работники) и проверки окончания выделения вируса излечившимися пациентами.
2. Выявляющие антитела против вируса SARS-CoV-2, то есть наличие или отсутствие иммунитета в результате продолжающегося или перенесенного заболевания.
Вышеназванный документ Европейской комиссии содержит указания на 78 тест-систем для выявления РНК вируса с маркировкой «СЕ» и задекларированной производителем хорошей производительностью, однако поскольку точные последовательности вирусной РНК, определяемые тестами, не разглашаются, специфичность многих из этих тестов находится под вопросом. Выявление антигенов используют, как правило, в целях экспресс-диагностики, однако метод пока недостаточно подтвержден с научной точки зрения. На сегодня только 13 антигенных тестов имеют маркировку СЕ. Относительно тестов для выявления антител пока не ясно, как конкретные тесты соотносятся с параметрами опубликованных протоколов исследований, отмечено в документе Европейской комиссии. Количество тестов, определяющих наличие антител, с маркировкой «СЕ» составляет 101.
Пригодность существующих иммунологических тестов еще продолжают изучать (беспокойство вызывает в основном возможность перекрестных реакций с другими типами коронавирусов). Как только будет уточнена адекватность данных методик, они станут важным компонентом стратегий деэскалации с отменой ограничений по мобильности и контактам для людей с доказанным иммунитетом, отмечено в свежих материалах Европейского центра предупреждения и контроля заболеваний (European Centre for Disease Prevention and Control, 2020).
Преквалификация ВОЗ
Всемирная организация здравоохранения (ВОЗ) на добровольной основе принимает от производителей тесты на экспертизу, регулярно публикуя на своем сайте отчеты о продвижении процедуры допуска к экстренному использованию (Emergency Use Listing Procedure — EUL). По состоянию на 24 апреля преквалификацию прошли 4 продукта для диагностики инфекции SARS-CoV-2 (табл. 1).
| Таблица 1 | Тесты для диагностики in vitro COVID-19, в отношении которых ВОЗ осуществила EUL (24.04.2020 г.; www.who.int) |
| Дата предоставления | Название продукта | Код продукта | Производитель |
| 3 апреля 2020 г. | Cobas SARS-CoV-2 Qualitative assay for use on the cobas 6800/8800 Systems | 09175431190 и 09175440190 |
Roche Molecular Systems, Inc. |
| 7 апреля 2020 г. | Primerdesign Ltd COVID-19 genesig Real-Time PCR assay |
Z-Path-COVID-19-CE | Primerdesign Ltd |
| 9 апреля 2020 г. | Abbott Realtime SARS-CoV-2 | 09N77-090 и 09N77-080 | Abbott Molecular Inc. |
| 24 апреля 2020 г. | PerkinElmer SARS-CoV-2 Real-time RT-PCR Assay |
SY580 | SYM-BIO LiveScience Co., Ltd |
Валидация от FIND
Основанный в мае 2003 г. на Всемирной ассамблее здравоохранения в Женеве, Фонд инновационной диагностики (Foundation for Innovative New Diagnostics — FIND), совместный проект ВОЗ, других некоммерческих организаций, поддерживаемых финансово Фондом Билла и Мелинды Гейтс, ведет интересный исследовательский проект по COVID-19. Его результаты, на которые ссылаются и в вышеупомянутом документе ECDC, публикуют на сайте FIND в том числе в виде дашборда (рисунок).
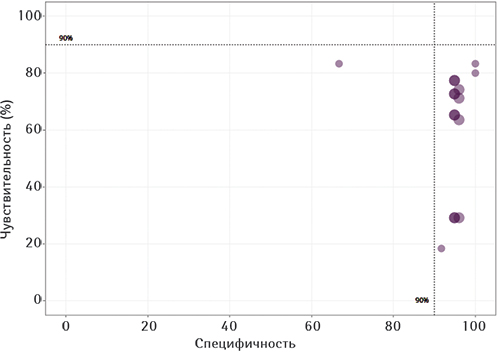
Оценки датской группы
Исследовательский коллектив из Дании опубликовал небольшой анализ 9 тестов, свидетельствующий, что, как и следовало ожидать, некоторые из них показывают лучшие результаты, чем другие (табл. 2). В него вошли как быстрые, так и выполняемые титрованием антител методом ферментного иммуносорбентного анализа (enzyme-linked immunosorbent assay — ELISA) тесты.
| Таблица 2 | Чувствительность и специфичность трех ELISA и шести быстрых тестов для выявления антител к коронавирусу нового типа (SARS-CoV-2) (Lassaunière R. et al., 2020) |
| Тесты ELISA | Wantai SARS-CoV-2 Total Antibody, % | Euroimmun IgA ELISA, % | Euroimmun IgG ELISA, % |
| Специфичность | 100 | 93 | 96 |
| Чувствительность | 90 | 90 | 65 |
| Быстрые тесты (от большего к меньшему) | |||
| AutoBio Diagnostics > Dynamiker Biotechnology = CTK Biotech > Artron Laboratories > Acro Biotech ≥ Hangzhou Alltest Biotech | |||
Неясности
Самые большие сомнения и трудности возникают с быстрыми тестами, особенно — для выявления антигенов вируса. По некоторым оценкам, их точность равна всего лишь 20%, что намного меньше, чем заявляют производители (Herman А.О., 2020). Так, в конце марта, получив первую партию из заказанных 640 тыс. наборов, власти Испании вернули их производителю — «Shenzhen Bioeasy Biotechnology» как не соответствующие спецификациям (www.euractiv.com). Ряд провайдеров из США также стали отдавать предпочтение более сложным методам лабораторного тестирования.
ВОЗ с 8 апреля рекомендует использовать новые иммунодиагностические тесты «только в исследовательских учреждениях» (www.who.int). Они не должны использоваться в любых других условиях, в том числе для принятия клинических решений, до тех пор, пока не появятся доказательства, поддерживающие их использование по конкретным показаниям. «Медицинский работник должен интерпретировать отрицательный результат с осторожностью и на основе клинического суждения», — отмечено в цитируемом документе ECDC. Одну из разновидностей быстрых тестов, нацеленную на выявление антигенов вируса, ВОЗ вообще не рекомендует использовать в практической деятельности, проводя аналогию с аналогичными тестами для выявления гриппозной инфекции, чувствительность которых, по разным оценкам, составила 34–80%. Впрочем, быстрые тесты, выявляющие антитела к вирусу, ВОЗ также не рекомендует использовать в лечебно-диагностическом процессе, обращая внимание на слабость механизмов иммунной защиты у некоторых категорий пациентов, перекрестную реактивность с другими типами коронавирусов и выработку иммунитета преимущественно ко 2-й неделе заболевания.
Самотестирование может помочь в определении показаний к самоизоляции, хотя на уровне ЕС и отдельных стран тестов, одобренных для этого предназначения, пока нет, а некоторые страны, в том числе Бельгия, Финляндия, Швеция, Ирландия, Германия и Нидерланды, — предупреждали о недопустимости или даже запретили самотестирование на COVID-19 на данном этапе. Иная ситуация — с молекулярными тестами. Так, Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) недавно разрешило сбор материала в домашних условиях для первого теста полимеразно-цепной реакции (ПЦР), который можно использовать таким образом.
При этом выявление антител к вирусу пока не может считаться свидетельством наличия приобретенного иммунитета, отмечает ECDC. Остается много неопределенности относительно его напряженности и длительности. Сроки выработки антител также еще уточняют. Так, в течение 1-й недели после начала заболевания антитела были выявлены менее чем у 40% пациентов, а с 15-го дня — у 100% (общие), 94,3% (IgM) и 79,8% (IgG) (Zhao J. et al., 2020). Подобные исследования составляют основу для формирования экспертных мнений относительно пригодности тестов на антитела к SARS-CoV-2 для проведения крупномасштабных сероэпидемиологических обследований населения, оценки иммунного статуса персонала на первой линии (медиков) и планирования противоэпидемических мероприятий.
Несмотря на методологические трудности, интерес к масштабным исследованиям популяционного иммунитета повышается, особенно на фоне первых сообщений о невысокой частоте выявления антител к вирусу даже в тех регионах, которые особенно сильно пострадали от COVID-19: около 15% в муниципалитете Гангельт в Северном Рейне-Вестфалии, 10–15% в Нью-Йорке и Новом Орлеане и около 5% по США в целом (www.wbur.org). Для такой популяционной распространенности заболевания чувствительность и специфичность имеющихся быстрых тестов слишком низкие, считает Майкл Остерхольм (Michael Osterholm) из Миннесотского университета (University of Minnesota). «Даже у одобренного FDA теста компании Cellex уровень ложноположительных результатов составляет около 5%. Это все еще значительная погрешность: в сообществе, где 5% людей заражены этим вирусом, — отметил М. Остерхольм, — ложных срабатываний будет столько же, сколько и истинных». ВОЗ предоставила несколько различных типов протоколов для изучения иммунного ответа в популяции и в целевых группах (WHO, 2020). Предварительные результаты исследований показали хорошую корреляцию результатов титрования антител методами ELISA и вируснейтрализующих антител (Amanat F. et al., 2020; OKBA NMA, 2020).
FDA: грядет ужесточение требований
Начиная с февраля 2020 г., FDA выдало разрешения на экстренное использование (Emergency Use Authorizations — EUA) целого ряда быстрых (в основном для анализа бокового потока, реже — хемолюминесцентного анализа), а также других иммунологических и молекулярных тестов. FDA предупреждает об ограничениях, связанных с использованием данных тестов, и не считает их результаты достаточным основанием как для установления, так и отмены диагноза COVID-19. Кроме того, еще в марте FDA предложило правила, в соответствии с которыми уже более 70 компаний продают тесты на антитела к COVID-19, не имея EUA, хотя и с необходимостью соблюдать некоторые условия (Abbasi J., 2020). В частности, производители, работающие без EUA, должны декларировать соответствие своих тестов спецификациям, используя материал, взятый от пациентов с диагнозом COVID-19, подтвержденным методом ПЦР. В сопроводительной документации должно быть отмечено, что FDA не одобрило тесты, и что их не следует использовать в качестве единственного основания для диагностики или исключения инфекции SARS-CoV-2, как и для информирования пациентов о перенесенной инфекции. «Однако некоторые фирмы ложно утверждают, что их серологические тесты рассмотрены или одобрены FDA, или что с их помощью можно диагностировать COVID-19. FDA примет необходимые меры против компаний, делающих ложные заявления или предлагающих тесты, которые не являются точными и надежными. Также появилась информация, что FDA может потребовать получать разрешения на маркетинг тестов от всех производителей, поскольку тесты «откровенно сомнительного качества» наводнили американский рынок», — цитирует «New York Times» Скотта Беккера (Scott Becker), исполнительного директора Ассоциации лабораторий общественного здравоохранения.
Данные по крупицам
В ведущийся Государственной службой Украины по лекарственным средствам и контролю за наркотиками Реестр лиц, ответственных за введение в обращение медицинских изделий, имплантируемых активных медицинских изделий и медицинских изделий для диагностики in vitro, от 24 апреля внесено 35 тест-систем для определения антител IgM, IgG и IgA к вирусу SARS-CoV-2 (преимущественно быстрых для применения в месте оказания помощи и всего несколько — для количественной оценки в лаборатории) и чуть менее 10 ПЦР-тестов. В табл. 3 указаны те из тест-систем, которые, будучи внесенными в вышеупомянутый отечественный Реестр, получили также EUA от FDA, или внесены в список Европейской комиссии (European Commission, 2020, на основании материалов FIND), или одобрены Национальной комиссией по здравоохранению Китая. Большинство данных изделий для диагностики in vitro (IVD) имеют сертификат соответствия «CE».
| Таблица 3 | Тест-системы, внесенные в отечественный Реестр, а также получившие EUA от FDA или вошедшие в перечень FIND |
| Скорость, использование | Чувствительность/специфичность, % | Тип | Производитель | Название | Регуляторный статус |
| Быстрый | IgG/IgM | Assure Tech. (Hangzhou) Co., Ltd | COVID-19 IgG/IgM Rapid Test Device | CE-IVD | |
| Быстрый | IgG/IgM | Assure Tech. (Hangzhou) Co., Ltd | COVID-19 IgG/IgM Rapid Test Device | CE-IVD | |
| Быстрый | IgM | Beijing Diagreat Biotechnologies Co., Ltd | 2019-nCoV IgM Antibody Determination Kit | CE-IVD | |
| Быстрый | IgG | Beijing Diagreat Biotechnologies Co., Ltd | 2019-nCoV IgG Antibody Determination Kit | CE-IVD | |
| Иммунохроматографический | Beijing Lepu Medical Technology Co., Ltd | SARS-CoV-2 Antibody Test (colloidal gold immunochromatography) | |||
| Быстрый | 93,6/96,4 | IgG/IgM | Cellex Inc. | Cellex qSARS-CoV-2 IgGIgM Cassette Rapid Test | CE-IVD, US FDA–EUA |
| Ручная (экстракция) в лечебном учреждении | ПЦР | Co-diagnostics | Logix Smart Coronavirus disease 2019 (COVID-19) | CE-IVD, FDA-EUA | |
| Быстрый | IgG/IgM | Core Technology Co., Ltd | COVID-19 IgM/IgG Ab Test | CE-IVD | |
| Ручная в лечебном учреждении | 96,9/99,4 | IgG/IgM | CTK Biotech, Inc. | OnSite COVID-19 IgG/IgM Rapid Test | Research Use Only |
| Быстрый | IgG/IgM | Dynamiker Biotechnology (Tianjin) Co., Ltd. | 2019 nCOV IgG/IgM Rapid Test | CE-IVD | |
| Ручная или автоматическая | IgG | Euroimmun AG | Anti-SARS-CoV-2 ELISA (IgG) | CE-IVD | |
| Ручная или автоматическая | IgA | Euroimmun AG | Anti-SARS-CoV-2 ELISA (IgA) | CE-IVD | |
| Быстрый | IgG/IgM | Getein Biotech, Inc. | One Step Test for Novel Coronavirus (2019-nCoV) IgM/IgG antibody (Colloidal Gold) | CE-IVD | |
| Ручной или автоматический иммунный анализ | IgG/IgM | Goldsite Diagnostics Inc. | SARS-CoV-2 IgG/IgM Kit (manual) | CE-IVD | |
| Быстрый | IgG/IgM | Hangzhou Biotest Biotech Co., Ltd | COVID-19 IgG/IgM Rapid Test Cassette (Whole Blood/Serum/Plasma) | CE-IVD | |
| Быстрый | IgG/IgM | Hangzhou Biotest Biotech Co., Ltd | COVID-19 IgG/IgM Rapid Test Cassette (Whole Blood/Serum/Plasma) | CE-IVD | |
| Быстрый | IgG/IgM | Hangzhou Clongene Biotech Co., Ltd | 2019-nCoV IgG/IgM Rapid Test | CE-IVD | |
| Ручная в лечебном учреждении | ПЦР | Mabsky Bio-Tech Co., Ltd | COVID-19 virus (2019-nCoV) Dual-Detection Kit | CE-IVD | |
| Ручная в лечебном учреждении | 98/100 | ПЦР | Novacyt/Primerdesign | Genesig Real-Time PCR COVID-19 | CE-IVD |
| Автоматическая или ручная | Osang Healthcare | GeneFinder COVID-19 RealAmp Kit | CE-IVD, FDA-EUA | ||
| Быстрый | 81,8/96,7 | IgG/IgM | SD Biosensor Inc. | STANDARD Q COVID-19 IgM/IgG Duo Test | CE-IVD |
| Быстрый | IgG/IgM | Shenzhen Bioeasy Biotechnology Co., Ltd | Bioeasy 2019-nCoV Total Ab GICA Rapid Test | CE-IVD | |
| Быстрый | 97 (IgG); 81 (IgM) | IgG/IgM | VivaChek Biotech (Hangzhou) Co., Ltd | VivaDiag COVID-19 IgM/IgG Rapid Test | CE-IVD |
| Быстрый | IgG/IgM | Zhejiang Orient Gene Biotech | COVID-19 IgG/IgM Rapid Test | CE-IVD, EUA planned | |
В указанный список не включены изделия, коммерциализированные украинскими разработчиками, а также те, что не удалось найти ни в одном из вышеназванных перечней. Таких насчитывается около полутора десятков. Таким образом, многие из средств лабораторной диагностики COVID-19, появившиеся на рынке, пока не имеют определенного регуляторного статуса и проходят экспертную оценку. Поскольку FIND (Фонд инновационной диагностики) — авторитетный мировой ресурс, материалами которого пользуется Европейская комиссия в своих обзорах, мы будем продолжать знакомить читателей с опубликованными там результатами испытаний.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим