Европейское агентство по лекарственным средствам (European Medicines Agency — EMA) 26 февраля рекомендовало предоставить компании «Roche Registration GmbH» разрешение на маркетинг в Европейском Союзе Evrysdi (рисдиплам) — первого препарата для перорального применения у пациентов с определенными типами спинальной мышечной атрофии, редким и часто смертельным генетическим заболеванием, вызывающим мышечную слабость и прогрессирующую потерю двигательной функции.
Препарат показан для лечения наиболее распространенной формы спинальной мышечной атрофии, известной как «5q SMA» (термин «5q» относится к его генетической причине), у пациентов в возрасте 2 мес и старше с клиническим диагнозом спинальной мышечной атрофии 1-го, 2-го или 3-го типа или с 1–4 копиями гена выживания моторного нейрона-2 (Survival Motor Neuron — SMN2).
Спинальная мышечная атрофия — это наследственное заболевание, которое поражает двигательные нейроны (нейроны головного и спинного мозга, контролирующие движения мышц). Пациентам с этим заболеванием не хватает белка SMN, что приводит к разрушению двигательных нейронов. Белок SMN кодируется двумя генами, SMN1 и SMN2 (рисунок). Пациенты со спинальной мышечной атрофией не имеют работающего гена SMN1, но имеют по крайней мере одну копию гена SMN2, которая в основном производит короткий белок SMN, который не работает так же хорошо, как полноразмерный белок (на него приходится 90% синтезируемой при участии SMN2 белковой фракции).
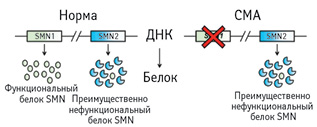
Рисдиплам помогает гену SMN2 в синтезе полноразмерного белка SMN, который способен нормально работать. Ожидается, что это повысит выживаемость мотонейронов и уменьшит выраженность симптомов заболевания. Препарат разработан для неинвазивного лечения, которое можно использовать дома. Он был принят в PRIME, схему поддержки, разработанную EMA для перспективных новых лекарств, нацеленных на неудовлетворенные медицинские потребности. Рекомендация EMA основана на двух клинических исследованиях, в одном из которых изучали применение рисдиплама у пациентов со спинальной мышечной атрофией разного возраста.
В рамках своей рекомендации для получения разрешения на маркетинг у компании запросили организацию поставторизационного исследования эффективности (PAES) — долгосрочного проспективного обсервационного исследования, для дальнейшей оценки прогрессирования заболевания у пациентов со спинальной мышечной атрофией (как досимптоматических, так и симптоматических).
Основными побочными реакциями, выявленными в исследованиях, были головная боль, язвы во рту и афтозные язвы, инфекции мочевыводящих путей, включая цистит, тошноту при артралгии, гипертермию и головокружение. Теперь заключение будет отправлено в Европейскую комиссию для принятия решения о разрешении на маркетинг в масштабах ЕС. После выдачи разрешения решения о цене и возмещении будут принимать на уровне каждого государства-члена с учетом потенциальной роли/применения этого лекарственного средства в контексте национальной системы здравоохранения этой страны.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим