Живые аттенуированные вакцины (на основе бациллы Кальметта — Герена (БЦЖ), против кори, эпидемического паротита, краснухи, ротавируса, гриппа (вводится интраназально), желтой лихорадки) запускают врожденный иммунный ответ, усиливая базовую защиту от инфекций. При этом вопросы о его специфичности, уровне защиты и т.д. остаются открытыми.
Для выяснения этого во время пандемии COVID-19 стартовала масса исследований неспецифической защитной эффективности живых вакцин. Например, поскольку во многих странах продолжается использование пероральной полиовакцины (ОПВ), важно знать, как связано воздействие живого аттенуированного полиовируса (в том числе косвенное) со снижением уровня развития симптоматической инфекции SARS-CoV-2? На данный вопрос искали ответ ученые из США и Ирана (Habibzadeh F. et al., 2021).
Матери вакцинированных младенцев не болели все 9 мес наблюдения
В организованном в Иране когортном исследовании с участием 4190 женщин ни у одной из тех, кто косвенно подвергался воздействию ОПВ (посредством вакцинации детей), не развился COVID-19 в течение 9 мес исследования, в то время как 0,74% женщин того же возраста, которые не контактировали с ОПВ, заболели COVID-19. Авторы предположили, что косвенное воздействие живого аттенуированного полиовируса может быть связано со снижением симптоматики инфекции COVID-19 в течение как минимум 6 мес.
В своих изысканиях авторы отталкивались от результатов более ранних работ на эту тему. Так, несколько контролируемых исследований, проведенных в 1960-х и 1970-х годах с участием более чем 60 000 человек, показали, что введение ОПВ способствовало почти 4-кратному снижению заболеваемости и смертности, связанных с гриппом, без каких-либо клинически значимых побочных эффектов. Преимущество ОПВ, в отличие, к примеру, от противокоревой и БЦЖ вакцин в том, что она доступна перорально и выпускается с несколькими штаммами для многократного в течение жизни введения.
Возможная причина: филогенетически древняя врожденная иммунная система использует несколько защитных механизмов для противоинфекционной защиты. В отличие от адаптивного иммунитета, который основан на антиген-специфичности, отдельные популяции макрофагов и естественных клеток-киллеров, ранее контактировавшие с патогенами, могут быть способны реагировать на неспецифические патогены.
БЦЖ как стимулятор, в том числе местного иммунитета
Во всем мире проводятся многочисленные исследования, чтобы связать положительное влияние вакцинации БЦЖ на COVID-19. Так, рандомизированное клиническое исследование III фазы ACTIVATE (NCT03296423) подтвердило, что недавняя вакцинация БЦЖ лиц пожилого возраста (>65 лет) защищает от новых инфекций (Giamarellos-Bourboulis E.J. et al., 2020). Риск заражения хотя бы одной новой респираторной инфекцией за 12 мес для группы, вакцинированной БЦЖ, снизился на 79%.
Кроме того, вклад в сильно варьирующуюся защитную эффективность БЦЖ может вносить вариабельность штамма. В обзорной статье дана сводная информация по этому поводу (Gonzalez-Perez M. et al., 2021). Так, в большинстве запланированных или проводящихся исследований о связи БЦЖ с COVID-19 используют датский штамм (1331) (рисунок). Второй по частоте — рекомбинантный штамм (рБЦЖ) VPM1002, в котором ген уреазы C заменен геном, кодирующим листериолизин-O листерии (Listeria monocytogenes) (Nieuwenhuizen N.E. et al., 2017). Третье место делят Московский штамм 361-1 и неуточненный — от Индийского института сывороток (Serum Institute of India Pvt. Ltd. — SII). В нашей стране зарегистрированы две вакцины БЦЖ: от SII (содержит московский штамм 361-1) и «ББ-НЦІПХ Лтд.» (Болгария).
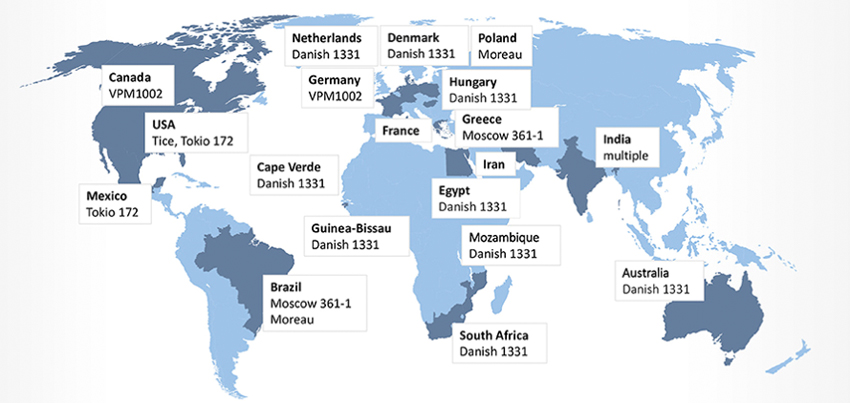
Более вирулентные штаммы также были более эффективными в защите от заражения микобактериями туберкулеза (Mycobacterium tuberculosis), сообщили авторы обзора (Gonzalez-Perez M. et al., 2021) со ссылкой на исследование (Abdallah A.M. et al., 2015). При этом самые высокие уровни вирулентности в модели заражения мышей показали штаммы БЦЖ группы дупликации DU2-IV (BCG Phipps, Frappier, Pasteur и Tice), тогда как штаммы группы II DU2 (BCG Russia, Sweden, Tokyo 172 и Birkhaug) (Otrashevskaya E. et al., 2018) были среди наименее опасных (Zhang L. et al., 2016). Cогласно отчету ВОЗ, для компенсации потенциального «чрезмерного ослабления» доза BCG-Japan содержит в 5 раз больше колониеобразующих единиц, чем другие распространенные вакцины БЦЖ (Tran V. et al., 2016).
Вообще наиболее часто используемыми в вакцинах БЦЖ штаммами являются французский пастеровский (Pasteur strain (Pasteur 1173P2)), датский (Danish 1331), бразильский (Mearou RJ), русский (Moscow-368), болгарский субштамм (Sofia SL222) и японский (Tokyo 172-1) (Li J. et al., 2021).
В настоящее время запланированы или проводятся более 20 контролируемых рандомизированных клинических исследований в Нидерландах, Австралии, Германии, Греции, США, Египте, Колумбии, Мексике, Бразилии, Южной Африке, Дании и Франции, в ходе которых планируют оценить, снижает ли вакцина БЦЖ заболеваемость и тяжесть COVID-19. В частности, этот фактор проанализируют в исследовании (NCT04711954) Медицинского центра Эразмус (Erasmus Medical Center, Нидерланды), проводящемся в Украине среди пациентов, живущих с ВИЧ.
Возможно, введение БЦЖ через слизистые оболочки (пероральное или аэрозольное), которое локально задействует тренированный иммунитет, может привести к более эффективным ответам врожденной иммунной памяти у пациентов с COVID-19 легкой степени (Gonzalez-Perez M. et al., 2021).
Бактериальные векторы
Несколько групп по всему миру в настоящее время занимаются созданием вакцин нового поколения на основе БЦЖ (Gonzalez-Perez M. et al., 2021). Так, VPM1002, генетически модифицированная вакцина на основе рБЦЖ, уже прошла клинические исследования (NCT04387409, NCT04439045, спонсоры — «Vakzine Projekt Management GmbH», SII, Университетская сеть здравоохранения (University Health Network), Торонто, и др.) для снижения частоты инфицирования SARS-CoV-2 и тяжести COVID-19. VPM1002 экспрессирует листериолизин O, полученный из патогенной для человека листерии (Listeria monocytogenes).
Модифицированный вирус осповакцины Анкара (Modified Vaccinia virus Ankara — MVA) представляет собой аттенуированное производное, которое использовали в кампании по искоренению натуральной оспы и в настоящее время разрабатывается как рекомбинантный вирусный вектор для производства вакцин против инфекционных заболеваний и рака (Pavot V. et al., 2017). MVA — это очень реактогенная вакцина, от которой умирало от одного до двух человек на миллион вакцинированных. Ее иммуногенность зависит от дозы и режима вакцинации, и сейчас начинает накапливаться информация об эффективности вакцин с вектором MVA.
Таким образом, задействование при иммунопрофилактике инфекций врожденного неспецифического иммунитета является потенциально значимым механизмом, требующим тщательного изучения.
Список использованной литературы
Abdallah A.M., Hill-Cawthorne G.A., Otto T.D. et al. (2015) Genomic expression catalogue of a global collection of BCG vaccine strains show evidence for highly diverged metabolic and cell-wall adaptations. Sci Rep, 5: 15443. doi: 10.1038/srep15443.
Giamarellos-Bourboulis E.J., Tsilika M., Moorlag S. et al. (2020) Activate: Randomized Clinical Trial of BCG Vaccination against Infection in the Elderly. Cell, 2020 Oct 15; 183(2): 315–323.e9. doi: 10.1016/j.cell.2020.08.051. EpubSep 1. PMID: 32941801; PMCID: PMC7462457.
Gonzalez-Perez M., Sanchez-Tarjuelo R., Shor B. et al. (2021) The BCG Vaccine for COVID-19: First Verdict and Future Directions. Frontiers in Immunology, 12, 579. www.frontiersin.org/article/10.3389/fimmu.2021.632478.
Habibzadeh F., Sajadi M.M., Chumakov K. et al. (2021) COVID-19 Infection Among Women in Iran Exposed vs Unexposed to Children Who Received Attenuated Poliovirus Used in Oral Polio Vaccine. JAMA Netw Open, 4(11): e2135044. doi:10.1001/jamanetworkopen.2021.35044.
Li J., Zhan L., Qin C. (2021) The double-sided effects of Mycobacterium Bovis bacillus Calmette-Guérin vaccine. NPJ Vaccines. Jan 25; 6(1):14. doi: 10.1038/s41541-020-00278-0. PMID: 33495451; PMCID: PMC7835355.
Nieuwenhuizen N.E., Kulkarni P.S., Shaligram U. et al. (2017) The Recombinant Bacille Calmette-Guérin Vaccine VPM1002: Ready for Clinical Efficacy Testing. Front Immunol, 8: 1147. Published 2017 Sep 19. doi: 10.3389/fimmu.2017.01147.
Otrashevskaya E., Vinokurova V., Shilikov E. et al. (2018). M. BOVIS BCG-1 (RUSSIA) SUB-STRAIN GENOME STABILITY INVESTIGATION WITHIN THE ENTIRE PRODUCTION PROCESS. Journal of microbiology epidemiology immunobiology, 58–67. 10.36233/0372-9311-2018-2-58-67.
Pavot V., Sebastian S., Turner A.V. et al. (2017) Generation and Production of Modified Vaccinia Virus Ankara (MVA) as a Vaccine Vector. Methods Mol Biol.; 1581: 97–119. doi: 10.1007/978-1-4939-6869-5_6. PMID: 28374245.
Tran V., Ahn S.K., Ng M. et al. (2016) Loss of lipid virulence factors reduces the efficacy of the BCG vaccine. Sci Rep. 6: 29076. doi: 10.1038/srep29076.
Zhang L., Ru H.W., Chen F.Z. et al. (2016) Variable virulence and efficacy of BCG vaccine strains in mice and correlation with genome polymorphisms. Mol Ther. 24: 398–405. doi: 10.1038/mt.2015.216.
По материалам www.frontiersin.org; www.nature.com; www.iavi.org; www.drlz.com.ua

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим