Європейський парламент 16 лютого 2023 р. схвалив продовження терміну сертифікації медичних виробів. Воно відбуватиметься поетапно, тобто до грудня 2027 р. для пристроїв з вищим ризиком і до грудня 2028 р. — із середнім і низьким ризиком. Таким чином, ситуація з дефіцитом часу для деяких продуктів стає простішою, але не відміняється. Потрібні подальші кроки, особливо для того, щоб виробники «нішевих» товарів не пішли з ринку.
Йдеться про схвалення законодавчої резолюції щодо Пропозиції Європейського парламенту та Ради про внесення змін до регламентів (ЄС) 2017/745 та (ЄС) 2017/746, що стосуються певних медичних виробів та засобів для діагностики in vitro.
Регламенти та терміни набуття чинності
Необхідність у нових регламентах була зумовлена різними серйозними подіями. Певні продукти у класах найвищого ризику доведеться перевіряти незалежним міжнародним групам експертів. Виробники також повинні постійно моніторувати безпеку продукції після її виходу на ринок. Крім того, чітка ідентифікація всіх товарів має забезпечувати їхню повну відстежуваність.
Перехід до нового Регламенту щодо медичних виробів (Medical Device Regulation — MDR) та Регламенту щодо засобів діагностики in vitro (In Vitro Diagnostic Regulation — IVDR), які були прийняті у 2017 р., упродовж тривалого часу супроводжується невизначеністю та затримками. Так, введення його в дію було відтерміновано на 1 рік. Багато виробників досі не готові витримати законодавчо визначений термін, і це призводить до ризику дефіциту багатьох продуктів у ЄС.
MDR передбачав перехідний період, який мав закінчитися 26 травня 2024 р. Упродовж цього часу вироби, на які поширюються сертифікати, видані з 25 травня 2017 р. згідно з відповідними директивами, могли бути дійсними протягом максимального періоду в 5 років після дати їх видачі, але не довше ніж до 27 травня 2024 р.
Що стосується IVDR, то у січні 2022 р. Рада та Європейський парламент уже прийняли рішення про загальне продовження перехідного періоду до 26 травня 2025 р. з більш тривалим відтермінуванням до 26 травня 2026 р. та 26 травня 2027 р. для певних класів виробів, для яких процедура оцінки відповідності згідно з Директивою 98/79/EC не вимагала участі уповноваженого органу і для яких така участь тепер є необхідною відповідно до IVDR. Також було введено новий термін до 26 травня 2028 р. для застосування деяких положень щодо виробів, які виготовляються та використовуються в закладах охорони здоров’я.
Проблеми органів з оцінки та виробників
Незважаючи на значний прогрес за останні роки, загальний потенціал з оцінки відповідності залишається недостатнім, зазначено у пропозиції. Так, на даний момент відповідно до Регламенту (ЄС) 2017/745 призначено 36 уповноважених органів. Ще 26 заявок на їх призначення наразі опрацьовуються.
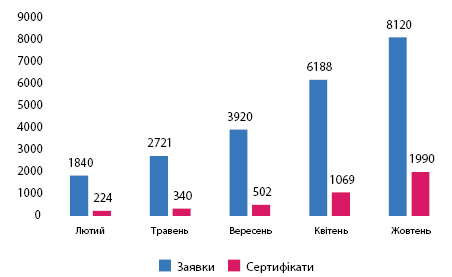
Крім того, багато виробників не готові виконати вимоги MDR до кінця перехідного періоду. Зокрема, у жовтні 2022 р. уповноважені органи повідомили, що отримали загалом 8120 заявок від виробників на сертифікацію відповідно до MDR та видали 1990 таких сертифікатів (рисунок). Згідно з представленою уповноваженими органами оцінкою кількість сертифікатів, виданих до травня 2024 р., може сягнути близько 7000, якщо поточна швидкість їх видачі залишиться незмінною. Водночас кількість сертифікатів, термін дії яких спливає до 26 травня 2024 р., становить 17 095, що різко контрастує з практикою їх оновлення, що склалася. Після закінчення терміну дії сертифікатів, виданих згідно з директивами, і без дійсного сертифіката MDR виробникам більше не дозволяється розміщувати медичні вироби на ринку ЄС.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим