Конференція охопила теоретичні основи та практичні аспекти організації клінічних досліджень в Україні і відбулася за участю представників ДП «Державний експертний центр МОЗ України», провідних спеціалістів та представників фармацевтичних та дослідницьких компаній, що зареєстровані в Україні: Група компаній «ФармаСіч», ТОВ «Synergy Group Ukraine», ТОВ «AstraZeneka», компанія «MSD Україна», патоморфологічна лабораторія CDS HEALTH CARE та представники вищих навчальних медичних закладів та Національного інституту раку.
Відкрив конференцію Григорій Урсол, генеральний директор ПП ПВФ «Ацинус», зазначивши, що головною метою всіх клінічних досліджень є покращення здоров’я пацієнтів та наближення до того, щоб невиліковні хвороби крок за кроком ставали виліковними. Багато людей вважають, що клінічні випробування — це нав’язане пацієнту лікарем дослідження, в ході якого перший стає «піддослідним кроликом», над яким представники фармацевтичної індустрії ставлять свої експерименти. Проте це далеко від реальності.
В Україні всі клінічні дослідження контролюються МОЗ України та самими замовниками, тобто розробниками лікарського засобу. Суворі закони і міжнародні вимоги передбачають кримінальну відповідальність усіх сторін дослідження, крім, власне, пацієнта. Бо саме він є найзахищенішою законом стороною клінічного дослідження, його безпека стоїть на першому місці, та без його згоди не може бути здійснена ні одна маніпуляція, видана жодна пігулка, проведений жодний аналіз. Окрім того, участь у клінічному дослідженні дає змогу учаснику отримати безкоштовно необхідні йому діагностику та лікування, що має особливе значення для пацієнтів, що фінансово неспроможні почати чи продовжувати лікування, але так його потребують.
Доповіддю на тему «Нормативне законодавство при проведенні клінічних досліджень» продовжила конференцію Людмила Ковтун, заступник директора Державного експертного центру МОЗ України з клінічних питань. Доповідач підкреслила важливість знання нормативно-правової бази щодо проведення клінічних досліджень, а також прав та обов’язків спонсорів, дослідницьких організацій, відповідального дослідника та пацієнта.
Доповідач звернулася до історії запровадження світових стандартів, нагадавши, що у 1991 р. в м. Брюссель відбулася Міжнародна конференція з гармонізації технічних вимог до реєстрації лікарських препаратів для застосування людиною (International Council for harmonization of Technical Requirements for Pharmaceuticals for Human Use — ICH). Саме на цій конференції вперше було створено єдині вимоги до проведення клінічних досліджень — належну клінічну практику (Good Clinical Practice — GCP) для країн — членів ЄС, США та Японії. Настанова GCP покликана сприянню взаємовизнання клінічних даних для уповноважених регуляторних органів цих держав.
GCP — це стандарт планування, проведення, виконання, моніторингу, аудиту та документального оформлення клінічних досліджень, а також обробки та представлення їх результатів, що служить для суспільства гарантією достовірності отриманих даних і захищеності прав, здоров’я й анонімності осіб, що беруть учать у дослідженнях.
Експерт зупинилася на основних принципах проведення клінічних досліджень в Україні. Нормативно-правова база, що регламентує проведення клінічних досліджень в Україні, представлена Законом України «Про лікарські засоби» (1996 р.) зі змінами та доповненнями, наказом МОЗ України від 23.09.2009 р. № 690 «Про затвердження порядку проведення клінічних випробувань та експертизи матеріалів клінічних випробувань та Типового положення про комісії з питань етики» зі змінами та доповненнями, внесеними наказами МОЗ України від 12.06.2012 р. № 523, від 06.05.2014 р. № 304, від 18.12.2014 р. № 966, від 01.10.2015 р. № 639.
Планування, проведення та звітність усіх клінічних випробувань, у тому числі й досліджень біоеквівалентності, здійснюються з дотриманням вимог та принципів GCP. Клінічні дослідження проводяться відповідно до етичних принципів, задекларованих Гельсінською декларацією, після оцінки відповідним органом співвідношення ризик/користь застосування досліджуваного препарату. Права, безпека та благополуччя осіб, які беруть участь в дослідженнях, є більш важливими, ніж інтереси науки та суспільства.
Виробництво та збереження досліджуваного лікарського засобу, а також поводження з ним здійснюються у встановленому законодавством порядку з дотриманням вимог GMP та протоколу клінічного дослідження. Реєстрація, обробка і збереження отриманої в ході клінічного дослідження інформації мають забезпечувати коректне надання, інтерпретацію і верифікацію даних. Забезпечення конфіденційності документів, що можуть ідентифікувати особу учасника випробування, є необхідною умовою для захисту його прав під час проведення клінічного дослідження.
Доповідач наголосила на тому, що до початку дослідження слід отримати добровільну згоду пацієнтів або здорових осіб на участь у дослідженнях, а основні документи клінічного дослідження мають зберігатися відповідно до українського законодавства не менше ніж 15 років після його завершення. Саме зберігання інформації часто викликає дуже багато зауважень при перевірках регуляторним органом через псування документів внаслідок неналежних умов зберігання.
Важливим аспектом проведення клінічних досліджень, на думку Л. Ковтун, є наявність належної освіти, професійної підготовки та досвіду в осіб, які долучаються до проведення клінічних досліджень, для виконання функцій та обов’язків, пов’язаних з таким дослідженням. Вибір дослідників та місця проведення дослідження покладається на спонсора, який може делегувати свої повноваження контрактній дослідницькій організації, проте залишається відповідальним за ініціацію та проведення клінічного дослідження, а також за достовірність інформації, яка була отримана в результаті його проведення.
Усі клінічні дослідження розпочинаються після прийняття рішення МОЗ України на підставі позитивного висновку експертизи матеріалів щодо проведення клінічного дослідження, який надається Державним експертним центром, та позитивної оцінки Комісії з питань етики при лікувально-профілактичному закладі (ЛПЗ) (витяг з протоколу засідання). Також обов’язковою умовою для проведення клінічних досліджень є оформлення договірних відносин між усіма юридичними та фізичними особами, що беруть участь у ньому, а саме тристороннього договору (спонсор — ЛПЗ — університет).

Експерт відмітила, що якщо досліджуваний препарат належить до наркотичних засобів, психотропних речовин або прекурсорів, то проведення клінічного випробування здійснюється із дотриманням вимог законодавства у сфері обігу таких препаратів. При цьому на будь-якому етапі клінічного випробування або після його завершення Державний експертний центр може проводити клінічний аудит клінічного дослідження щодо дотримання вимог GСР.
За словами спікера, у 2016 р. було зареєстровано 139 клінічних випробувань, з них 100 є міжнародними багатоцентровими дослідженнями та 39 — передреєстраційними. При цьому найбільша кількість досліджень проводиться в таких напрямках медицини, як онкологія та пульмонологія.
Звертаючи увагу на проведення клінічних аудитів експертами Державного експертного центру, Л. Ковтун відмітила, що всього за 2016 р. було проведено 46 аудитів, при цьому одним з основних зауважень є незначна кількість рапортувань відносно побічних явищ при проведенні клінічних досліджень препаратів в Україні. Це, на думку спікера, піднімає питання якості отриманих даних в ході дослідження та доцільність їх проведення в Україні. Проблемним питанням з боку внесення змін до нормативно-правових актів є страхування відповідальності заявника/спонсора клінічного випробування на випадок заподіяння шкоди життю та здоров’ю суб’єктів дослідження (пацієнтів, здорових добровольців).
Валентина Тельнова, спеціаліст з клінічних досліджень, продовжила конференцію з доповіддю на тему «Нове доповнення до належної клінічної практики в редакції E6 (GCP E6(R2). Яких змін варто очікувати?». Зміни до існуючої редакції настанови з клінічної практики було представлено на 3-й Європейській конференції з клінічних досліджень (3rd European Conference on Clinical Research), що проходила 17–18 жовтня 2016 р. в м. Прага, Чеська Республіка, під егідою Європейської федерації контрактних дослідницьких організацій (European Contract Research Organisation (CRO) Federation).
За словами спікера, внесення змін до GCP було ініційовано на основі висновків, зроблених у ході перевірок дотримання GCP, змін в регуляторній політиці країн, еволюції у сфері технології та науки управління ризиками (technology and science of risk management). Також у 2016 р. до ICH приєдналися 2 нових члени — Канада (Health Canada) та Швейцарія (Swissmedic).
У новій редакції настанови GCP внесено зміни за декількома розділами: глосарій, принципи ICH GCP, обов’язки дослідника, обов’язки спонсора та основні документи.
До глосарію додано такі поняття, як:
- 1.11.1 сертифікована копія — паперова чи електронна копія оригінального запису, що верифікована (датованим підписом) чи була згенерована за допомогою затвердженої процедури та являє собою точну копію з усіма тими самими атрибутами, включаючи дані з ідентичним контекстом, контентом, структурою та інформацією, що й оригінал;
- 1.38.1 план моніторингу — описання методів, обов’язків та вимог до моніторингу клінічного випробування (та моніторингової стратегії);
- 1.39 звіт з моніторингу — результати будь-якого централізованого моніторингу необхідно повідомляти.
Відповідно до нових змін спонсор несе відповідальність за будь-яку субконтрактну організацію, що залучена до проведення клінічного випробування. Також спонсор повинен імплементувати систему управління якістю (system to manage quality — QMS) та періодично переглядати заходи з контролю за ризиками, щоб упевнитися, що вони залишаються ефективними й актуальними. Спонсор та дослідник повинні зберігати записи про розміщення своїх основних документів. Система запису має забезпечувати безпроблемну ідентифікацію документа, пошук та вилучення.
Дослідник несе відповідальність за нагляд за будь-якою фізичною особою/особами, яким він делегує виконання завдань у клінічному дослідженні. Дані, отримані в ході дослідження, повинні бути відповідними, читабельними, співпадати у часі, оригінальними, точними та повними (attributable, legible, contemporaneous, original, accurate and complete — ALCOAC). Вимоги Управління з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) та ВООЗ до документації клінічних досліджень раніше носила абревіатуру ALCOA, а в новій редакції додали останнє визначення «complete». Зміни до первинних даних мають бути послідовними та не повинні приховувати первісний запис.
На даний момент нова версія GCP E6 знаходиться на погодженні в Японії, яка має в листопаді цього року підписати документ, після чого розпочнеться його імплементація.
Про менеджмент клінічних центрів у Східній Європі у міжрегіональній перспективі, або що потрібно зробити сьогодні, щоб процвітати завтра, розповів Сергій Мироненко, керівник компанії «ФармаСіч». Динаміка кількості клінічних випробувань в Україні за останні роки показує, що пік кількості клінічних досліджень в період 2010 – І півріччя 2016 р. припадає на 2012 р. (213 клінічних досліджень), а починаючи з 2013 р. спостерігається негативна динаміка проведення міжнародних клінічних проектів в Україні (рис. 1).
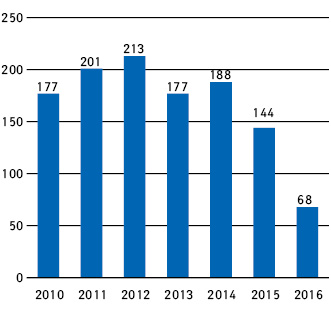
На жаль, цьогорічні дані не дають підстав вважати, що кількість клінічних випробувань буде більшою, ніж минулого року, тому негативна динаміка кількості нових проектів зберігається і в 2016 р.
З чим пов’язана така криза? Звичайно, першим фактором, що приходить на думку, є війна на сході України. Проте криза почалася ще в мирному 2012 р., коли військових дій не було. З власного досвіду спікер зазначив, що у 2014 р. спонсори дійсно не хотіли проводити дослідження у клінічних центрах Харкова чи Дніпропетровська через близькість до бойових дій, проте вже у 2015 р. цей фактор потрохи нівелювався, до того ж політична ситуація мало впливає на рішення про розміщення клінічних досліджень в Україні. Проте кількість досліджень, що проводяться, незмінно зменшується.
Спікер відмітив, що така ситуація демонструє, що є інші фактори, від яких залежать конкурентоспроможність України на глобальному ринку клінічних досліджень. Звіти локальних експертів показують, що Україна реалізувала свій потенціал у клінічних дослідженнях лише на 10–15%. Для того щоб дослідити причини розвитку такої ситуації та шляхи її вирішення, компанія «ФармаСіч» у 2015 р. реалізувала аналітичний проект з вивчення глобальної конкурентоспроможності східноєвропейських ринків клінічних випробувань. Результати дослідження опубліковані в журналі «».
У проектну команду увійшли представники компанії «ФармаСіч» та їх британські колеги. Суть проекту полягала в проведенні опитування професіоналів з великим досвідом управління клінічними проектами. Так, спікер повідомив, що всього в опитуванні взяли участь 57 респондентів з більше ніж 20 країн (Північна та Південна Америка, Азія та Європа). При цьому 72% респондентів мали досвід менеджменту більше ніж 10 міжнародних проектів.
Цілями дослідження були:
- порівняти роботу дослідницьких центрів Східної Європи з роботою дослідницьких центрів інших «ключових» регіонів;
- проаналізувати, чи є різниця в якості роботи центрів різних терапевтичних профілів;
- підтвердити чи спростувати думку щодо того, що східноєвропейські країни залишаються привабливими для проведення міжнародних клінічних досліджень;
- визначити основні причини, чому дослідницькі центри Східної Європи залучаються до участі у клінічних випробуваннях.
О. Мироненко зауважив, що в ході дослідження було вирішено відмовитися від традиційного терміну СЕЕ (Central&Eastern Europe), що об’єднує країни Східного регіону ЄС та пострадянські країни. Оскільки країни Східного регіону ЄС критично відрізняються від інших країн цього регіону, що не входять до ЄС, їх розділили на Центральну Європу (країни Східного регіону ЄС) та Східну Європу (Білорусь, Молдова, Україна, Грузія та Російська Федерація).
За результатами дослідження було визначено глобальний рейтинг клінічних центрів (рис. 2).
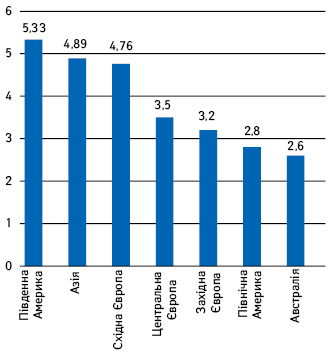
Чим більшим є середнє значення, тим більш проблемними, на думку респондентів, є клінічні центри в регіоні. Найгірше сприймаються центри Південної Африки, Азії та Східної Європи. Найкращими виявилися представники австралійських та північноамериканських центрів, проміжне положення займають представники Центральної та Східної Європи.
Спікер відмітив, що всі центри були розподілені на 3 категорії: «безпроблемні» центри (з невеликою кількістю проблем, що виникають зрідка та не впливають на якість даних і хід випробування), «помірнопроблемні» (з помірно вираженими проблемами, які мають системний характер, з’являються часто, але можуть бути вирішені без критичного негативного впливу на якість чи терміни випробування) та «високопроблемні» (системні проблеми, які істотно або критично впливають на якість та терміни випробування та потребують значних ресурсів для постійного контролю якості).
Отримані результати показали, що клінічні дослідження в різних регіонах вимагають різних рівнів управління ними. Так, в традиційних регіонах клінічні випробування вимагають менше зусиль, ніж такі в нових регіонах, що розвиваються (наприклад Східна Європа та Південна Америка), що вимагають більших внесків від спонсорів, CRO тощо.
Іншим предметом дослідження доповідач визначив розбіжності в продуктивності клінічних досліджень в різних терапевтичних напрямках (рис. 3). Так, 27,7% респондентів відповіли, що не бачать різниці в якості роботи дослідних центрів, 14,8% мали досвід лише в одному з терапевтичних напрямків у регіоні Східної Європи, і 57,4% зазначили, що розбіжності є.
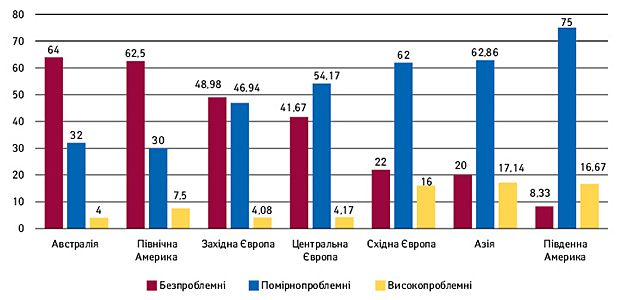
У відповідях припустили, що клінічні дослідження в онкології є найбільш складними з точки зору продуктивності (30,8%). Це пояснюється найвищою насиченістю випробувань у цьому терапевтичному напрямку і в цілому великою рутинною завантаженістю фахівців онкологічного профілю. Далі за онкологією прямують дослідження у сфері психіатрії (11,5%), хірургії (7,7%), внутрішніх хвороб (1,9%) та інші (3,9%).
За результатами опитування було також визначено рейтинг основних проблем, які виникають при роботі у клінічних центрах Східної Європи (таблиця).
| Таблиця | Рейтинг основних проблем, які виникають при роботі у клінічних центрах Східної Європи |
| Проблема | Ніколи або дуже рідко, % | Інколи або часто, % | Дуже часто або завжди, % |
|---|---|---|---|
| Складні контрактні процедури | 17,7 | 62,8 | 19,6 |
| Якість даних та комплаєнс | 18 | 76 | 6 |
| Проблеми з локальними етичними комісіями та регуляторні питання | 20,4 | 67,4 | 12,2 |
| Дотримання термінів виконання робіт (таймлайнів) | 27,1 | 66,7 | 6,3 |
| Недостатня матеріально-технічна база | 29,4 | 60,8 | 9,8 |
| Перенавантаження клінічними дослідженнями | 30,6 | 59,2 | 10,2 |
| Недостатній досвід участі в клінічних дослідженнях | 35,3 | 62,8 | 2 |
| Проблема внутрішньої взаємодії та організації командної роботи | 38 | 58 | 4 |
| Недостатня кількість кваліфікованого й освіченого персоналу | 43,1 | 52,9 | 3,9 |
| Низький рівень мотивації | 54 | 40 | 6 |
Складні контрактні процедури було відмічено як одне з найбільш складних завдань для спонсора. Наприклад, укладення договору з державною лікарнею (а вони є основним місцем проведення клінічних випробувань в Україні) є дуже складним за багатьма напрямами, в тому числі фінансовим та юридичним.
Другою за значимістю проблемою є комплаєнс та якість клінічних даних. Ця проблема, на думку доповідача, є суттєвою та потребує якомога швидшого вирішення для подальшого збільшення кількості проведення міжнародних клінічних досліджень на території України. Критичною проблемою є недостатня матеріально-технічна база, що значно обмежує спектр досліджень, які можуть проводитися в Україні. Наприклад, за 2 роки в сфері офтальмології було проведене лише 1 клінічне випробування, і в основному це пов’язано з неможливістю виконання технічних вимог.
Доповідач зазначив, що за результатами опитування типовий клінічний центр Східної Європи виглядає наступним чином: це комунальний або державний лікувальний заклад з недостатнім рівнем матеріально-технічної бази, з яким вступити в контрактні відносини є нетривіальним завданням через суперечливе місцеве законодавство та обтяжливі адміністративні процедури.
Втім, адміністративний хаос і брак сучасного обладнання компенсуються мотивацією персоналу (завдяки підходу «завжди і в усьому брати участь»), який є досить досвідченим та професійно вправним, хоча й перенавантаженим. Зазвичай такий центр забезпечує швидкий набір пацієнтів, при цьому не дуже переймаючись якістю генерованих даних, а слово «дедлайн» у дослідників не викликає таких самих сильних почуттів, як у спонсорів.
Такий типовий клінічний центр схильний ігнорувати процедури компетентних органів та етичних комісій, а проблеми внутрішньої комунікації його персоналу є досить очевидними для спонсора.
Звичайно, екстраполювати отримані дані на Україну на 100% неможливо, адже вони враховують багато різних країн, проте, на думку спікера, є досить близькими для нашої держави.
С. Мироненко підкреслив, що, попри всі проблеми, 43% респондентів заявили, що однозначно залучатимуть Східну Європу в свої проекти, а 30% висловили високу ймовірність кооперації зі східноєвропейськими дослідниками. При цьому основною мотивацією до залучення було визначено не якість даних (1,92%) чи низьку вартість (5,77%), а швидкість набору пацієнтів (46,15%).
На завершення доповіді спікер відзначив, що Україна як ключовий ринок Східної Європи ще зберігає привабливість для спонсорів, переважно завдяки здатності забезпечувати швидкий набір пацієнтів. Проте поточні кризові явища яскраво ілюструють, що цієї конкурентної переваги вже недостатньо, аби витримати глобальну конкуренцію.
Адміністрації ЛПЗ, регуляторні органи та й самі дослідники повинні усвідомити існуючі місцеві обмеження для розвитку клінічних досліджень та вимоги з боку спонсорів, що стають дедалі жорсткішими.
«За умови, що клінічні центри модифікують свої структуру, процедури та підходи до виконання проектів, Україна й надалі зможе робити значний внесок у клінічну розробку інноваційних лікарських засобів», — зазначив С. Мироненко.
Більшість клінічних досліджень, що проводяться в Україні, знаходяться в тій фазі, коли ризики та позитивні характеристики досліджуваного препарату вже відомі та лише підтверджуються в ході клінічного випробування. Тому пацієнт завчасно попереджається про можливі ризики й про можливі позитивні для його здоров’я наслідки застосування цього лікарського засобу.
Якщо пацієнт стає учасником програми клінічного дослідження, то у нього з’являється можливість отримати безкоштовно необхідну йому терапію, яку з тих чи інших причин він не може собі дозволити. Це є незаперечним бонусом проведення таких процедур. Адже клінічні дослідження — це не експерименти над людьми, а гідне лікування якісними лікарськими засобами. При цьому безпека пацієнта в клінічних дослідженнях завжди є пріоритетом.
Слід зазначити, що така конференція в Кропивницькому проводиться вперше та була абсолютно безкоштовною для всіх слухачів. Присутні висловили сподівання щодо періодичного проведення подібних конференцій у майбутньому.
Варто відмітити
Компанія «Ацинус», що гостинно вітала усіх учасників конференції, розпочала свою медичну практику у 1994 р. на території Кіровоградської обласної лікарні на орендних умовах. Проте вже у 1998 р. розпочалася діяльність Лікувально-діагностичного центру (ЛЦД) «Ацинус» у власному приміщенні, де сьогодні проводять консультації і прийом практично за всіма лікарськими спеціальностями.
Це єдина в області багатопрофільна приватна клініка, оснащена сучасним обладнанням, в якій медичне обслуговування та індивідуальний підхід до пацієнта відповідають європейському рівню. Прийом ведеться лікарями 45 спеціальностей згідно з ліцензією і сертифікатом акредитації МОЗ України вищої категорії.
Сучасна діагностична база, налагоджена робота досвідчених фахівців допомагають пацієнтові пройти весь складний шлях — від діагностики і перших кроків лікування до повного одужання, формування навичок і звичок здорового способу життя, оптимістичного погляду на власне здоров’я і навколишній світ.
Однією з основних цілей роботи підприємства в цілому та клініки зокрема є забезпечення населення якісною та доступною медичною та фармацевтичною допомогою. Особливо це стосується онкологічних хворих, терапія яких є високовартісною та в переважній більшості недоступною для пересічного жителя України.
Практичним аспектам діагностики та лікування онкологічних захворювань, а також ролі клінічних випробувань у забезпеченні доступності терапії в цій сфері медицини була присвячена третя частина конференції. Імунотерапія раку легені, сучасні принципи системного лікування раку молочної залози, молекулярна генетика як ключ до ефективного скринінгу діагностики та лікування онкозахворювань, рак ротової порожнини як об’єкт проведення клінічних досліджень, молекулярне профілювання в практиці лікаря-онколога — всі ці та багато інших важливих тем обговорювалися провідними лікарями, науковцями та дослідниками України в рамках заходу.
Фахівці підкреслили, що саме клінічні дослідження дають можливість пацієнтам отримати не лише якісне лікування безкоштовно, а й супутню терапію та пройти діагностику, що також коштує дорого та часто просто недоступна через брак технічного устаткування у лікувально-профілактичних закладах.
Клінічні дослідження є прекрасною можливістю для здорового та довгого життя!
фото автора

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим