Определение термина «редкое заболевание» в законодательствах различных стран отличается. Так, в США редким заболеванием считается патология, диагностированная менее чем у 200 тыс. человек, что составляет менее 6,4 пациента на 10 тыс. человек (из расчета, что население США составляет 314 млн человек). Национальная организация редких заболеваний США (National Organization for Rare Disorders), которая сыграла важную роль в создании упомянутого закона в 1983 г., в настоящее время насчитывает 30 млн участников, у которых диагностировано порядка 7 тыс. различных редких заболеваний. В ЕС же под определение «редкое заболевание» подпадают состояния, отмечаемые менее чем у 5 пациентов на 10 тыс. человек или у 250 тыс. больных при том, что население стран ЕС составляет 506 млн человек.
До принятия в 1983 г. закона в поддержку разработки этой группы лекарственных средств в США было одобрено всего лишь 38 препаратов для лечения редких заболеваний. По итогам 2012 г. регуляторными органами США одобрено уже 347 лекарственных средств, применение которых показано при 425 различных заболеваниях. Дополнительным свидетельством успеха законодательных инициатив США стало принятие аналогичных законов Японией (в 1993 г.) и ЕС (в 2000 г.).
Одной из ключевых законодательных инициатив, призванных активизировать разработку лекарственных средств для лечения этой группы заболеваний, является продление срока их патентной защиты. Так, в США срок патентной защиты с момента одобрения препарата регуляторными органами составляет 7 лет, при этом во многих случаях срок действия патента на активные вещества, входящие в состав орфанных препаратов, превышает 7 лет. Законодательно созданы условия, которые блокируют выведение на рынок аналогичных лекарственных средств, за исключением тех случаев, когда для нового препарата было доказано наличие лучших показателей эффективности и/или профиля безопасности. В ЕС срок патентной защиты для этой группы лекарственных средств составляет 10 лет.
США предоставляет различные финансовые льготы компаниям, которые разрабатывают орфанные препараты. Среди прочего, таким компаниям полагается 50% налоговый кредит на R&D-расходы. Также правительство США дает гранты на проведение I–III фазы клинических исследований в объеме 30 млн дол. США ежегодно, начиная с 2008 г. Отменены налоговые сборы с потребителей этой продукции, что делает ее более доступной и способствует увеличению объема продаж таковой в натуральном выражении.
В ЕС, где законодательство, направленное на поддержку разработки и выведения на рынок орфанных препаратов, было принято только в 2000 г., по состоянию на 2012 г. зарегистрировано 70 лекарственных средств для лечения 55 редких заболеваний. Следует отметить, что до 2000 г. было зарегистрировано всего лишь 8 таких препаратов. Рекордные показатели по количеству одобренных орфанных лекарственных средств зафиксированы в 2007 г., когда лицензию на маркетирование в ЕС получили 13 лекарственных средств этой группы. Также удачным, с этой точки зрения, был и 2012 г. с показателем 10 орфанных препаратов. За 1-е полугодие 2013 г. были одобрены только 2 лекарственные средства для лечения редких заболеваний.
В разрезе терапевтических групп орфанные препараты, одобренные в ЕС в 2002–2013 гг., распределились следующим образом:
- A «Средства, влияющие на пищеварительную систему и метаболизм» — 11 препаратов;
- B «Средства, влияющие на систему крови и гемопоэз» — 2 препарата;
- C «Средства, влияющие на сердечно-сосудистую систему» — 5 препаратов;
- G «Средства, влияющие на мочеполовую систему и половые гормоны» — 1 препарат;
- H «Препараты гормонов для системного применения (кроме половых гормонов и инсулинов)» — 3 препарата;
- J «Противомикробные средства для системного применения» — 2 препарата;
- L «Антинеопластические и иммуномодулирующие средства» — 29 препаратов;
- N «Средства, действующие на нервную систему» — 6 препаратов;
- R «Средства, действующие на респираторную систему» — 2 препарата;
- V «Различные средства» — 2 препарата.
Таким образом, наибольшее внимание со стороны фармацевтических компаний привлекают лекарственные средства для лечения онкологических заболеваний и иммуномодуляторы.
Рынок орфанных препаратов — перспективное направление развития
Согласно данным аналитической компании «EvaluatePharma®», с 2012 г. по 2018 г. среднегодовой прирост мирового рынка орфанных лекарственных средств в денежном выражении составит 7,4% (рис. 1). Таким образом, доход от продаж таких препаратов в 2018 г. достигнет 127 млрд дол. США. При этом, для сравнения, среднегодовой прирост рынка орфанных лекарственных средств, как ожидается, будет почти вдвое превышать аналогичный показатель для Rx-сегмента фармацевтического рынка (за исключением генериков), который, как ожидается, в период с 2012 г. по 2018 г. будет расти на 3,7% ежегодно. Благодаря этому удельный вес орфанных препаратов может увеличиться, достигнув в 2018 г. 15,9% в общем объеме продаж рецептурных лекарственных средств (за исключением генериков). Для сравнения, данный показатель за 20 лет до этого — в 1998 г. — был более чем в 3 раза ниже — 5,1%. В 2012 г. по сравнению с предыдущим годом продажи орфанных препаратов выросли на 7,1% — до 83 млрд дол., при этом объем рынка рецептурных препаратов (за исключением генериков) сократился на 2,1% — до 645 млрд дол.
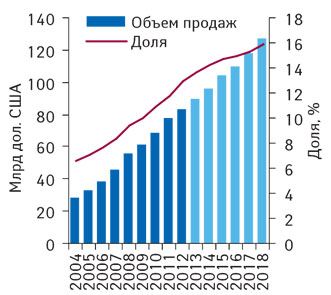
Лидеры мирового рынка орфанных лекарственных средств
Ожидается, что в 2018 г. «Novartis» сохранит свою позицию в рейтинге топ-10 компаний по объему продаж орфанных препаратов в денежном выражении (рис. 2). Так, удержать 1-е место компании удастся благодаря доходам от продаж лекарственных средств для лечения редких заболеваний на уровне 11,8 млрд дол. Маркетинговая стратегия компании в разрезе орфанных препаратов строится вокруг таких перспективных лекарственных средств, как Gleevec™/Glivec™/Гливек® (иматиниб) и Tasigna®/Тасигна (нилотиниб), предназначенных для лечения хронического миелогенного лейкоза и злокачественных новообразований желудочно-кишечного тракта. Также ожидается, что позиции компании «Roche» останутся неизменными, при этом значительно улучшит свое положение биотехнологическая компания «Celgene», которая поднимется в рейтинге на 2 позиции и займет 3-е место. Также положительная динамика, как ожидается, будет отмечаться в продажах «Sanofi», «Bristol-Myers Squibb», «GlaxoSmithKline» и «Alexion Pharmaceuticals», которые поднимутся в рейтинге на 4, 9, 12 и 12 позиций соответственно. Подобные изменения свидетельствуют о росте внимания со стороны крупных мультинациональных фармацевтических компаний к рынку орфанных препаратов.
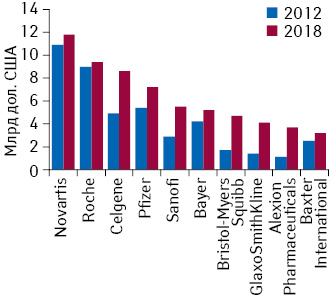
Кроме того, следует отметить, что этот рынок в 2018 г. станет еще менее консолидированным по сравнению с 2012 г., что свидетельствует о высокой конкуренции, а ротации в списке топ-10 компаний по объему продаж орфанных лекарственных средств в денежном выражении демонстрируют желание многих из них отхватить и себе кусок этого перспективного пирога.
Какие же препараты обеспечили упомянутым выше компаниям успех? Согласно прогнозам, самым продаваемым в мире орфанным лекарственным средством в 2018 г. станет препарат моноклональных антител Rituxan®/Мабтера® (ритуксимаб) компании «Roche» с объемом продаж почти 6,9 млрд дол. (рис. 3). При этом следует отметить, что этот показатель в 2018 г. останется почти на таком же высоком уровне, как и по итогам 2012 г. Rituxan® был впервые одобрен в 1997 г. в качестве орфанного лекарственного средства для лечения В-клеточных неходжкинских лимфом, а в последствии — для терапии хронической лимфоцитарной лейкемии, а также еще по одному показанию, не относящемуся к редким заболеваниям, — для применения при ревматоидном артрите. Вторая позиция в рейтинге, как ожидается, достанется иммуномодулятору Revlimid® (леналидомид) компании «Celgene», показанному при множественной миеломе и миелодиспластическом синдроме. Следует отметить, что его объем продаж в течение 2012–2018 гг. будет увеличиваться ежегодно на 10%, что позволит ему практически удвоиться за этот период и достичь 6,6 млрд дол. Еще более внушительные темпы прироста прогнозируются для препарата, замыкающего топ-3 данного рейтинга, — Soliris® (экулизумаб) компании «Alexion Pharmaceuticals» — 20% в денежном выражении в год в период 2012–2018 гг. А рекордсменом по динамике прироста объема продаж стал препарат Afinitor®/Афинитор® (эверолимус) компании «Novartis», среднегодовой темп увеличения объема продаж которого составил 24% в денежном выражении.
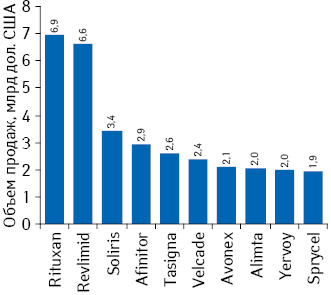
Стоимость разработки орфанных лекарственных средств
В контексте перспектив развития рынка орфанных препаратов наряду с объемами продаж большой интерес представляют собой R&D-расходы, связанные с разработкой этой группы лекарственных средств, и продуктивность самих исследований. И тут орфанные препараты располагают неоспоримыми преимуществами, которые призваны стимулировать их разработку. Так, в среднем расходы на клинические исследования ІІІ фазы (в среднем самой дорогостоящей фазы клинических исследований) орфанного лекарственного средства составляют всего около половины по сравнению с остальными препаратами и оцениваются на уровне 85 млн дол. (против 186 млн дол.). Кроме того, в США, где при разработке орфанных препаратов компании полагается 50% налоговый кредит, стоимость данной фазы исследований может сократиться до 43 млн дол.
Более низкая стоимость клинических исследований ІІІ фазы, кроме наличия налогового кредита, связана также с меньшим количеством пациентов, которых необходимо задействовать в исследовании. Так, в среднем в клиническом исследовании ІІІ фазы неорфанного лекарственного средства принимают участие более 3,7 тыс. больных, а орфанного — чуть больше 600. По остальным показателям, характеризующим клинические исследования, например таким, как продолжительность, орфанные и неорфанные препараты практически не отличаются. Также в этом контексте необходимо отметить, что в среднем время, затрачиваемое фармацевтическими компаниями на процесс одобрения лекарственного средства, для орфанных препаратов составляет 9 мес, что на 1 мес меньше по сравнению с неорфанными.
Различие средней стоимости проведения исследования ІІІ фазы и количества задействованных пациентов в основном и обуславливают значительные различия показателей ожидаемой окупаемости инвестиций для орфанных и неорфанных лекарственных средств. Так, этот показатель для ІІІ фазы клинических исследований и подачи документов на одобрение орфанных препаратов характеризуется в 1,7 раза более высоким его значением по сравнению с остальными лекарственными средствами (без учета налоговых льгот, предоставляемых компаниям в США). Доход от продаж орфанных препаратов в 10,3 раза превышает вложения в ІІІ фазу их клинических исследований, а этот же показатель для прочих лекарственных средств составляет 6.
Среди орфанных препаратов, которые сейчас находятся в стадии разработки, в топ-10 наиболее перспективных попали лекарственные средства таких крупных мультинациональных фармацевтических компаний, как «Eli Lilly», «Roche», «Novo Nordisk», «GlaxoSmithKline», «Bristol-Myers Squibb» и «Bayer», целых 2 препарата которой вошли в этот рейтинг (табл. 1). При этом 6 из 10 компаний, чьи кандидаты в препараты попали в данный рейтинг, получили права на эту продукцию благодаря М&А-активности и приобретению прав на разработку/маркетирование лекарственного средства, и только 4 разработали орфанные препараты самостоятельно.
Первая позиция в данном рейтинге принадлежит кандидату в препараты на основе моноклональных антител к рецептору фактора роста эндотелиоцитов (Vascular Endothelial Growth Factor Receptor) — IMC-1121B («Eli Lilly»), предназначенному для лечения редких типов рака желудка и печени, а также ряда более распространенных онкологических заболеваний. Прогнозируется, что в 2018 г. чистая приведенная стоимость (Net present value — NPV) данного проекта составит более 3,5 млрд дол. NPV показывает объем средств, которые инвестор ожидает получить от проекта после того, как денежные притоки окупят его первоначальные инвестиционные вложения и периодические денежные оттоки, связанные с осуществлением проекта. В упрощенном виде NPV можно трактовать как стоимость, добавляемую проектом.
| Таблица 1 | Топ-10 наиболее перспективных кандидатов в орфанные препараты |
| Кандидат в препараты | Компания | Прогнозированный объем продаж в 2018 г., млн дол. США | NPV, млрд дол. | Расходы на клинические исследования III фазы, млн дол. США |
|---|---|---|---|---|
| IMC-1121B | Eli Lilly | 813 | 3,529 | 110 |
| RG3638 | Roche | 660 | 3,456 | 135 |
| Ibrutinib | Pharmacyclics | 1283 | 3,427 | 96 |
| Opsumit | Actelion | 969 | 2,546 | 124 |
| Riociguat | Bayer | 749 | 1,964 | 129 |
| N9-GP | Novo Nordisk | 487 | 1,766 | 64 |
| GSK2118436 | GlaxoSmithKline | 549 | 1,743 | 119 |
| BAX 111 | Baxter | 397 | 1,675 | 15 |
| Elotuzumab | Bristol-Myers Squibb | 418 | 1,507 | 134 |
| BAY 86–6150 | Bayer | 301 | 1,323 | 27 |
Работа на результат
В 2012 г. из 43 новых препаратов, одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA), 15 были классифицированы как орфанные. Для сравнения, в 2011 г. этот показатель составил 11. Таким образом, на долю орфанных лекарственных средств в структуре одобренных FDA в 2012 г. пришлось 35%.
Самым перспективным среди орфанных препаратов, одобренных FDA в 2012 г., является Kyprolis (карфилзомиб) компании «Onyx», предназначенный для лечения множественной миеломы (табл. 2). Ожидается, что в 2017 г. объем его продаж только в США составит 897 млн дол.
| Таблица 2 | Топ-10 орфанных препаратов, одобренных FDA в 2012 г., по прогнозируемому объему продаж в США в 2017 г. |
| Препарат | Показание к применению | Компания | Объем продаж в США в 2012 г., млн дол. | Прогнозируемый объем продаж в США в 2017 г., млн дол. США | Расходы на клинические исследования ІІІ фазы, млн дол. США |
|---|---|---|---|---|---|
| Kyprolis | Множественная миелома | Onyx Pharmaceuticals | 64 | 897 | 118 |
| Kalydeco | Цистический фиброз | Vertex Pharmaceuticals | 172 | 706 | 115 |
| Iclusig | Острая лимфобластная лейкемия | ARIAD Pharmaceuticals | – | 538 | 80 |
| Jetrea | Вспомогательное средство при витрэктомии в педиатрии | ThromboGenics | – | 382 | 98 |
| Signifor | Болезнь Кушинга | Novartis | 3 | 352 | 128 |
| Inlyta | Рак почки | Novartis | 59 | 252 | 117 |
| Gattex | Синдром укороченной тонкой кишки | Pfizer | – | 250 | 98 |
| Juxtapid | Гомозыготная семейная гиперхолестеринемия | Aegerion Pharmaceuticals | – | 244 | 22 |
| Elelyso | Болезнь Гоше | Pfizer | 6 | 148 | 50 |
| Bosulif | Хронический миелоидный лейкоз | Pfizer | 7 | 147 | 76 |
При этом в ЕС в 2012 г. на 36% увеличилось количество заявок относительно получения разрешения на маркетирование орфанных лекарственных средств по сравнению с предыдущим годом. В общей сложности Европейское агентство по лекарственным средствам (European Medicines Agency — ЕМА) рассмотрело 19 таких заявок. Также следует отметить, что 72% одобренных орфанных препаратов показаны для применения не только у взрослых, но и у детей. Необходимо подчеркнуть, что, согласно данным ЕМА, в последние годы увеличивается количество кандидатов в орфанные лекарственные средства. Так, в 2011 г. на рассмотрение в ЕМА было подано 107 наименований таковых, в 2012 г. — 148, а в 2013 г. ожидается подача более 150 заявок.
Орфанные препараты в системе здравоохранения
Несмотря на то что, как показано выше, орфанные препараты занимают заметное место в структуре продаж рецептурных лекарственных средств, удельный вес расходов на их приобретение в структуре затрат на лекарственные средства невелик. Так, доля орфанных препаратов в структуре расходов Бельгии в 2008 г. составляла всего 1,9%, а в 2009 г. возросла до 2%, во Франции и Нидерландах данный показатель в 2004 г. оценивался на уровне 0,7 и 1% соответственно. Доля орфанных лекарственных средств в общем объеме расходов на препараты была несколько выше в Германии — 2,1%, в Великобритании она составила 1%, в Италии — 1,5%, в Испании — 2%. В среднем данный показатель для топ-5 стран ЕС по объему расходов на лекарственные средства оценивается на уровне 1,7%. При этом, учитывая прогнозируемый рост рынка орфанных препаратов, некоторые авторы приходят к выводу, что удельный вес таковых в объеме расходов на лекарственные средства будет увеличиваться (Wilson H. et al., 2012).
Таким образом, благодаря продуманным и удачно воплощенным в жизнь законодательным инициативам таких развитых государств, как США, Япония, а также стран ЕС, сегодня достигнут значительный прогресс в решении проблемы лечения редких заболеваний и доступности орфанных препаратов для пациентов. Тем не менее до полного решения проблемы еще далеко. Сегодня насчитывается порядка 5–7 тыс. различных редких заболеваний, из которых всего лишь для 1% в ЕС одобрены лекарственные средства. Потому работа по стимулированию создания новых орфанных препаратов еще далека от завершения, следовательно, рынок лекарственных средств обладает значительными резервами для роста и развития.
по материалам www.ema.europa.eu; www.evaluategroup.com; www.ojrd.com, www.orpha.net; www.thomsonreuters.com

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим