
Елена Говоркова, директор лабораторії у відділі інфекційних захворювань Дитячого дослідницького госпіталю ім. Св. Юди (Мемфіс, штат Тенессі, США) і фахівець Американського національного центру з вивчення і контролю грипу
На Третьому противірусному конгресі, який відбувся 12–14 жовтня 2014 р. в Амстердамі, були вперше презентовані нові багатообіцяючі результати міжнародних досліджень Амізону. Враховуючи велику актуальність теми противірусної терапії редакція «Щотижневику АПТЕКА» звернулася з проханням прокоментувати нові дані, отримані в ході досліджень ефективності та профілю безпеки Амізону, до авторитетних вчених, що брали участь у цьому заході. Нашими співрозмовниками стали Елена Говоркова і Дейвід Больц.
Елена Говоркова (Е.Г.) (MD, PhD) — директор лабораторії у відділі інфекційних захворювань Дитячого дослідницького госпіталю ім. Св. Юди (Мемфіс, штат Тенессі, США) і один з провідних фахівців Американського національного центру з вивчення і контролю грипу. Її наукові інтереси спрямовані на дослідження ефективності препаратів проти вірусів грипу (включаючи високопатогенні штами), а також на вивчення молекулярно-біологічних і генетичних властивостей резистентних вірусів. Е. Говоркова є автором понад 110 оригінальних наукових публікацій у провідних міжнародних журналах і володарем декількох американських і російських патентів. Є членом ряду наукових товариств, а також редакційних рад журналів «Antiviral Research», «Antimicrobial Agents and Chemotherapy», «Vaccine, Journal of Infectious Diseases».
Дейвід Больц (Д.Б.) (PhD) — науковий співробітник відділу мікробіології і молекулярної біології НДІ Іллінойського технологічного інституту (Чикаго, штат Іллінойс, США). Ось вже більше 10 років він займається питаннями патогенезу вірусних захворювань, доклінічними дослідженнями антивірусної активності вакцин і хіміотерапевтичних препаратів. Є членом Американського товариства вірусологів (American Society for Virology).

Дейвід Больц, науковий співробітник відділу мікробіології і молекулярної біології Іллінойського НДІ технології (Чикаго, штат Іллінойс, США).
Е.Г.: Проблема лікування та профілактики грипу та ГРВІ ніколи не втрачала своєї актуальності, а після спалахів так званого пташиного грипу, пандемії свинячого грипу в 2009 р. стала ще більш нагальною. Це обумовлено як необхідністю пошуку ефективної терапії при тяжких випадках захворювання, так і можливістю виникнення резистентності вірусів до існуючих лікарських засобів. Наприклад, епідемічні штами вірусу грипу А підтипів Н1N1 і H3N2 стали нечутливими до препарату римантадин.
Розробка противірусних препаратів ведеться за кількома перспективними напрямками. Це пошук препаратів із прямою дією на білки вірусу грипу (інгібітори нейрамінідази, гемаглютиніну, полімеразного комплексу). Це і препарати, що захищають клітини людини від вірусу грипу шляхом видалення рецепторів, до яких прикріплюється вірус. І, нарешті, це лікарські засоби, здатні активувати неспецифічні механізми противірусного захисту (наприклад різні імуномодулятори).
При цьому бажано, щоб препарати мали додаткові властивості, які можуть вплинути на процес патогенезу вірусної інфекції. Зокрема, важлива їх протизапальна активність, оскільки запалення відіграє значну роль у розвитку інфекційного процесу при грипі та ГРВІ. Надлишкові запальні реакції можуть стати пусковим механізмом для розвитку ускладнень і тяжких форм цих захворювань.
Безумовно, вакцинація довела свою протиепідемічну ефективність. Але й грипозні вакцини мають ряд недоліків: можливу невідповідність штамового складу вакцини й актуального різновиду вірусу, а також значний період, необхідний для розробки клінічно доступної вакцини проти нового вірусного штаму. Тому поряд з вакцинацією необхідно мати можливість застосування ефективних противірусних засобів для негайного лікування інфекції.
На даний час тільки один клас вірусспецифічних препаратів (а саме інгібітори нейрамінідази озельтамівір і занамівір) рекомендований для профілактики та лікування грипу у дорослих і дітей. Поява вірусів грипу, резистентних до інгібіторів нейрамінідази, стала значною проблемою системи охорони здоров’я. Висока поширеність вірусів H1N1 з мутацією H275Y, яка обумовлює резистентність до інгібіторів нейрамінідази, була зафіксована в усьому світі під час сезонних епідемій грипу у 2007–2009 рр.
Іншим моментом, що обмежує застосування інгібіторів нейрамінідази, є широка циркуляція вірусної мікст-інфекції, оскільки в цьому разі необхідні препарати, що ефективно діють не тільки на віруси грипу, а й на інші віруси, які уражують респіраторний тракт. Крім того, зрозуміло, що слід розробляти і впроваджувати лікарські засоби з різними механізмами протигрипозної дії, а не тільки інгібітори нейрамінідазної активності. Тоді з’явиться можливість застосування комбінованої терапії та, потенційно, значного зниження частоти ускладнень при грипозній інфекції.
Розробка та вивчення нового лікарського засобу — складний і багатоступінчастий процес. Тому, відповідаючи на дане питання, необхідно розділити доклінічну і клінічну стадії дослідження. Доклінічна стадія проводиться з використанням культури клітин і на лабораторних тваринах. При проведенні цих досліджень слід оцінити не тільки ефективність і профіль безпеки препарату, а й зрозуміти можливий механізм його дії. У культурі клітин визначають придушення специфічної вірусної активності і зниження вірусних титрів із встановленням дозозалежного ефекту. В експериментах на тваринах оцінюють ступінь наданого препаратом захисту від грипозної інфекції.
На клінічній стадії досліджень найбільш важливими залишаються критерії оцінки стану пацієнта: вираженість основних клінічних симптомів, тривалість захворювання, наявність ускладнень. Разом з тим необхідно використовувати і вірусологічні критерії, що дозволяють оцінювати рівень зниження реплікації вірусу у верхніх дихальних шляхах людини.
Ряд високотехнологічних сучасних підходів застосовується для встановлення механізму дії досліджуваних препаратів. До них належать різні молекулярно-генетичні методи, скринінг рецепторів, визначення рівня цитокінів та хемокінів, а також аналіз клітинних факторів.
Одним з багатообіцяючих противірусних препаратів для лікування грипу та ГРВІ є Амізон. Амізон являє собою оригінальну хімічну сполуку, що належить до похідних ізонікотинової кислоти. На Третьому противірусному конгресі, який відбувся 12–14 жовтня 2014 р. в Амстердамі (Нідерланди), Д. Больцем були представлені переконливі результати противірусної ефективності Амізону щодо вірусів грипу та деяких інших РНК-вмісних респіраторних вірусів. За результатами проведених клінічних досліджень в НДІ грипу в Санкт-Петербурзі, Амізон виявляє виражений клінічний ефект при грипі та ГРВІ.
Таким чином, Амізон — це оригінальний препарат і дотепер ні на ринку США, ні на ринках інших економічно розвинених країн хіміко-фармацевтичних аналогів цього препарату немає.
Д.Б.: Ми досліджували противірусну активність Амізону, точніше його активної речовини енісаміуму йодиду, проти грипу і респіраторно-синцитіального вірусу in vitro. Використовуючи диференційовані нормальні бронхоепітеліальні клітини людини (Normal Human Bronchial Epithelial Cells — NHBE), ми продемонстрували, що енісаміум (Амізон) ефективно пригнічує (більше ніж 100-кратно) реплікацію різних підтипів вірусів грипу типу А (H1N1, H1N1pdm09 і H3N2), а також грипу типу B. Крім того, енісаміум (Амізон) пригнічував реплікацію резистентного до озельтамівіру вірусу грипу А (H1N1) з мутацією H275Y. У додаткових експериментах, в яких енісаміум (Амізон) додавали до клітин NHBE через різні проміжки часу, впливаючи на різні стадії циклу реплікації вірусу грипу, відзначено значне зниження вірусних титрів (p<0,05) протягом 8 год після інфікування клітин. При додаванні енісаміуму (Амізон) протягом перших 4 год після інфікування зафіксовано зниження титру вірусу більше ніж в 100 разів, що свідчить про вплив енісаміуму (Амізон) на початковій стадії реплікації вірусу грипу.
Також встановлено, що енісаміум (Амізон) ефективно пригнічує реплікацію респіраторно-синцитіального вірусу в клітинах NHBE (більше ніж 100-кратно), що корелює зі значним зниженням внутрішньоклітинного рівня вірусного РНК.
Таким чином, енісаміум (Амізон) чинить противірусну активність проти вірусів грипу А і В in vitro, а також проти респіраторно-синцитіального вірусу. На даний час отримані попередні результати, що свідчать про високу противірусну ефективність енісаміуму (Амізон) також відносно адено- і коронавірусів. Можна зробити висновок про те, що енісаміум (Амізон) може діяти як противірусний засіб широкого спектру дії, що може виявитися особливо цінним в лікуванні при грипі та ГРВІ.
Післямова
На Третьому противірусному конгресі, який відбувся 12–14 жовтня 2014 р. в Амстердамі, американськими вченими були вперше представлені докази того, що Амізон чинить противірусну активність не тільки по відношенню до вірусів грипу А і В, але також і до респіраторно-синцитіального вірусу, який зумовлює тяжкі гострі респіраторні захворювання у дітей. У рандомізованих плацебо-контрольованих клінічних дослідженнях, проведених в НДІ грипу в Санкт-Петербурзі, було переконливо продемонстровано, що Амізон має виражену клінічну і противірусну ефективність відносно вірусів грипу А (H1N1, H3N2) і В, парагрипу, аденовірусу, респіраторно-синцитіального вірусу і відрізняється сприятливим профілем безпеки.
Вищенаведені факти дозволяють стверджувати, що Амізон є ефективним противірусним лікарським засобом із сприятливим профілем безпеки, показаним для застосування при грипі та ГРВІ.
за матеріалами, наданими компанією «Фармак»
Противірусна активність енісаміуму [Амізону] щодо вірусів грипу у диференційованих нормальних клітинах епітелію бронхів людини*
Дейвід Больц (David Boltz) 1 , Синьцзян Пен (Xinjian Peng) 1 , Мігель Муззіо (Miguel Muzzio) 1 , Прадйот Даш (Pradyot Dash) 2 , Пол Томас (Paul Thomas) 2 , Раджендра Мехта (Rajendra Mehta) 1 , і Віктор Маргітич (Victor Margitich) 3
1Науково-дослідний інститут Іллінойського технологічного Інституту (Illinois Institute of Technology (IIT) Research Institute), Чикаго, Іллінойс, США; 2Дитячий дослідницький госпіталь імені святого Юди (St. Jude Children Research Hospital), Мемфіс, Теннессі, США; 3ПАТ «Фармак», Київ, Україна
Екскурс у проблему
Грип — це гостре респіраторне захворювання, що викликається вірусами грипу А і В, які спричиняють розвиток щорічних епідемій з високим рівнем захворюваності та смертності, а іноді й пандемій. Хоча вакцини для профілактики грипу довели свою ефективність у зменшенні вираженості симптомів захворювання під час епідемій грипу, однак у зв’язку з можливою антигенною невідповідністю вакцини та відносно довготривалим процесом розробки клінічно доступної вакцини проти нового штаму вірусу створення ефективних противірусних препаратів для пригнічення інфекційного процесу при грипі є актуальним завданням. Наразі лише один клас противірусних препаратів (інгібітори нейрамінідази, такі як озельтамівір [Tamiflu®, «Roche»] і занамівір [Relenza®, «GlaxoSmithKline»]) рекомендовано для використання з метою профілактики та лікування грипу у дорослих та дітей у всьому світі.
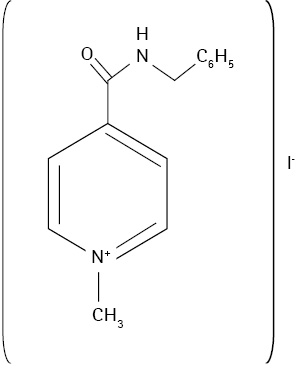
Сьогодні значні зусилля зосереджені на розробці нових способів лікування і вибору мішеней для дії лікарських засобів, які дали б змогу усунути патогенні властивості вірусу грипу. У цьому контексті привертають увагу деякі препарати, що наразі знаходяться на ринку країн СНД та виявляють противірусну активність щодо вірусів грипу А і В. Одним з таких препаратів є енісаміуму йодид, що зареєстрований та маркетується під торговою назвою Амізон® в Україні, Росії, Білорусі, Казахстані та Узбекистані як противірусний засіб проти грипу.
Клінічні дослідження, проведені в Росії, продемонстрували високу ефективність препарату проти вірусів грипу А і В, що дозволило говорити про енісаміум як про перспективний засіб, призначений для лікування грипу. Однак наявні експериментальні дані про ефективність цієї похідної ізонікотинової кислоти як противірусного агента, дієвого щодо грипу, є недостатніми. Тож метою даного дослідження було оцінити очікувану противірусну активність енісаміуму щодо вірусів грипу in vitro. Пілотні дослідження на MDCK- та A549-клітинах продемонстрували низьку проникність енісаміуму — на рівні 0,08 і 0,87% відповідно, а також відсутність противірусного ефекту. Поглинання енісаміуму диференційованими нормальними бронхоепітеліальними клітинами людини (normal human bronchial epithelial — NHBE) було кращим порівняно з клітинами A549 та MDCK, та варіювало в межах 1,7–2,1%. Тому саме культури клітин NHBE були обрані для оцінки ефективності та наявності противірусного ефекту енісаміуму щодо вірусів грипу.
Матеріали та методи
Культура клітин: у досліджені були використані диференційовані клітини NHBE EpiAirway System компанії «MatTek» (Ашланд, Массачусетс, США). Клітини від одного донора були використані для аналізу однорідності. Апікальну поверхню клітин піддавали впливу вологого 95% повітря/5% CO2, а також заміняли середовище та відмивали муцин кожні 24–48 год.
Матеріали, що досліджуються: продукт, що досліджувався — енісаміум (Амізон®), був наданий ПАТ «Фармак». Препарат для позитивного контролю — озельтамівіру карбоксилат, отриманий від «Toronto Research Chemicals, TRC» (Торонто, Канада).
Вірусний агент: в NHBE-клітини було інокулювано віруси грипу А через апікальну поверхню. Після інкубації протягом 1 год вірусний інокулят видаляли з клітин, апікальну поверхню клітин промивали натрій-фосфатним буферним розчином (Phosphate Buffered Saline — PBS).
Введення матеріалу, що досліджується: для проведення позитивного контролю (використання озельтамівіру карбоксилату) культура клітин NHBE інкубувалася з базального боку з озельтамівіром протягом 60 хв до зараження вірусом. Енісаміум або контроль додавали до базального компартменту культури клітин до або після інокуляції та інкубувався протягом визначеного умовами експерименту періоду.
Результати
| Таблиця 1 | Противірусна активність енісаміуму щодо вірусів грипу А та В у культурі диференційованих NHBE-клітин |
| Титри вірусу грипу, log10TCID50/мл±SD | |||||
| Доза препарату (µM)a | A/GA/20/06(H1N1) H275Y | A/Brisbane/59/07(H1N1) | A/TN/1-560/09(H1N1) | A/Perth/16/09(H3N2) | B/Texas/06/11 |
| 0 | 6,9±0,4 | 5,58±0,1 | 7,58±0,7 | 6,7±0,5 | 6,8±0,4 |
| Озельтамівірb Енісаміум |
6,0±0,4 (–0,9) | 3,08±0,6 (–2,5)c | 3,75±0,4 (–3,8) | 3,0±0,4 (–3,2) | 4,9±0,3 (–1,8) |
| 40 | 6,5±0,0 (–0,4) | 5,67±0,1 (ND) | 6,50±0,3 (–1,1) | 6,2±0,9 (–0,5) | 6,2±0,6 (–0,6) |
| 200 | 6,2±0,6 (–0,8) | 5,50±0,3 (–0,1) | 6,75±0,0 (0,8) | 6,3±0,1 (–0,3) | 5,8±0,5 (–1,0) |
| 600 | 5,1±0,3 (–1,8) | 4,33±1,0 (–1,25) | 5,67±0,1 (–1,9) | 4,8±0,4 (–1,8) | 4,8±0,4 (–1,9) |
| 1000 | 4,8±0,5 (–2,1) | 3,25±0,5 (–2,3)c | 4,83±0,1 (–2,8) | 4,1±0,7 (–2,6) | 4,6±0,1 (–2,2) |
| Таблиця 2 | Проникність енісаміуму у диференційовані клітини NHBE |
| Доза препарату, µMa | nb | Концентрація у NHBE клітинах, середнє значення±SD, нгc | Проникність, % |
| 10 | 3 | 36,8±3,8 | 1,4 |
| 50 | 3 | 213±34 | 1,6 |
| 100 | 3 | 410±77 | 1,6 |
| 500 | 3 | 1727±108 | 1,3 |
| 1000 | 3 | 3009±132 | 1,1 |
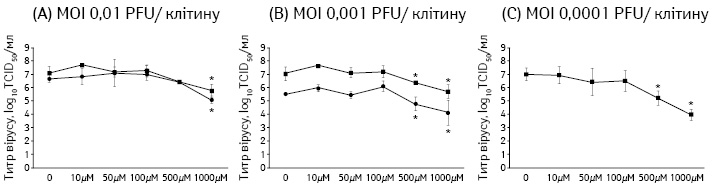
Диференційовані NHBE-клітини були інфіковані вірусом грипу A/Brisbane/59/2007 (H1N1) в кількості MOI=0,01 PFU/клітину (A), 0,001 PFU/клітину (B) та 0,0001 PFU/клітину (C). Енісаміум (1000; 500; 100; 50 і 10 µM) додавали до базального компартменту через 1 год після інокуляції вірусу. Змиви з апікальної поверхні клітин збирали через 24 год (чорні кружки) та 48 год (чорні квадрати) після зараження та титрували за допомогою TCID50-аналізу. Межове значення, що визначали в ході аналізу, становило 0,75 log10TCID50/мл.
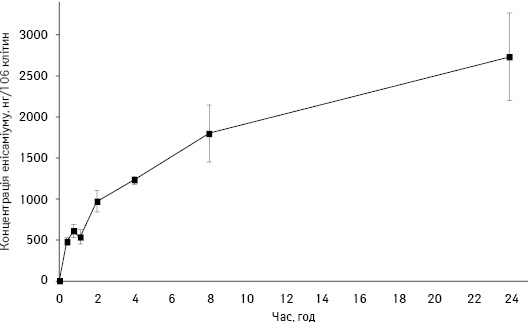
Неінфіковані NHBE-клітини обробляли 1000 µM енісаміуму, потім клітини відбирали через 0,25; 0,5; 1; 2; 4; 8 і 24 год після контакту з досліджуваною речовиною. Представлені концентрації енісаміуму в клітинах.
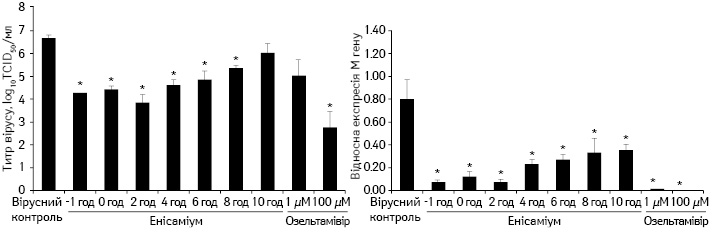
Диференційовані NHBE-клітини були інфіковані вірусом грипу A/Brisbane/59/2007 (H1N1) в кількості MOI=1,0 PFU/клітину й експонувалися з енісаміумом 2000 µM. Енісаміум додавали в базальний компартмент через –1, 0, 2, 4, 6, 8 і 10 год після інокуляції вірусу і залишали протягом 24 год. Час інокуляції вірусу вказується як 0 год. Супернатанти збирали через 24 год після зараження з верхнього відсіку і титрували за допомогою TCID50-аналізу (A). Експресія матричного гена (Matrix gene — M gene) пов’язана з контролем рівню вірусу, експресія гена була нормована за рівнем мРНК β-актину у відповідному зразку (B).
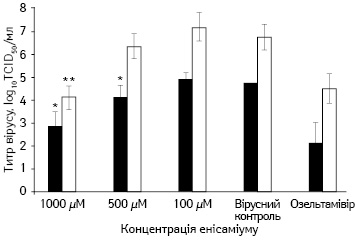
Диференційовані NHBE-клітини були попередньо оброблені енісаміумом 1000, 500, 100 µM за 24 год до інокуляції. Через 24 год до NHBE-клітин було інокулювано вірус грипу A/Brisbane /59/2007 (H1N1) в кількості MOI=0,001 PFU/клітину; енісаміум знаходився у культуральному середовищі з базального боку протягом усього експерименту. Озельтамівіру карбоксилат (1 µM) було додано до базального компартменту за 1 год до інокуляції вірусу, він знаходився там протягом усього експерименту. Час інокуляції вірусу вказується як 0 год. Супернатанти збирали через 24 год (чорні стовпчики) і 48 год (білі стовпчики) після інфікування.
Висновки
- Енісаміум дозозалежно знижує реплікацію всіх досліджуваних вірусів грипу, в тому числі сезонного H1N1, що мав мутацію H275Y NA, і таким чином виявляє ефективність проти озельтамівіррезистентного вірусу.
- Противірусна ефективність енісаміуму є дозозалежною, а ефект більш виражений при нижчих інфекційних дозах.
- Максимальна ефективність енісаміуму виявлена при його додаванні протягом 8 год після зараження.
- Внутрішньоклітинна концентрація енісаміуму, що досягається при його додаванні в кількості 1000 µM під час інфікування, корелює з противірусною ефективністю енісаміуму.
Виявлено противірусну активність протигрипозної сполуки — енісаміуму, що підтверджує дані про його клінічну ефективність. Хоча молекулярний механізм дії енісаміуму досі до кінця не ідентифіковано, дані, представлені вище, вказують на те, що енісаміум впливає на вірусну реплікацію вірусів грипу. У разі, коли енісаміум додавали перед або незабаром після інфікування, зниження експресії матричного гена і вірусних титрів вказує на те, що енісаміум інгібує синтез вірусної РНК. Цікаво, що вірусні титри продовжували підвищуватися в присутності енісаміуму. Тому можна зробити висновок, що енісаміум пригнічує реплікацію вірусу грипу, але не блокує її повністю. Необхідні подальші дослідження для забезпечення кращого розуміння механізму дії енісаміуму.
Подяка. Ця робота фінансувалася ПАТ «Фармак». Ми висловлюємо глибоку вдячність доктору Джону Моррі (John Morrey), Дональду Смі (Donald Smee) та Елені Говорковій (Elena A. Govorkova) за цінні поради та корисні обговорення в ході цих досліджень.
___________________
* Переклад постеру, представленого на Третьому противірусному конгресі, який відбувся 12–14 жовтня 2014 р. в Амстердамі

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим