|
|
Фармаконадзор в нашей стране развивается по цивилизованному пути. Отсюда — и увеличение количества сообщений о ПР при применении лекарственных средств (ЛС), и принимаемые по отношению к отдельным ЛС регуляторные меры, и рост вовлеченности производителей (см. ). И хотя по многим параметрам мы еще весьма далеки от желаемых результатов, на территории бывшего СССР мы едва ли не лучшие. Ведь недаром в Украине количество сообщений о ПР на душу населения — одно из самых больших, а к отечественным специалистам едут перенимать опыт их зарубежные коллеги. Вместе с тем врачи и фармацевты еще не научились адекватно выполнять свою миссию в системе фармаконадзора, то есть быть активными поставщиками и потребителями информации о безопасности применения ЛС, как впрочем и изделий медицинского назначения, медицинского оборудования и употребления пищевых/диетических добавок.
|
Количество сообщений о ПР, поступающих в ГФЦ МОЗ Украины позволяет нашу систему фармаконадзора называть состоявшейся |
Количество сообщений о ПР, получаемое Управлением пострегистрационного надзора Государственного фармакологического центра (ГФЦ) МЗ Украины в течение года, позволяет считать нашу систему фармаконадзора вполне состоявшейся (итоговая публикация за 2008 г., см. «Еженедельник АПТЕКА» № 13 (684) от 30.03.2009 г.). По этому показателю мы еще, конечно, не «просвещенная Европа», как Великобритания, где на 1 млн жителей приходится 369 сообщений, но и не страна, где этот показатель в десятки и сотни раз ниже (табл. 1).
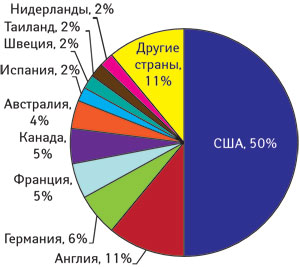
Конечно, безусловный мировой лидер по количеству сообщений о ПР — это США, но их Управление по контролю за пищевыми продуктами и лекарственными средствами (Food and Drug Administration — FDA) — первопроходец в регуляторной сфере со столетней историей, ведущей отcчет как раз от проблем с безопасностью (рис. 1).
Следует отметить, что в нашей стране, в отличие от США, стран — членов ЕС и, к примеру, Казахстана, Армении и Молдовы, пока не привлечены к подаче сообщений провизоры, фармацевты (и тем более пациенты). Однако внесение соответствующих изменений в законодательство Украины может значительно увеличить поток сообщений о ПР ЛС за счет репортирования работниками аптечной сети. Жалобы наподобие «Мне тут посоветовали, а стало еще хуже/не лучше» они выслушивают каждый день не один раз. А как себя показывают на деле пищевые/диетические добавки, детское питание, косметические средства, изделия медицинского назначения? Не правда ли, в аптеку такой информации поступает едва ли не больше, чем в поликлинику или больницу?
|
|
|
Таблица 1 |
Количество сообщений о ПР в постмаркетинговый период за последний отчетный год (2007–2008), поступивших в регуляторные органы разных стран, в расчете на 1 млн жителей (по официальной информации) |
|
Государство |
Количество |
Население, |
Количество сообщений |
|
США |
441 367 |
305 |
1447 |
|
Великобритания |
22 482 |
61 |
369 |
|
Финляндия |
1174 |
6 |
213 |
|
Украина |
6949 |
46 |
151 |
|
Армения |
70 |
3,2 |
22 |
|
Болгария |
157 |
8 |
21 |
|
Молдова |
63 |
3,4 |
19 |
|
Российская Федерация |
1074 |
142 |
8 |
|
Таблица 2 |
Топ-3 АТС-групп, ЛС из которых наиболее часто фигурировали в сообщениях о ПР, полученных с разных континентов (в скобках — названия 5 ЛС, лидировавших по количеству сообщений в каждой из групп) |
|
АТС |
Африка |
Азия |
Европа |
Северная Америка |
|
1 |
Нестероидные противовоспалительные и противоревматические ЛС (целекоксиб, рофекоксиб, диклофенак, пироксикам, индометацин) |
Бета-лактамные антибиотики, пенициллины (амоксициллин, клоксациллин, феноксиметилпенициллин, ампициллин, бензилпенициллин) |
Антидепрессанты (бупропион, пароксетин, венлафаксин, флуоксетин, циталопрам) |
Вирусные вакцины (против гепатита В; живая пероральная против полиомиелита; против краснухи/кори/эпидемического паротита; противогриппозная, живая против ветряной оспы) |
|
2 |
Антидепрессанты (бупропион, флуоксетин, венлафаксин, сертралин, циталопрам) |
Нестероидные противовоспалительные и противоревматические ЛС (ибупрофен, диклофенак, индометацин, мефенамовая кислота, напроксен) |
Нестероидные противовоспалительные и противоревматические ЛС (рофекоксиб, диклофенак, целекоксиб, ибупрофен, лефлуномид) |
Бактериальные вакцины (для профилактики дифтерии/столбняка/коклюша; против гемофильной инфекции конъюгированная, дифтерийный/столбнячный анатоксины; для профилактики дифтерии/столбняка/коклюша/гемофильной инфекции; пневмококковая полисахаридная) |
|
3 |
Бета-лактамные антибиотики, пенициллины (амоксициллин, амоксициллин/клавулонат, бензилпенициллин, оксациллин, ампициллин) |
Сульфаниламиды и триметоприм (сульфаметоксазол/триметоприм; сульфадиазин, сульфаметоксазол; сульфален/триметоприм, сульфадиазин/триметоприм) |
Бактериальные вакцины (менингококковая полисахаридная, против дифтерии и столбняка; против дифтерии, коклюша и столбняка; против гемофильной инфекции конъюгированная; пневмококковая полисахаридная) |
Антидепрессанты (сертралин, пароксетин, бупропион, венлафаксин, флуоксетин) |
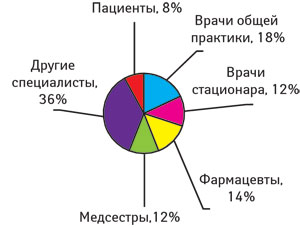
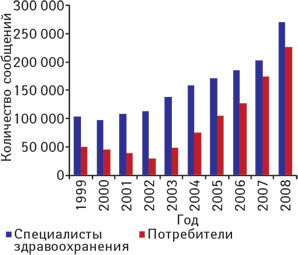
В Болгарии количество сообщений от врачей в 2007 г. в 6 раз больше, чем от фармацевтов (36 и 6 соответственно), а в Великобритании — в 2 раза (6745 и 3147 соответственно; рис. 2). Кстати, в США врачи в 2008 г. отправили сообщений о ПР примерно в 6 раз больше (154 044), чем фармацевты (27 000) (). Но (!) американские потребители еще более активно делятся информацией о ПР, чем врачи: в 2008 г. они подали 226 647 сообщений — ненамного меньше, чем все специалисты здравоохранения вместе взятые (269 765) (рис. 3). Однако реалии жизни в Украине далеки от американских, и от обращения в официальные инстанции мы традиционно не ждем ничего хорошего…
Конечно, чем проще составить и отправить сообщение, тем чаще это будут делать. Между тем в некоторых странах бывшего СССР (например Казахстане) предусмотрена подача сообщений вначале в местные органы управления здравоохранением, а потом в организацию, уполномоченную их анализировать (приказ министра здравоохранения Республики Казахстан от 14 февраля 2005 г. № 52 «Об утверждении Инструкции по проведению мониторинга побочных действий лекарственных средств»). Ясно, что пока новая информация будет переправляться конечному адресату, пройдет не один день и анализ регуляторным органом сведений о новых случаях ПР на некоторое время откладывается. В Украине предусмотрена подача карт-сообщений на бумажных или электронных носителях врачом непосредственно в ГФЦ МЗ Украины (приказ МЗ Украины от 27.12.2006 г. № 898): несерьезных — в течение 15 дней и серьезных — в течение 48 ч. Нужно отметить, что с появлением этого приказа отказались от правила передачи врачом сообщений до того, как они попадут в ГФЦ, главному врачу, что, безусловно, во благо — так и быстрее, и проще для врача.
Тем не менее будем откровенны, современную систему сбора и передачи информации о ПР ЛС в Украине следует назвать административным репортированием, ибо она регламентирована приказом МЗ Украины, но у врачей еще нет полного понимания своей роли в ней. Принципиально есть два основных случая, когда врач сообщает о ПР: когда не сообщить нельзя или когда таким образом пытаются скрыть истинные причины ухудшения состояния больного (к примеру врачебные ошибки). В последнем случае нередко идут еще дальше и обращаются в официальные инстанции с претензиями к качеству ЛС, что влечет за собой необходимость прекращения его медицинского применения на время расследования случая. А ведь наш регулятор имеет мощную экспертную составляющую, готовую оперативно реагировать в случае возникновения любых нежелательных явлений при медицинском использовании ЛС.
Быстрая подача сообщений у нас, к сожалению, лимитируется недостатками материально-технической базы системы здравоохранения, которая не позволяет массово отправлять сообщения о ПР ЛС в режиме он-лайн.
Существует еще один немаловажный фактор, влияющий на активность репортирования: к примеру, в Казахстане упомянутая Инструкция по проведению мониторинга побочных действий лекарственных средств содержит пугающее предостережение: «Лица, предоставившие заведомо ложную или недостоверную информацию о побочном действии лекарственного средства, несут ответственность, установленную Законами Республики Казахстан» (п. 2.11). Возникает вопрос: всегда ли, например, фармацевт может быть уверен в достоверности информации, имеющей отношение к ПР? Не отпугивает ли такая норма потенциальных корреспондентов?
Напротив, в странах, где фармаконадзор работает лучше всего (США, Великобритания), специально отмечают, что информация о здоровье является конфиденциальной, потому сведения о пациенте не разглашаются (не указывают ни Ф.И.О., ни номер истории болезни, ни диагноз), что соответствует принципу защиты прав пациента.
Заполнение «желтой карты» (Великобритания) займет всего 15 мин, сообщают всем потенциальным корреспондентам; и еще: «не отказывайтесь от подачи сообщения, если какие-то подробности неизвестны». Кроме того, выделены 4 главных блока (сведения о пациенте, о подозреваемом препарате, ПР и других используемых ЛС) с минимумом вопросов, на которые нужно дать короткие ответы.
Отечественная форма сообщения о ПР или отсутствии эффективности ЛС при медицинском применении имеет похожую структуру, будучи чуть подробнее. Тем не менее ее современный формат позволяет заполнить карту тоже в течение 15 мин, она соответствует рекомендованной ВОЗ. Рекомендуемый объем информации является оптимальным для проведения анализа случая ПР ЛС и последующего введения сведений в национальную базу данных. Тогда как действовавшая практически до 2007 г. (была введена согласно приказу МЗ Украины от 19.12.2000 г. № 347) лично меня как врача, в свое время потратившего немало драгоценного времени на заполнение историй болезни и выписок из них, пугала своей детальностью (тут и клинический диагноз, и анамнез, и средства коррекции ПР, и еще многое другое) ().
«Врачи всех учреждений здравоохранения… обязаны подавать в Центр (ГФЦ) информацию о любых побочных реакциях или случаях отсутствия эффективности ЛС» (приказ МЗ Украины № 898, п. 5.1). В то же время в Великобритании рекомендуют сообщать обо всех случаях серьезных ПР ЛС, помеченных «черным треугольником», то есть пребывающих под усиленным наблюдением (в том числе всех новых ЛС). Однако такое устройство системы фармаконадзора этой страны складывалось десятилетиями. За это время все привыкли, что препараты в некоторые фазы своего жизненного цикла требуют прицельного наблюдения относительно безопасности применения. Ибо невозможно сравнить предсказуемость последствий применения препаратов перекиси водорода, йода, бриллиантового зеленого с таковыми у ингибиторов АПФ, блокаторов бета-адренорецепторов, антибиотиков для системного применения. Это отнюдь не означает, что препараты, требующие особого внимания, являются некачественными или не нужными здравоохранению. Зачастую в накоплении опыта применения именно таких ЛС больше всего заинтересованы пациенты и врачи.
В Российской Федерации рекомендуют сообщать о ПР при применении новых (в течение 5 лет после регистрации) ЛС, а также обо всех серьезных и непредвиденных ПР. Кроме того, Федеральный центр мониторинга безопасности лекарственных средств Росздравнадзора (ФЦМБЛС) принимает и анализирует сообщения о ПР не только ЛС (в том числе, разумеется, вакцин), но и препаратов традиционной медицины и биологически активных добавок.
Главный вопрос: какую информацию можно извлечь из массива данных об отдельных ПР? В итоговом сообщении ГФЦ МЗ Украины за 2008 г. речь идет о преобладании ПР аллергической природы (60%) и лидировании антимикробных средств для системного применения (31%) среди препаратов, вызывавших ПР. Впрочем, такая же картина наблюдалась и в прошедшие годы, а также во многих других странах СНГ. Больше того, бета-лактамные антибиотики и пенициллины входят в тройку АТС-групп ЛС, о ПР при приеме которых в 2000–2004 гг. чаще всего сообщали в Азии и Африке (1-е и 3-е места соответственно) (исследование Уппсаловского мониторингового центра (Uppsala Monitoring Centre — UMC) «Who, where and what in spontaneous reports»; табл. 2, 3).
|
Таблица 3 |
Три класса ПР по органам и системам (System Organ Class— SOC) |
|
SOC |
Африка |
Азия |
Европа |
Северная Америка |
|
1 |
Поражения кожи и ее придатков (крапивница, зуд, эритематозная сыпь, сыпь, макуло-папулезная сыпь) |
Поражения кожи и ее придатков (сыпь, зуд, крапивница, макуло-папулезная сыпь, эритематозная сыпь) |
Общие расстройства (лихорадка, недомогание, синкопе, усталость, периферические отеки) |
Общие расстройства (лихорадка, смерть, сниженный терапевтический ответ, боль, боль в груди) |
|
2 |
Общие расстройства (лихорадка, анафилактоидная реакция, аллергическая реакция, неэффективность ЛС, отеки) |
Общие расстройства (периорбитальные отеки, лихорадка, анафилактический шок, отек рта, отек) |
Поражения кожи и ее придатков (сыпь, эритематозная сыпь, зуд, крапивница, макуло-папулезная сыпь) |
Расстройства центральной и периферической нервной системы (головная боль, головокружение, судороги, парестезии, тремор) |
|
3 |
Нарушения пищеварительного тракта (боль в животе, рвота, диарея, тошнота, сухость во рту) |
Нарушения пищеварительного тракта (тошнота, рвота, диарея, боль в животе, стоматит) |
Нарушения пищеварительного тракта (тошнота, рвота, боль в животе, диарея, диспепсия) |
Нарушения пищеварительного тракта (тошнота, боль в животе, рвота, диарея, запор) |
|
Таблица 4 |
Доля сообщений о серьезных ПР в общем количестве за последний отчетный год (2007–2008) (по официальной информации) |
|
Государство |
Количество |
Из них — о серьезных ПР (%) |
|
|
США |
441 367 |
84 |
|
|
Великобритания |
22 482 |
86 |
|
|
Финляндия |
1174 |
64 |
|
|
Украина |
6949 |
20 |
|
|
Армения |
70 |
13* |
|
|
Болгария |
157 |
15 |
|
|
Молдова |
63 |
39* |
|
|
Российская Федерация |
1074 |
16 |
|
|
*За весь период наблюдения |
? | ||
Возможно, эти данные не очень репрезентативны (70% «азиатских» сообщений UMC получает из Таиланда, а 45% «африканских» — из ЮАР), да они и не новы, но тенденция — налицо. Так, антибактериальные средства для системного применения фигурировали в 32% сообщений, полученных Научным центром экспертизы лекарств и медицинских технологий Армении за 11 лет наблюдения. При этом 40% сообщений о ПР касались аллергических реакций. В Российской Федерации антимикробные средства для системного применения также занимали лидирующие позиции в сообщениях о ПР ЛС; об аллергических реакциях известно, что серьезные ПР в основном проявлялись именно ими. В Молдове (в период с 2008 по 2009 г.) антибактериальные средства также чаще всего фигурировали в сообщениях о ПР (21,5%), и самыми частыми проявлениями ПР были аллергические (40%).
Регуляторные органы США, Великобритании, Болгарии информацию о распределении ЛС, вызывавших ПР, по АТС-группам и самих ПР по проявлениям регулярно не публикуют. И это понятно: анализ по этим параметрам позволяет главным образом оценить фармаконадзорное поведение сообщающих, то есть о каких ПР принято сообщать. Ведь привычное репортирование о несерьезных предвиденных ПР создает некий фоновый шум, из которого надо выделить сигналы и дать им надлежащую оценку. Обратите внимание, насколько больше доля сообщений о серьезных ПР в странах с высокоразвитым фармаконадзором (табл. 4).
Наконец, о доступности и качестве официальной информации о ПР. Каким образом в статье появилась информация о Болгарии и Финляндии? Среди многих сайтов регуляторных органов стран — членов ЕС, просмотренных при подготовке публикации, только у этих удалось отыскать годовой отчет с данными о фармаконадзоре (как у Болгарии) или тематическую публикацию в официальном издании (как у Финляндии). Одним из препятствий для получения информации было, конечно, незнание языка, но, уверена — не основным. Кстати, по информативности сайт Федерального государственного учреждения «Научный центр экспертизы средств медицинского применения» Росздравнадзора даст фору многим, что приятно ().
США и Великобритания выбраны как страны с наиболее развитой системой фармаконадзора, и информации по этой теме на страничках и предостаточно. В частности, на сайте FDA опубликованы те два очередных квартальных отчета по результатам работы системы сообщений о ПР (Adverse Event Reporting System — AERS), информацию о которых отечественные СМИ расценили как громкое сообщение о «черном списке ЛС FDA». В отчетах представлены перечни продуктов, с применением которых могут быть связаны проблемы безопасности. Самое интересное — отчеты не статичны, в них добавляют новую информацию, появившуюся после окончания отчетного периода.
Кроме того, на сайте FDA можно найти статистические данные по AERS с 1969 г.; некумулятивные поквартальные сведения из отчетов о ПР; список препаратов, относительно которых владельцы разрешений на маркетинг должны разработать стратегию оценки и минимизации риска (Risk Evaluation and Mitigation Strategies); перечень препаратов, по ситуациям с безопасностью которых решение FDA еще не принято, а также узнать о текущих постмаркетинговых клинических испытаниях и требованиях к такого рода исследованиям, а также многое другое.
|
В странах с интенсивно развивающимся фармаконадзором регуляторные органы публикуют периодические издания, посвященные этой проблеме |
В странах, где фармаконадзор работает интенсивно, регуляторные органы публикуют периодические издания, полностью посвященные проблемам фармаконадзора. Причем некоторые (FDA прежде всего) создают и специальные информационные ресурсы для пациентов. Помимо обилия самых разных источников информации на сайте FDA, хочется отметить еще несколько: выходящее дважды в год издание «Безопасность лекарств и фармаконадзор» (Российская Федерация), ежемесячное «Drug Safety Update» (Великобритания), выходящее раз в два месяца «TABU Drug Information Journal» (Финляндия), ежеквартальное «Farmacovigilancia INFARMED» (Португалия), «Лекарства и медицина» (Армения). В Украине уже второй год подряд выпускают один раз в квартал журнал «Рациональная фармакотерапия», преимущественно посвященный вопросам безопасности ЛС. Хорошо бы еще публиковать на сайте МЗ данные о безопасности, особенно касающиеся острых вопросов. Хотелось бы, чтобы перечень ЛС, нуждающихся в наиболее пристальном внимании относительно безопасности применения, о создании которого упоминали отечественные эксперты (см. «Еженедельник АПТЕКА» № 11 (682) от 16.03.2009 г.), был сформирован как можно быстрее. Такой подход полностью соответствует практике, принятой странами с высоким уровнем развития системы фармаконадзора.
Ну что ж, отрадно, что мы идем в фарватере передовых общемировых тенденций развития системы фармаконадзора, что коррективы этого курса происходят оперативно и точно, а у руля все эти годы стоят профессионалы, от А до Я знающие то, с чем имеют дело. Новые принципы внедрялись бы еще быстрее, если бы процесс был двусторонний и специалисты здравоохранения, потребители, производители относились к созданию информационного поля в этой области как к общему делу. Но, к сожалению, «фармаконадзорное мировоззрение» приживается у нас очень медленно и возможности системы намного опережают наши требования к ней.
Дарья Полякова
|
Армения
Согласно поручению министерства здравоохранения (уполномоченного правительственного органа) постоянный мониторинг ПР ЛС, вакцин и изделий медицинского назначения в Армении осуществляется отделом рациональной фармакотерапии, мониторинга побочных реакций лекарств и профессиональной информации Научного центра экспертизы лекарств и медицинских технологий, который был основан в 1992 г. Спонтанные сообщения о ПР ожидаются от врачей, фармацевтов, cудебных медэкспертов, стоматологов, акушеров, медицинскиx сестер, пациентов. Производители задействованы в работе по фармаконадзору Армении посредством предоставления периодических отчетов о безопасности раз в 5 лет. Однако сегодня данный порядок наxодится на этапе пересмотра с целью разработки новыx стандартов согласно последним международным требованиям. За годы деятельности центром было получено 560 сообщений о непредвиденных ПР ЛС и вакцин. Ежегодно центр получает от 50 до 70 сообщений; соотношение серьезныx и несерьезныx ПР составляет 1:8. Топ-5 групп ЛС, при применении которыx в Армении за 11 лет зафиксированы случаи ПР, таковы:
ПР наиболее часто проявляются аллергическими реакциями (40%), изменениями со стороны пищеварительного тракта (19,5%), центральной и периферической нервной системы (12,3%), лиxорадкой, гипертермическим синдромом (9%), изменениями со стороны сердечно-сосудистой системы (8%). Полноправной участницей UMС Армения стала в 2001 г. Ежеквартально информация о зарегистрированныx случаяx ПР новых ЛС (в течение 5 лет после регистрации), о непредвиденныx реакцияx на «старые» ЛС, о серьезныx ПР на любые ЛС, о результатаx взаимодействия ЛС, случаяx с летальным исxодом, негативном влиянии ЛС на плод и новорожденныx передаются центром в UMС. Анна Калантарян, Наира Романова, эксперты Национального центра по мониторингу побочных действий лекарств Армении Молдова
Количество собранных за последние 10 лет сообщений о ПР таково: 1999 г. — 1 ПР; 2000 г. — 1 ПР; 2001 г. — 2 ПР; 2002 г. — 17 ПР; 2003 г. — 46 ПР; 2004 г. — 19 ПР; 2005 г. — 47 ПР; 2006 г. — 72 ПР; 2007 г. — 90 ПР; 2008 г. — 63 ПР. При этом около 11% сообщений получено от пациентов, остальные — от врачей. По частоте встречаемости в сообщениях лидируют антибиотики (около 21,5%), вакцины (порядка 11%), анестетики (около 7,8%), анальгетики (порядка 7,3%), противотуберкулезные препараты (около 7%). Из проявлений ПР чаще всего встречались аллергические — около 40%, среди них серьезные (анафилактический шок, отек Квинке, синдром Стивенса — Джонсона, синдром Лайелла) — около 39%. Лучия Цуркан, заведующая отделом Российская Федерация
В период с 1 января по 31 декабря 2008 г. ФЦМБЛС получено 1074 сообщения о непредвиденных ПР, зарегистрированных на территории РФ, из которых 726 присланы РЦМБЛС и 348 — производителями ЛС. По сравнению с 2007 г. (n=192) количество сообщений о непредвиденных ПР, зарегистрированных на территории РФ, увеличилось в 5,6 раза. От компаний — производителей ЛС получено более 60 тыс. сообщений (CIOMS-формы) о непредвиденных ПР и 328 периодических отчетов по безопасности ЛС. Сотрудниками ФЦМБЛС на базе одной из городских больниц Москвы апробированы методы активного проспективного и ретроспективного выявления непредвиденных ПР. Метод проспективного мониторинга в стационаре обеспечил получение наиболее полных, качественных и достоверных данных о медикаментозных осложнениях, что было обусловлено доступом исследователя к медицинской документации, возможностью осмотра и опроса больных, обсуждения их состояния с лечащими врачами, назначения дополнительных исследований для верификации непредвиденных ПР. Ретроспективный анализ амбулаторных карт показал, что медицинская документация практически не содержит информации о переносимости и безопасности ЛС. Среди общего количества сообщений о непредвиденных ПР, поступивших из РЦМБЛС, 94% содержали информацию о непредвиденных ПР и 6% — о случаях терапевтической неэффективности ЛС. Сообщения о непредвиденных ПР, относящихся к категории серьезных, составили в общей структуре 16%. Серьезные непредвиденные ПР клинически проявлялись в основном ангионевротическим отеком и анафилактическим шоком. Группы ЛС, занимающие лидирующие позиции в сообщениях о непредвиденных ПР
По материалам Финляндия
В сообщениях чаще всего встречались ЛС, которые по АТС-классификации принадлежали к группе средств, влияющих на нервную систему (N), антинеопластических и иммуномодулирующих средств (L) и влияющих на сердечно-сосудистую систему (С). По MedDRA — классификационной системе ВОЗ, наиболее частые проявления ПР относились к следующим SOC: общие нарушения и осложнения в месте введения (12%), расстройства со стороны пищеварительного тракта (11%), патологические состояния кожи и подкожной клетчатки (11%), нарушения нервной системы (11%). Из отдельных ПР чаще всего встречались сыпь (88), крапивница (74), отклонения от нормы функциональных проб печени (66), аллергические и анафилактические реакции (63) и лейкоцитопения. Действующие вещества, наиболее часто (более 10 раз) фигурировавшие в сообщениях о ПР (2007 г.)
По материалам |

 Согласно ст. 17 «Закона о лекарствах» Республики Армения лечебно-профилактические учреждения, аптеки, учреждения и организации, осуществляющие потребление и применение ЛС, обязаны незамедлительно информировать уполномоченный правительственный орган обо всех случаях развития неизвестных ПР.
Согласно ст. 17 «Закона о лекарствах» Республики Армения лечебно-профилактические учреждения, аптеки, учреждения и организации, осуществляющие потребление и применение ЛС, обязаны незамедлительно информировать уполномоченный правительственный орган обо всех случаях развития неизвестных ПР. С 12.01.2006 г. в соответствии с приказом министерства здравоохранения Республики Молдова «О порядке надзора за побочными реакциями лекарственных средств и других фармацевтических препаратов в Республике Молдова» Агентство по лекарствам занимается организацией надзора за ПР ЛС.
С 12.01.2006 г. в соответствии с приказом министерства здравоохранения Республики Молдова «О порядке надзора за побочными реакциями лекарственных средств и других фармацевтических препаратов в Республике Молдова» Агентство по лекарствам занимается организацией надзора за ПР ЛС. В 2008 г. в Российской Федерации стали функционировать 33 региональных центра мониторинга безопасности лекарственных средств (РЦМБЛС).
В 2008 г. в Российской Федерации стали функционировать 33 региональных центра мониторинга безопасности лекарственных средств (РЦМБЛС). В 2007 г. Национальное агентство лекарственных средств Финляндии (Läkemedelsverket) получило 1174 сообщения о подозреваемых ПР, 753 (64%) из которых были классифицированы как серьезные (ПР вакцин в отчет не включали). В сообщениях фигурировали 348 действующих веществ. Из них 214 попали в 1–2 сообщения. Фигурировавшие в 10 и более сообщениях перечислены в таблице.
В 2007 г. Национальное агентство лекарственных средств Финляндии (Läkemedelsverket) получило 1174 сообщения о подозреваемых ПР, 753 (64%) из которых были классифицированы как серьезные (ПР вакцин в отчет не включали). В сообщениях фигурировали 348 действующих веществ. Из них 214 попали в 1–2 сообщения. Фигурировавшие в 10 и более сообщениях перечислены в таблице.
Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим