|
В интересном и содержательном докладе Алексея Викторова, профессора, руководителя отдела фармацевтического надзора ГФЦ, был представлен анализ работы в области фармаконадзора в Украине, даны рекомендации по улучшению организации этого вида деятельности.
Данные по отдельным областям свидетельствуют о том, что в 2005 г. среди фармакологических групп лекарственных средств (ЛС) чаще всего побочные реакции (ПР) возникали при применении антибактериальных препаратов системного применения, противовоспалительных и противоревматических средств, а также кровезаменителей и перфузионных растворов (табл. 1).
| Таблица 1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Фармакологические группы ЛС, лидирующие по частоте ПР в некоторых регионах Украины | ||||||||||||||||||||||||||||||||||||||||||||||||
|
|
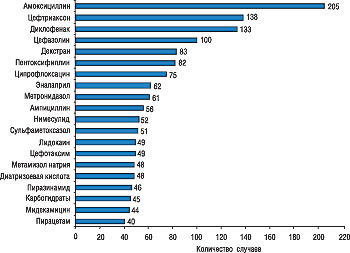
В Украине, как и во всем мире, антибактериальные средства системного применения лидируют по частоте вызываемых ПР. Если обратить внимание на перечень отдельных препаратов, в нем 1, 2 и 4-е места заняты ЛС именно этого класса — это препараты амоксициллина, цефтриаксона и цефазолина (рисунок).
Интересен анализ структуры ПР ЛС. Среди системных проявлений в прошлом году в Украине преобладали аллергические реакции (68,3% случаев) и нарушения со стороны пищеварительного тракта (11,2%). Нарушения со стороны сердечно-сосудистой, центральной и периферической нервной систем отмечали реже — в 7,4 и 6,3% случаев соответственно.
Особую настороженность вызывают ПР при медицинском применении ЛС у детей и подростков. По данным за 2005 г., у пациентов в возрасте до 17 лет зарегистрировано 1227 случаев развития ПР: у новорожденных в первые сутки жизни — 4 (0,32%), детей в возрасте 2 дней – 1 мес — 28 (2,20%), 1–3 мес — 44 (3,51%), 3–12 мес — 252 (20,53%), 1 года –17 лет — 899 случаев (73%). Большой удельный вес среди ПР при медицинском применении ЛС занимают общие аллергические реакции, особенно велик этот показатель у детей в возрасте 3–12 мес (33,6%).
Вследствие предвиденных серьезных ПР ЛС в Украине с 1997 по 2005 г. умерли 36 человек в возрасте 14–85 лет, что, по мнению докладчика, не соответствует действительности — реальное количество смертельных исходов значительно больше. В 17 случаях причиной гибели стал анафилактический шок, в 12 — нарушение кровообращения, в 2 — синдром Лайелла. Среди других осложнений, приведших к смерти, — апластическая анемия (агранулоцитоз), неуправляемая гипотензия (сердечно-сосудистый коллапс) и синдром респираторного расстройства (дистресса). 7 случаев из 36 обусловлены нарушением кровообращения вследствие применения препарата лидокаина гидрохлорида для местной анестезии в стоматологии.
Профиль безопасности препарата изучают с целью идентификации рисков при его медицинском использовании. Для этого проводят фармакоэпидемиологические или клинические исследования по собственной инициативе или по требованию органов фармаконадзора. В 2005 г. были проведены такие исследования препаратов 5 фармакологических групп, а именно — противомикробных, противогрибковых, противовоспалительных, нейролептических и рентгеноконтрастных средств. В общей сложности наблюдали 9830 пациентов. Начаты или продолжаются исследования еще 5 препаратов.
Поскольку показатели здоровья населения нашей страны отличаются от таковых жителей других государств, всячески приветствуется изучение профиля безопасности ЛС на территории Украины иностранными производителями. В 2005 г. о завершении таких исследований сообщили 8 иностранных компаний.
|
Кроме изучения ПР конкретных ЛС, немалый интерес представляют и исследования общих причин повышения частоты ПР. При этом следует учитывать, что сокращение сроков экспертной оценки и процесса регистрации новых ЛС не всегда позволяет выявить возможные ПР и их частоту до выхода препарата на рынок.
Вызывает обеспокоенность фетишизация и мифологизация фармакотерапии, недобросовестная реклама ЛС. Так, в рекламных листовках часто не приводят данных о возможных ПР, а в устных презентациях проблема ПР зачастую представлена недостаточно полно. Не все фармацевтические компании четко рекомендуют перед началом курса лечения посоветоваться с врачом или фармацевтом.
Также сегодня широко используют биологически активные добавки (БАД), хотя немного известно о том, как их употребление влияет на частоту и спектр ПР.
Как показывает опыт других стран, в определенной степени развитие ПР обусловлено медицинскими ошибками, однако до сих пор изучению этой проблемы уделяли мало внимания.
А. Викторов остановился и на структуре расходов (прямых и косвенных) в связи с ПР ЛС. Нельзя измерить боль, страдания, дискомфорт пациента, однако прямые расходы определить намного проще. К примеру, О.Н. Залиской проанализирована модель затрат на лечение больных, которые принимали нестероидные противовоспалительные препараты (НПВП) с учетом приема гастропротекторных средств. При этом изучены затраты на устранение ПР и прием дополнительных препаратов — блокаторов Н2-рецепторов и ингибиторов протонного насоса (Залиская О.Н., 2003). Подобные расходы делят между собой государство и пациент, поэтому задачи их минимизации касаются всех.
В заключение доклада А. Викторов обратил внимание на то, что приведенные данные о частоте и спектре ПР основываются на информации, полученной благодаря системе спонтанных сообщений. Необходимо, чтобы большее внимание изучению проблемы ПР ЛС уделяли фармацевтические компании.
Вопросу подготовки регулярно обновляемых отчетов по безопасности (Periodic Safety Update Reports — PSUR) как составляющей фармаконадзора производителя ЛС был посвящен доклад Елены Матвеевой, руководителя группы пострегистрационного надзора за ПР ЛС отдела фармакологического надзора.
PSUR является неотъемлемой частью фармаконадзора, осуществляемого производителем. Фармацевтические компании обязаны постоянно заниматься изучением вопроса безопасности предлагаемых ими препаратов. Результаты проведенной работы должны быть представлены в виде PSUR, сроки подачи которого четко регламентированы. Согласно приказу МЗ Украины от 26.12.2000 г. № 347 на протяжении первых двух лет после регистрации (международной «даты рождения») PSUR следует представлять каждые 6 мес, после этого на протяжении 3 лет — ежегодно, далее — 1 раз в 5 лет.
При подготовке отчета следует учитывать данные о безопасности применения препарата, не только полученные производителем самостоятельно в результате проведенных исследований, но также из регистров, литературных источников, от регуляторных органов и компаний, с которыми установлены договорные отношения.
Титульный лист и структура регуляторного отчета строго регламентированы. Так, на титульном листе должны быть представлены подробные данные о препарате, а именно международное непатентованное и торговое название препарата, его состав, дата и номер регистрационного свидетельства в Украине, владелец регистрационного свидетельства и его адрес, статус ЛС в Украине. Кроме того, следует указать процедуру лицензирования препарата в ЕС, международную «дату рождения», отчетный период, дату составления отчета, а также период, который будет охватывать следующий отчет.
В документе существует раздел «Положение относительно лицензирования препарата в странах мира», где сообщается, в каких странах получено разрешение на маркетинг ЛС.
В разделе «Обновленные данные касательно мер, принятых регуляторными органами либо собственником регистрационного удостоверения по вопросам безопасности» указывают отказы от перерегистрации, ограничения в использовании, изменения дозировки или показаний к применению и т.д.
Раздел «Влияние ЛС на пациента» содержит полную детальную информацию относительно выявленных ПР из всевозможных источников и ее всесторонний анализ. Кроме того, в соответствующем разделе предоставляется обновленный анализ проведенных исследований. В завершение излагается обобщенная оценка безопасности с описанием проблем, возникших при медицинском применении препарата.
В выводах следует указать данные по безопасности, о которых не сообщалось ранее, и ссылки на основную информацию компании по этому вопросу, сообщить и обосновать каждое рекомендованное либо уже начатое действие, сделать общий вывод относительно безопасности ЛС при медицинском применении за отчетный период.
Даже при поверхностном изучении структуры PSUR становится ясно, насколько непроста его подготовка. Необходимо не только обработать огромный объем материала, провести его детальную оценку, но и привести его в соответствие со строгими требованиями. Поэтому один из двух образовательных семинаров для производителей ЛС по вопросам фармакологического надзора, проведенных ГФЦ, был полностью посвящен особенностям и правилам создания и подачи PSUR. В его работе приняли участие 57 представителей фармацевтических компаний, из них 21 — от отечественных производителей ЛС.
| Таблица 2 | |||||||||||
| Количество PSUR, предоставленных отечественными и зарубежными производителями | |||||||||||
| |||||||||||
И это дало свой результат. С 1 января по 15 сентября 2006 г. количество полученных отчетов значительно превысило показатель за весь предыдущий год (с 1.01.2005 по 31.12.2005 г.). Так, в прошлом году PSUR предоставили 53 отечественные фармкомпании и 36 зарубежных, тогда как за истекшие месяцы этого года количество таких отчетов увеличилось до 170 и 64 соответственно (табл. 2).
С целью повышения качества подготовки и обеспечения своевременности подачи PSUR ответственность за это возложена на определенных сотрудников компаний. Соответствующие данные о назначении подали 22 иностранных и 13 отечественных компаний. Можно надеяться, что уже в ближайшем будущем количество компаний, предоставляющих PSUR, возрастет, а также увеличится количество подотчетных препаратов, отметила Е. Матвеева.
Таким образом, цель фармакологического надзора — установление профиля безопасности ЛС и заблаговременное решение проблем, возникновение которых наиболее вероятно при его медицинском использовании. Это необходимо и пациентам, и производителям, и обществу в целом. Поэтому остается надеяться, что практикующие врачи, фармацевтические компании и органы фармаконадзора объединят свои усилия для общей цели. n
Продолжение следует
Пресс-служба «Еженедельника АПТЕКА», фото Игоря Кривинского


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим