 Форум открыла Мартина Делингер-Кремер (Martine Dehlinger-Kremer), президент EUCROF, председатель педиатрической рабочей группы EUCROF, вице-президент по глобальным медицинским и нормативным вопросам SynteractHCR, член Совета Европейского форума по надлежащей клинической практике (European Forum for GCP — EFGCP), член рабочей группы Европейской сети детских исследований в Европейском агентстве по лекарственным средствам (European Network of Paediatric Research at the European Medicines Agency — Enpr-EMA).
Форум открыла Мартина Делингер-Кремер (Martine Dehlinger-Kremer), президент EUCROF, председатель педиатрической рабочей группы EUCROF, вице-президент по глобальным медицинским и нормативным вопросам SynteractHCR, член Совета Европейского форума по надлежащей клинической практике (European Forum for GCP — EFGCP), член рабочей группы Европейской сети детских исследований в Европейском агентстве по лекарственным средствам (European Network of Paediatric Research at the European Medicines Agency — Enpr-EMA).
Спикер отметила, что путешествие лекарственного средства с момента его открытия до медицинского применения осуществляется в течение длительного периода, преодолевая на этом пути немало препятствий. Поэтому только 5% всех разрабатываемых препаратов фактически достигают рынка. Самая дорогая часть этого путешествия — это этап клинических исследований препарата, результаты которых являются обязательными для дальнейшего одобрения и выведения его на рынок. Основная цель клинических исследований — получение данных о безопасности и эффективности нового препарата.
По словам М. Делингер-Кремер, глобальный рынок клинических исследований к 2021 г. составит около 20 млрд дол. США, а среднегодовые темпы прироста (CAGR) составят 7,5% в течение прогнозируемого периода с 2016 по 2021 г. Увеличение затрат на проведение клинических исследований, которое отмечается в последнее время, влияет и на конечную цену, которую пациенты платят за лекарственное средство. По оценкам Центра по изучению развития лекарств в Тафтсе (Tufts Center for the Study of Drug Development), США, в 2016 г. средняя стоимость клинического исследования на всех трех этапах составляет около 340 млн дол.
Сегодня проведение клинических исследований, по мнению М. Делингер-Кремер, сопряжено с рядом рисков. Например, значительным давлением на фармацевтические компании в аспекте быстрой разработки новых эффективных лекарств с низкой ценой; огромным количеством стандартов и требований, которым нужно соответствовать; повышением сложности проведения клинических исследований (увеличение количества конечных точек за последние 10 лет, увеличение числа адаптивных испытаний) и т.д.
Фармацевтическая и биофармацевтическая промышленность углубляется в инновации в клинических исследованиях:
- мониторинг на основе оценки рисков (Risk Based Monitoring — RBM) начинает расширяться за счет новых концепций Системы управления рисками (Quality Risk Management);
- предприятия агрегируют свои данные для создания прогностических моделей клинических исследований;
- укрепляется центричность вокруг пациента;
- внедрение технологий mHealth является многообещающим.
В меру того как рынок требует новых качественных лекарств в максимально короткие сроки, компании сталкиваются с необходимостью проводить большое количество исследований. Работа компаний (спонсоров) с CRO в качестве посредника позволяет избежать необходимости найма большого количества новых сотрудников, решить регуляторные и организационные вопросы и др.
Ключом к успешным клиническим исследованиям М. Делингер-Кремер обозначила тесное и продуктивное сотрудничество между всеми заинтересованными сторонами: спонсором, CRO, исследователем, персоналом и пациентом.
ФАРМАЦЕВТИЧЕСКАЯ ИНДУСТРИЯ: ГЛОБАЛЬНОЕ ВИДЕНИЕ
 Продолжил форум Амер Альгаббан (Amer Alghabban), генеральный директор GxP Compliance & Training Partners, Швейцария, экс-глобальный директор и руководитель отдела контроля качества и аудита в Merck Serono, глобальный руководитель отдела обеспечения качества GxP в Arpida Ag., Швейцария, и старший менеджер по аудиту в области клинического обеспечения качества в Novartis. Докладчик отметил, что глобальная Фарма за последние 20 лет столкнулась с несколькими основными трудностями:
Продолжил форум Амер Альгаббан (Amer Alghabban), генеральный директор GxP Compliance & Training Partners, Швейцария, экс-глобальный директор и руководитель отдела контроля качества и аудита в Merck Serono, глобальный руководитель отдела обеспечения качества GxP в Arpida Ag., Швейцария, и старший менеджер по аудиту в области клинического обеспечения качества в Novartis. Докладчик отметил, что глобальная Фарма за последние 20 лет столкнулась с несколькими основными трудностями:
- возрастающие ожидания клиентов — необходимость в новых методах лечения, которые клинически и экономически превосходят существующие альтернативы, а их эффективность и безопасность научно доказаны, и в то же время введение плательщиками здравоохранения новых ограничений на затраты для поставщиков услуг и более тщательное изучение ценности лекарственных средств;
- недостаточная научная производительность — продукция Фармы остается на стабильном уровне в течение последнего десятилетия, а научные открытия не позволяют покрывать растущие потребности рынка;
- «культурный склероз» — преобладающие культура управления, ментальные модели и стратегии, на которые опирается отрасль, остаются теми же, на которых она основывалась ранее, хотя темпы современного прогресса должны были внести в них изменения.
В 2011 г. мировой объем продаж лекарственных средств составил 1,08 трлн дол. и, согласно отчету , его ежегодный прирост до 2020 г. будет составлять 7,8%. Аналитики отмечают, что на данный момент наблюдается также мировой экономический рост — 7,2% в общем и 26,6% в странах БРИК (Бразилия, Россия, Индия и Китай). Коммерческая среда становится все более жесткой.
Центр по изучению развития лекарств в Тафтсе определил, что средняя стоимость разработки молекулы составляет от 1,24 до 1,32 млрд дол. Однако другие исследовательские центры считают, что этот диапазон более широкий и колеблется в пределах 75 млн — 4 млрд дол. Именно в силу дороговизны процесса разработки лекарственного средства крайне важен целесообразный и комплексный подход к определению необходимых и «правильных» лекарств, на создании которых стоит сконцентрировать внимание Фармы.
Спикер отметил, что для разработки таких препаратов необходимо следовать трехмерной формуле рисков (3-D Risk-Value formula):
- потенциальная ценность: например, насколько распространенным и серьезным является заболевание, для лечения или профилактики которого планируется разработать продукт;
- риск: например, насколько сложная болезнь, какие последствия поражения ею, новая биологическая мишень, будет ли продукт нуждаться в диагностике для получения одобрения;
- коммерческие риски: например, сколько компаний сфокусировалось на разработке лекарств для одного и того же заболевания, снизит ли это стоимость медицинского обслуживания и пр.
Также крайне важны для компании, по мнению докладчика, надлежащая проверка GxP-QA при приобретении продукции у другой компании, использование адаптивного интеллектуального мониторинга и опытный специалист по контролю качества, который сможет проконтролировать и подготовить к проверке регуляторов. «Провалил подготовку — подготовил провал», — процитировал спикер Бенджамина Франклина.
А. Альгаббан отметил, что в ближайшие 12 лет перед Фармой возникнет 2 основные задачи. Задача завтрашнего дня: разработать новые лекарственные средства для профилактики или лечения в настоящее время неизлечимых болезней. А задача сегодня — добраться до завтра!
«ПРЕОБРАЗОВАНИЕ НЕВИДИМОГО В ВИДИМОЕ»
 Об инновационных подходах и типах мышления в клинических исследованиях рассказал Марцин Стефанович (Marcin Stefanowicz), специалист по медицинским и технологическим инновациям и клиническим исследованиям, региональный менеджер по исследованиям в Центральной и Восточной Европе компании Roche. Первым мобильным устройством, которое включало как коммуникационные, так и вычислительные функции, стал Blackberry, представленный в 2002 г. Первый іPhone появился на свет в 2007 г. Немногим более десятилетия спустя смартфон стал неотъемлемой частью жизни многих людей.
Об инновационных подходах и типах мышления в клинических исследованиях рассказал Марцин Стефанович (Marcin Stefanowicz), специалист по медицинским и технологическим инновациям и клиническим исследованиям, региональный менеджер по исследованиям в Центральной и Восточной Европе компании Roche. Первым мобильным устройством, которое включало как коммуникационные, так и вычислительные функции, стал Blackberry, представленный в 2002 г. Первый іPhone появился на свет в 2007 г. Немногим более десятилетия спустя смартфон стал неотъемлемой частью жизни многих людей.
По словам спикера, благодаря мобильным приложениям для здоровья, различным дополнениям, датчикам, медицинским устройствам и продуктам удаленного мониторинга пациентов становится возможным улучшить качество услуг здравоохранения и обеспечить надлежащий контроль и уход за пациентом. Мобильные продукты должны широко использоваться, в том числе в клинических исследованиях. На сегодня количество мобильных приложений, касающихся здравоохранения, значительно увеличилось: на Google Play Store — около 160 тыс. (на 50% больше в 2017 г. по сравнению с 2016 г.), и на Apple App Store — около 150 тыс. (на 20%). По данным Research2guidance — mHealth App Developer Economics study 2017, в целом за 2016–2017 гг. создано более 78 тыс. новых приложений в сфере здравоохранения.
Если рассматривать структуру mHealth (рис. 1), то, по мнению М. Стефановича, ее можно разделить на три основных условных цели приложений: образование, управление и мониторинг. Каждая группа приложений при этом может быть полезна как для специалистов здравоохранения, так и для самих пациентов, а иногда позволяет улучшить обмен информацией, взаимодействие и понимание друг друга.
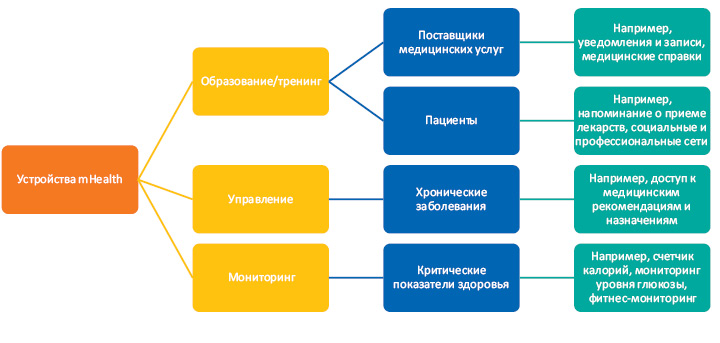
Для клинических исследований внедрение mHealth позволяет достичь улучшения по 4 направлениям:
- результаты (за счет возможности получения большого, точного и качественного массива данных);
- минимальное количество использования сервисов;
- вовлечение пациентов в процесс исследований;
- фокусирование на данных (real-world data).
М. Стефанович отметил, что методов сбора информации человеком на сегодня невероятное количество. Однако, несмотря на это, нельзя забывать о таком важном факторе, как обработка и анализ полученных данных. Может ли человек самостоятельно обработать всю полученную информацию, например, даже по одному клиническому исследованию? Вряд ли. Именно для улучшения клинического понимания, обработки данных и «преобразования невидимого в видимое» сегодня и необходимы digital-технологии в целом и mHealth в частности.
По словам спикера, необходимо внедрять новые технологии и новые подходы (таблица) в клинических исследованиях, для того чтобы они могли соответствовать актуальным требованиям всех заинтересованных сторон.
| Характеристика | Настоящее клинических исследований | Будущее клинических исследований |
| Дизайн исследования | Рандомизированное двойное слепое параллельное плацебо-контролируемое исследование | Рандомизированное двойное слепое параллельное плацебо-контролируемое исследование. Использование адаптивных дизайнов |
| Исследуемая категория пациентов | Группа лиц с одинаковым заболеванием | Индивидуумы, выбранные на основании фенотипа и генетических результатов |
| Подбор участников | На основании данных клинической практики | При помощи всемирных регистров клинических исследований и социальных сетей, созданных людьми с определенным заболеванием |
| Визиты во время клинического исследования | Лично или через аудиозвонки | Лично и через аудио- и видеозвонки |
| Критерии эффективности (результата) | • Нечувствительные • Эпизодические • Субъективные • Спонсороцентрические • В клинике • Однонаправленные |
• Чувствительные • Частые или продолжительные • Объективные • Пациентоцентрические • Удаленные • Многоплановые (комплексные) |
Что же новые технологии могут нам предоставить? Они помогут снизить затраты, «сконнектить» пациентов и поставщиков услуг здравоохранения, обеспечить участие и приверженность пациентов, вести медицинские записи с помощью мобильных устройств, улучшить качество данных в исследованиях и обеспечить доступ ко всем необходимым показателям и информации в режиме реального времени в любом месте.
М. Стефанович отметил, что использование новых технологий позволяет повысить эффективность передачи данных и информации без необходимости их транскрипции, с фиксированием временных показателей, а также мониторировать состояние пациентов удаленно. Однако их внедрение подразумевает критичность стандартизации надежности, атрибутивности, чувствительности и специфичности измерений, а также способов их получения и каналов передачи. «На протяжении многих лет Фарма узнавала о потребностях пациента через врачей. Теперь настало время спрашивать об этом напрямую у пациента. А диджитал-технологии как раз и являются инструментом, который сделает эту задачу реальной», — подытожил М. Стефанович.
ПЛАНИРОВАНИЕ МУЛЬТИНАЦИОНАЛЬНЫХ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
 Джулиан Платон (Julian Platon), специалист в сфере здравоохранения, консультант по медицинским вопросам, клиническому развитию, операциям и фармаконадзору с опытом работы в компаниях Schwarz Pharma, Hoffmann-La Roche, Abbott, PharmaPart, Solvay и Alexion, подчеркнул, что, приступая к планированию клинического исследования, необходимо в первую очередь знать критические показатели измерения: время, бюджет, качество данных и общую вероятность/предсказуемость (доказать рабочую гипотезу). При этом каждый из показателей зависит от определенных факторов. Например, время зависит от дизайна исследования, CRO (например медленно или быстро работает, есть ли весь необходимый персонал), администрирования (например серия заявок, количество стран и др.), набора участников (например количество пациентов в исследовании), количества необходимых исследований.
Джулиан Платон (Julian Platon), специалист в сфере здравоохранения, консультант по медицинским вопросам, клиническому развитию, операциям и фармаконадзору с опытом работы в компаниях Schwarz Pharma, Hoffmann-La Roche, Abbott, PharmaPart, Solvay и Alexion, подчеркнул, что, приступая к планированию клинического исследования, необходимо в первую очередь знать критические показатели измерения: время, бюджет, качество данных и общую вероятность/предсказуемость (доказать рабочую гипотезу). При этом каждый из показателей зависит от определенных факторов. Например, время зависит от дизайна исследования, CRO (например медленно или быстро работает, есть ли весь необходимый персонал), администрирования (например серия заявок, количество стран и др.), набора участников (например количество пациентов в исследовании), количества необходимых исследований.
Д. Платон отметил, что бюджет также зависит от типа дизайна, например, адаптивный дизайн означает потребность в независимом комитете по безопасности. CRO также является аспектом, влияющим на бюджет, однако следует помнить, что стоит платить не за имя CRO, а за имя проект-менеджера. Также на бюджет оказывают значительное влияние затраты на администрирование, а именно большие затраты на переводы при участии различных стран, бытовые затраты, количество необходимых для исследования стран, наряду со стоимостью работы исследователя.
Качество данных, в свою очередь, зависит от дизайна исследования в разрезе статистических данных и количества основных параметров, CRO (мониторинг посещений, ввод данных), администрирования (научное консультирование, особенно если фаза II/III), рекрутинга (количество участников исследования адекватной этнической принадлежности) и центральной лаборатории (стандартизация = качество).
Предсказуемость прогноза основывается на том, отвечает дизайн исследования на поставленный вопрос или просто «немного подходит», правильно ли составлена команда оценки рисков (специалисты медицинского, клинического, фармакологического, статистического и других профилей), а также на результатах сравнения исследования профильной литературы и мнении ключевого ведущего специалиста, количестве пациентов и т.д.
О «дилемме спонсора»
Довольно продолжительное время клиническая разработка и медицинские вопросы рассматривались исключительно как этап/остановка в жизненном цикле продуктов. То есть по факту главный исследователь просто «продавал» продукт отделу маркетинга, а за успешный выход препарата на рынок получал свой интерес. Однако такая система показала непригодность. Пример тому — выведение препарата Позикор компанией Hoffmann-La Roche, который сулил стать новым бестселлером компании, пока не был изъят с рынка за большое количество побочных реакций. По словам докладчика, главный исследователь Позикора после успешного выведения на рынок препарата получил в качестве «своего интереса» фармацевтическую компанию, которая до сегодняшнего дня активно работает и сотрудничает с Hoffmann-La Roche.
После неудачи с препаратом компания Hoffmann-La Roche изменила концепцию своей работы и ввела должность «lifecycle manager». Данный специалист «сопровождает» препарат с момента его разработки, через клинические исследования, выведение на рынок, постмаркетинговые исследования, дополнительные исследования по расширению терапевтических показаний (в случае необходимости) до окончания срока патентной защиты и разработки его генериков.
Еще одним аспектом «дилеммы спонсора» является повышенное давление спонсора (в частности отдела маркетинга) на клинические исследования. По мнению докладчика, очень важно помнить, что маркетинг не диктует исследователям или CRO, как работать. Однако у службы маркетинга есть свои ожидания по продукту, и к ним стоит прислушаться. Положительно на ситуацию в таком случае влияет наличие «буферов»: ключевых ведущих специалистов по конкретным направлениям или представителей спонсорского отдела по клиническим вопросам, которые будут регулировать взаимное сотрудничество двух сторон.
Очень важна при планировании, как отметил Д. Платон, коммуникация между исследователями и медицинским отделом компании в аспекте того, с какой целью проводятся исследования: для информационно-пропагандистской деятельности и коммуникации или для формирования преобладающих данных.
Планирование «многонациональных исследований»
«При подготовке к битве я всегда находил, что планы бесполезны, но планирование является обязательным», — процитировал спикер американского главнокомандующего и 34-го президента США Дуайта Эйзенхауэра. При планировании клинических исследований стоит помнить, что регион Центральной и Восточной Европы (ЦВЕ) представляет собой гетерогенную группу стран с различными законодательными системами, ментальностью, культурой и привычками, уровнями централизации систем здравоохранения, фокусирования на фармацевтических и медицинских устройствах, охвата CRO.
В 2008 г. рынок клинических исследований в Европе оценивался в 20,3 млрд евро, из которых 13,1 млрд евро составляла доля фармацевтических компаний, 2,2 млрд евро — академических центров, и 5,0 млрд евро — CRO. По словам Д. Платона, общая стоимость проведения клинических исследований значительно варьирует в разных странах (рис. 2). Если принять за условную единицу стоимость клинических исследований в США, то в России общие затраты на исследования будут вдвое меньше, нежели в США, и в 4 раза меньше, чем в Германии.
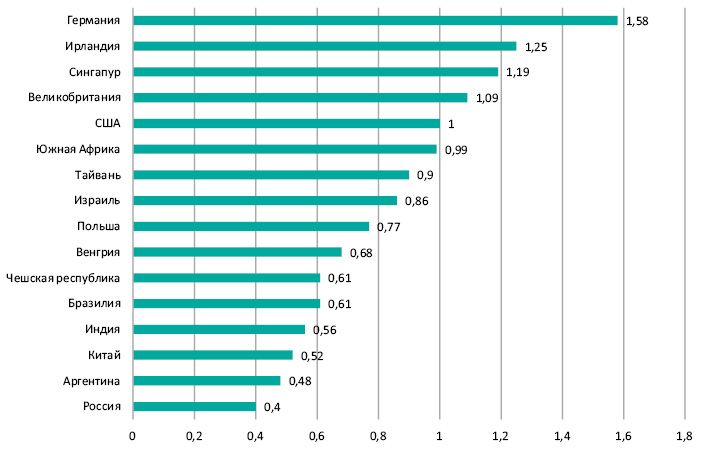
Спикер также привел данные о количестве клинических исследований на 100 тыс. населения. По данным AMAKEL Clinical Research Consulting за 2000–2007 гг., этот показатель составил для Канады 5,2, Германии — 1,49, Болгарии — 1,34, Румынии — 0,48, Украины — 0,2, России — 0,16. По словам Д. Платона, эти цифры заставляют задуматься над тем, почему в Украине сложилась такая ситуация и как ее можно исправить. Ведь потенциал страны, в частности высокая численность населения по сравнению с другими европейскими странами, значителен, и при планировании исследований это является большим преимуществом, которое следует учитывать.
По словам Д. Платона, комплаентность (приверженность) пациентов к лечению – очень важный аспект при планировании клинических исследований. По мнению эксперта, на фразу врача «Вы, пожалуйста, принимайте эту таблетку 3 раза в сутки» пациенты реагируют так:
- в Германии (думает) «давайте посмотрим, что говорят инструкция к препарату и интернет»;
- в США (думает) «посмотрим, что скажет мой адвокат»;
- в Украине «до или после еды, доктор?».
Такая ситуация добавляет еще один «плюс» в копилку Украины для выбора ее в качестве места проведения клинического исследования.
ПЛАН ВНЕДРЕНИЯ ICH E6 (R2)
 Завершающим в общей сессии стал доклад Вильяма Эндрю Лоутона (William Andrew Lawton), директора компании Risk Based Approach Ltd, Великобритания, экс-руководителя отдела клинических данных в Boehringer Ingelheim, члена учредительного комитета Ассоциации по управлению клиническими данными (Association for Clinical Data Management — ACDM), члена рабочей группы TransCelerate RBM и члена рабочей группы Европейской федерации фармацевтической промышленности и ассоциаций (European Federation of Pharmaceutical Industries and Associations — EFPIA) по прозрачности данных.
Завершающим в общей сессии стал доклад Вильяма Эндрю Лоутона (William Andrew Lawton), директора компании Risk Based Approach Ltd, Великобритания, экс-руководителя отдела клинических данных в Boehringer Ingelheim, члена учредительного комитета Ассоциации по управлению клиническими данными (Association for Clinical Data Management — ACDM), члена рабочей группы TransCelerate RBM и члена рабочей группы Европейской федерации фармацевтической промышленности и ассоциаций (European Federation of Pharmaceutical Industries and Associations — EFPIA) по прозрачности данных.
Эксперт напомнил, что Дополнение ICH E6 (R2), доработанное в ноябре 2016 г., представляет собой структурированный подход к необходимым изменениям для повышения эффективности подходов к проектированию клинических исследований, их ведению, осуществлению фармаконадзора, регистрации лекарственных средств и предоставлению отчетности. Дополнение к Руководству ICH GCP содержит единый стандарт ЕС, Японии, США, Канады для облегчения взаимного признания клинических данных уполномоченными органами в этих юрисдикциях.
EMA имплементировало Дополнение ICH E6 (R2) в июле 2017 г., Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) все еще сомневается в имплементации рекомендаций и переносит ее на IV кв. 2017 г., Управление лекарственных средств и медицинских устройств Японии (Pharmaceuticals and Medical Devices Agency — PMDA) — в I кв. 2018 г., а Канадская служба здравоохранения (Health Canada) — с 1 апреля 2018 г.
По состоянию на август 2017 г. статус готовности индустрии по ICH E6 (R2) еще требует большого количества усилий и доработки (рис. 3). Уровень 9 будет полностью соответствовать ICH E6. Максимум — лучший в отрасли (не является одной компанией), а медиана — средний показатель по отрасли. «Однако требования, описанные в Приложении, с ноября 2016 г. должны были имплементироваться участниками клинических исследований, а несоблюдение их — прямое нарушение Надлежащей клинической практики (Good Сlinical Рractice — GCP)», — подчеркнул Э. Лоутон. Согласно новым изменениям спонсор несет ответственность за любую субконтрактную организацию, привлеченную к проведению клинического исследования. Также спонсор должен имплементировать систему управления качеством и периодически пересматривать меры по контролю за рисками, чтобы удостовериться, что они остаются эффективными и актуальными. Спонсор и исследователь должны хранить записи о размещении своих основных документов. Система записи должна обеспечивать беспроблемную идентификацию документа, его поиск и извлечение.
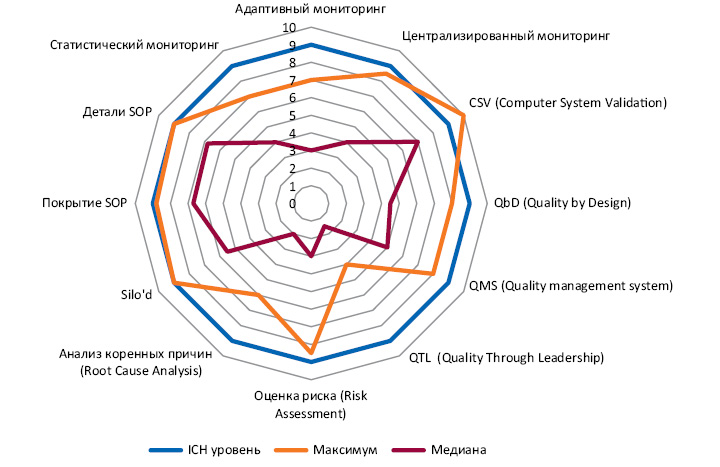
Исследователь несет ответственность за надзор за любым физическим лицом/лицами, которым он делегирует выполнение задач в клиническом исследовании. Данные, полученные в ходе исследования, должны быть соответствующими, читабельными, совпадать во времени, оригинальными, точными и полными (attributable, legible, contemporaneous, original, accurate and complete — ALCOAC). Изменения в первичных данных должны быть последовательными и не должны скрывать первоначальную запись.
 Сергей Мироненко, генеральный директор PharmaSich:
Сергей Мироненко, генеральный директор PharmaSich:
С 2013 г. в Украине наблюдается тенденция к уменьшению количества проводимых клинических исследований. Тут мы и задумались: как же повернуть эту ситуацию к лучшему? Ответ — о нас никто не знает. Именно это и сподвигло на проведение 1-го Киевского клинического форума. Стоит отметить, что это первое мероприятие в Украине, на котором рабочим языком является английский. Более того, масштаб форума и уровень спикеров позволяет сказать, что он — один из немногих в своем роде на пространстве СНГ. Подобным можно назвать форум «Clinical trials in Russia», который организовывает в Санкт-Петербурге компания Adam Smith. Однако это мероприятие не может похвастать таким количеством и качеством международных спикеров, а стоимость участия в нем в разы выше нашей. Как представитель организаторов я крайне благодарен всем спонсорам, партнерам и участникам форума за поддержку и стремление помочь украинской индустрии клинических исследований развиваться. Отдельная благодарность за прекрасные презентации и поддержку Государственному экспертному центру МЗ Украины в лице Л.И. Ковтун, С.С. Распутняка и Л.Я. Янковой. С сожалением хочу отметить, что форум нашел больше откликов у зарубежных коллег, нежели у отечественных специалистов, но уверен, что в следующем году эта ситуация изменится в лучшую сторону.
Подробнее о темах, которые освещались на форуме, читайте в следующих выпусках «Еженедельника АПТЕКА».
фото Сергея Бека




Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим