Відносно нещодавно прийняте в ЄС законодавство зобов’язало Європейське агентство з лікарських засобів (European Medicines Agency) бути абсолютно прозорим у результатах, які стосуються розгляду всіх маркетингових заявок (marketing authorization application — MAA), включаючи також і ті, які були відкликані заявником до отримання рішення регуляторного органу. Це дозволяє провести аналіз успішності спроб подачі маркетингових заявок на нові активні субстанції (new active substance — NAS), що їх було представлено до схвалення в регуляторні органи ЄС за централізованою процедурою. Проте одразу важливо відмітити, що в ЄС термін «нова активна субстанція» тлумачиться досить широко і включає також вакцини та аналогічні біопрепарати*. Тому, щоби надалі провести порівняльний аналіз успішності виведення на ринки Європи та США саме інноваційних ліків, ми мали дещо скорегувати дані, виключивши з них вакцини, аналогічні біологічні препарати та деякі інші, які станом на 2009?р. вже не були новими (якщо інше не зазначено в тексті) (табл. 1). Так само й в США регуляторними органами країни надається схвалення у разі, наприклад, нового показання до застосування препарату, який вже до того був присутній на ринку. Треба також врахувати, що схваленням нових активних субстанцій в США займається не тільки Центр з оцінки і дослідження лікарських засобів (Center for Drug Evaluation and Research — CDER)** Управління з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA), але й Центр з оцінки і досліджень біологічних препаратів (Center for Biologics Evaluation and Research — CBER) FDA, завданням якого є оцінка таких біологічних препаратів, як продукти крові (blood products), імунобіологічні препарати (immunobiological products), клітинно-терапевтичні (cell therapy products) та генно-терапевтичні (gene therapy products) продукти, біотехнологічні продукти (biotechnology products), наприклад отримані екстрагуванням з тканин людини і тварин (human or animal extracted products) ( ).
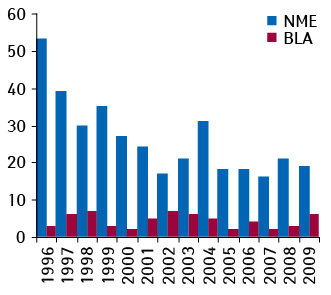
Отже, в Європі протягом 2009?р. Комітетом з лікарських засобів для застосування у людини (Committee for Medicinal Products for Human Use — СНМР) Європейського агентства з лікарських засобів були винесені рішення відносно 48?маркетингових заявок на нові активні субстанції (включаючи позитивні й негативні рішення, а також заявки, які були відкликані компанією-заявником до винесення ухвали). З них для 29 (60%) були винесені позитивні рішення, і СНМР було рекомендовано схвалення цих препаратів до маркетингу (див. табл. 1). За той самий час у США CDER всього було схвалено 19?маркетингових заявок на нові діючі речовини, препарати з якими ніколи раніше не отримували дозволу на маркетинг (new molecular entitie — NME), а також 6?заявок на маркетинг біологічних препаратів (biologic licence application — BLA). Тобто, на 1?заявку більше, ніж у попередньому 2008?р. (див. рисунок; табл. 2) ( ). У сумі загальна кількість нових активних субстанцій (що були схвалені CBER і CDER) та схвалених за новими показаннями до застосуванням ліків у 2009?р. дорівнювала 39. Аналіз схвалених заявок також показує, що і в США, і в ЄС мало місце зрушення R&D-активності у бік біологічних препаратів, вакцин та моноклональных антитіл. Так, наприклад, в ЄС протягом 2009?р. серед загальної кількості всіх схвалених заявок світ побачило 7?препаратів моноклональных антитіл, 6?пандемічних протигрипозних вакцин і 3?інші вакцини (Maggon K., 2010). Цікаво, що у 2009?р. і в США, і в Європі були схвалені 5?заявок на одні й ті самі препарати, що наштовхує на існування у фармкомпаній глобальної стратегії при подачі заявок, вважають експерти. Серед цих 5 препаратів — Samsca™ (толваптан, «Otsuka Pharmaceutical»), Onglyza™/Онгліза (саксагліптин, «Bristol-myers Squibb»/«AstraZeneca»), Simponi™ (голімумаб, «Centocor Ortho Biotech»/ «Johnson&johnson»), Ilaris™ (канакінумаб, «Novartis») і Multaq™/Мультак™ (дронедарон, «sanofi-aventis»).
| Таблиця 1 | Нові (оригінальні) активні субстанції, що їх було схвалено в ЄС у 2009 р. |
|
Торгове найменування (МНН1) |
Компанія2 |
Терапевтична група |
Дата прийняття рішення СНМР; примітки |
| Synflorix™ (пневмококова полісахаридна кон’югована вакцина) | «GlaxoSmithKline plc» | Інвазивні пневмококові захворювання | 22.01.20093 |
| Conbriza™ (базедоксифен) | «Wyeth Europa Ltd.» (входить до складу «Pfizer Inc.») | Остеопороз | 19.02.2009 |
| Exalief™/Zebinix™ (еслікарбазепіну ацетат) | «Bial Portela&Companhia S.A.»/«Eisai Co. Ltd.» | Епілепсія | 19.02.2009 |
| Removab™ (катумаксомаб) | «Fresenius Biotech GmbH» | Злоякісний асцит | 19.02.2009 |
| Cayston™ (азтреонаму лізин) | «Gilead Sciences Inc.» | Бактеріальні інфекції легень при муковісцидозі | 25.06.2009O |
| Ellaone™ (уліпристал) | «Laboratoire HRA Pharma S.A.» | Попередження вагітності | 19.03.2009 |
| Iressa™ (гефітиніб) | «AstraZeneca plc» | Рак легені | 23.04.2009 |
| Victoza™ (ліраглутид) | Novo Nordisk A/S | Цукровий діабет | 23.04.2009 |
| Mozobil™ (плериксафор) | «Genzyme Europe B.V.» (підрозділ «Genzyme Corp.») | Мобілізація гемопоетичних стовбурових клітин периферичної крові для збору та подальшої автологічної трансплантації | 29.05.2009O |
| Samsca™ (толваптан) | «Otsuka Pharmaceutical Group» | Гіпонатріємія | 29.05.2009 |
| ChondroCelect™ (аутологічні хондроцити) | «TiGenix N.V.» | Трансплантація автогенних хондроцитів при травмах колінного суглобу | 25.06.2009O |
| Cimzia™ (цертолізумаб пегол) | «UCB Pharma S.A.» | Ревматоїдний артрит | 25.06.2009 |
| Javlor™ (вінфлунін дитартрат) | «Pierre Fabre M?dicament S.A.» | Уротеліальна карцинома | 25.06.2009 |
| Onglyza™/Онгліза (саксагліптин) | «Bristol-Myers Squibb Со.»/«AstraZeneca plc.» | Цукровий діабет | 25.06.2009 |
| Simponi™ (голімумаб) | «Centocor Ortho Biotech Inc.»/«Schering-Plough Corp.» (остання на цей час належить «Merck&Co., Inc.») | Ревматоїдний артрит | 25.06.2009 |
| Arcalyst™ (рилонацепт) | «Regeneron Pharmaceuticals Inc.» | Кріопіринасоційований запальний синдром | 23.07.2009O |
| Ilaris™ (канакінумаб) | «Novartis Europharm Ltd.» (підрозділ «Novartis International AG») | Кріопіринасоційований запальний синдром | 23.07.2009O |
| Eporatio™/Ratioepo™ (епоетин тета) | ratiopharm GmbH | Лікування анемії | 23.07.2009 |
| Resolor™ (прукалоприд) | «Movetis N.V.» | Хронічні запори у жінок | 23.07.2009 |
| Multaq™ (дронедарон) | «sanofi-aventis S.A.» | Фібриляція передсердь | 24.09.2009 |
| Pevenar™ 13 (кон’югована пневмококова вакцина) | «Wyeth Pharmaceuticals Inc.» (підрозділ «Pfizer Inc.») | Профілактика інвазивних пневмококових інфекцій | 24.09.2009 |
| Onbrez™ Breezhaler™/Oslif™ Breezhaler™/Hirobriz™ Breezhaler™ (індакатерола малеат) | «Novartis Europharm Ltd.» (підрозділ «Novartis International AG») | Хронічне обструктивне захворювання легень | 24.09.2009 |
| Scintimun™ (бесилесомаб) | «CIS bio international» | Остеомієліт | 22.10.2009 |
| Firdapse™/Zenas™ (аміфампридін) | «EUSA Pharma Inc.» | Міастенічний синдром Ламберта — Ітона | 19.11.2009О |
| Elonva™ (корифлітропін-?) | «NV Organon» (дочірнє підприємство «Merck&Co., Inc.») | Стимуляція овуляції | 19.11.2009 |
| Urorec™/ Silodix™ (силодозин) | «Recordati Ireland Ltd.» | Гіперплазія простати | 19.11.2009 |
| Menveo™ (тетравалентна менінгококова вакцина (MenACWY)) | «Novartis Vaccines and Diagnostics S.r.l.» (підрозділ «Novartis International AG») | Менінгококові інфекції | 17.12.2009 |
| Prolia™ (денозумаб) | «Amgen Inc.» | Остеопороз | 17.12.2009 |
| Revolade™ (елтромбопаг оламіну) | «GlaxoSmithKline plc» | Імунопатологічна тромбоцитопенічна пурпура | 17.12.2009O |
| Таблиця 2 | Схвалені CDER у 2009 р. нові активні субстанції та нові біофармацевтичні продукти4 |
|
Торгова назва (МНН1) |
Компанія2 |
Показання до застосування |
Дата схвалення; примітки |
| Savella™ (мілнаципрану гідрохлорид) | «Cypress Bioscience Inc.» | Фіброміалгія | 14.01.2009S |
| Uloric™ (фебуксостат) | «Takeda Pharmaceutical Co. Ltd» | Гіперурікемія у хворих на подагру | 13.02.2009S |
| Afinitor™/Сертикан (еверолімус) | «Novartis Pharmaceuticals Corp.» | Нирково-клітинна карцинома | 30.03.2009p |
| Coartem™ (артеметер+люмефантрин) | «Novartis Pharmaceuticals Corp.» | Малярія | 7.04.2009p,о |
| Ulesfia™ (бензиловий спирт) | «Shionogi Pharma Inc.» (відома раніше як «Sciele Pharma Inc.») | Педикульоз | 09.04.2009S |
| Simponi™ (голімумаб) | «Centocor Ortho Biotech Inc.» (дочірня компанія «Johnson&Johnson Inc.») | Ревматоїдний артрит, псоріатичний артрит, анкілозуючий спондилоартрит | 24.04.20093S |
| Dysport™/Диспорт™ (комплекс ботулінічний токсин тип А) | «Ipsen Group» | Дистонія шийного відділу, корекція надбрівних зморшок | 29.04.2009S |
| Fanapt™ (ілоперидон) | «Vanda Pharmaceuticals Inc.» | Шизофренія | 6.05.2009S |
| Samsca™ (толвартан) | «Otsuka Pharmaceutical Group» | Гіпер- та еуволемічна гіпонатріємія, у тому числі у хворих на серцеву недостатність, цироз та SIADH5 | 19.05.2009S |
| Besivance™ (безифлоксацин) | «Bausch&Lomb Inc.» | Бактеріальний кон’юнктивіт | 28.05.2009S |
| Ilaris™ (канакінумаб) | «Novartis Pharmaceuticals Corp.» | Кріопіринасоційований запальний синдром | 17.06.2009P,О |
| Multaq™/Мультак™ (дронедарон) | «sanofi-aventis S.A.» | Миготлива аритмія (фібриляція передсердь) | 1.07.2009P |
| Effient™/Еффіент (празугрел) | «Eli Lilly&Co.» (розроблений разом із «Daiichi Sankyo») | Зниження ризику тромбозів у хворих на гострий коронарний синдром, що перенесли черезшкірні коронарні втручання | 10.07.2009P |
| Onglyza™/Онгліза (саксагліптин) | «Bristol-Myers Squibb Со.» (розроблений разом з «AstraZeneca plc») | Цукровий діабет | 31.07.2009S |
| Livalo™ (пітавастатин) | «Kowa Pharmaceuticals America Inc.» (розроблений разом із «Daiichi Sankyo Co. Ltd.» и «Nissan Chemical Industries Ltd.» | Гіперліпідемія та супутня дисліпідемія | 3.08.2009S |
| Saphris™ (азенапін) | «Organon BioSciences N.V.» (на сьогодні у складі «Merck & Co., Inc.») | Шизофренія та біполярний розлад | 13.08.2009S |
| Sabril™ (вігабатрин) | «H. Lundbeck A/S» (після поглинання «Ovation Pharmaceuticals Inc.») | Судоми немовлят віком від 1 міс до 2 років; терапія другої лінії для лікування складних парціальних (фокальних) нападів у дорослих | 21.08.2009P,О,S |
| Bepreve™ (бепотастину безилат) | «ISTA Pharmaceuticals Inc.» (розроблений спільно з «Senju Pharmaceutical Co.Ltd») | Алергічний кон’юнктивіт | 4.09.2009S |
| Vibativ™ (телаванцин) | «Theravance Inc.» (спільно з «Astellas Pharma Inc.») | Кожні інфекції, що викликані метицилінрезистентними бактеріями | 11.09.2009S |
| Folotyn™ (пралатрексат) | «Allos Therapeutics Inc.» | Рецидивуюча периферична Т-клітинна лімфома | 24.09.2009P,О |
| Stelara™/Стелара™ (устекінумаб) | «Centocor Ortho Biotech Inc.» (дочірня компанія «Johnson&Johnson Inc.») | Псоріаз середнього та тяжкого ступеня | 25.09.2009S |
| Votrient™ (пазопаніб) | «GlaxoSmithKline plc» | Прогресуючий нирково-клітинний рак | 19.10.2009S |
| Arzerra™ (офатумумаб) | «GlaxoSmithKline plc» (розроблений «Genmab A/S») | Хронічний лімфоцитарний лейкоз | 26.10.2009P,О |
| Istodax™ (ромідепсин) | «Gloucester Pharmaceuticals Inc.» (зараз належить «Celgene Corp.») | Т-клітинна лімфома шкіри | 27.11.2009S |
| Kalbitor™ (екалантид) | «Dyax Corp.» | Спадкова форма ангіоедеми | 27.11.2009P,О |
1МНН — міжнародна непатентована назва.
2Наводиться назва компанії, що представила заявку до FDA.
3Жирним шрифтом позначені біологічні препарати.
4CDER також була схвалена заявка на Extavia™ (інтерферон ??-1b, «Novartis Pharmaceuticals Corp.»), бренд-генеричну версію препарата Betaferon™/Betaseron™/Бетаферон™. Extavia™ не увійшла до цього списку, оскільки інтерферон ??-1b до 2009 р. вже був присутнім на території США.
5 Синдром неадекватної секреції антидіуретичного гормону (syndrome of inappropriate antidiuretic hormone hypersecretion — SIADH).
SСтандартні сроки розгляду заявки.
PПріоритетний статус розгляду заявки.
ООрфанний препарат.
Одним із препаратів, що були схвалені протягом 2009?р. в США, став рекомбінантний людський антитромбін-?, відомий під торговою назвою Atryn™. Його було розроблено компанією «GTC Biotherapeutics» для лікування спадкового дефіциту антитромбіну. Atryn цікавий тим, що є першим білком із властивостями антитромбіну, який був отриманий за допомогою трансгенних технологій, а саме з молока генно-модифікованих кіз (). Інший схвалений продукт — профілактична вакцина Cervarix™ британської компанії «GlaxoSmithKline», призначена для профілактики раку шийки матки і передракових станів, викликаних вірусом папіломи людини 16-го та 18-го типів у дівчат і жінок віком 10–25?років. Вона була схвалена в жовтні 2009?р. Не можна також не згадати про препарат Stelara™/Стелара™ (устекінумаб, «Centocor Ortho Biotech»/«Johnson&Johnson»), який наприкінці вересня 2009?р. був схвалений для застосування у дорослих із псоріазом середнього та тяжкого ступеня тяжкості: цей біопрепарат є першим у своєму роді аналогом інтерлейкінів людини 12?і 23, що має високу спорідненість і специфічність до їх субодиниці р40. Варто також згадати Folotyn™ (пралатрексат, «Allos Therapeutics»), що є першим схваленим препаратом для лікування рецидивної або рефрактерної периферичної Т-клітінної лімфоми. Комерційний інтерес становить також препарат Onglyza™/Онгліза (саксагліптин, «Bristol-myers Squibb»/«AstraZeneca») — селективний інгібітор дипептидилпептидази 4-го типу (DРР-4), що був схвалений FDA для лікування цукрового діабету ІІ?типу. Нарешті, не менш важливим серед препаратів, що отримали схвалення FDA торік, є Kalbitor™ (екалантид, «Dyax Corp.») — препарат для лікування спадкової форми ангіоедеми.
Серед схвалених до застосування у США лікарських засобів можна відмітити декілька історичних подій. Так, наприклад, для лікування педикульозу було схвалено добре відому до того хімічну сполуку бензиловий спирт. FDA також вперше за декілька десятиліть було схвалено препарат для лікування подагри, яким став Uloric™ (фебуксостат, «Teijin Pharma Ltd.»/«Takeda»). Тетравалентну вакцину Gardasil™ було схвалено для застосування у хлопців та чоловіків для профілактики гострокінцевих кондилом. Також варто відзначити перший косметичний лікарський засіб для лікування гіпотріхозу — біопрепарат Latisse™ (біматопрост, «Allergan») для покращання росту вій. У 2009?р. також був ще на 2?роки подовжений термін зберігання Tamiflu™/Таміфлю (осельтамівір), а через недостатність під час пандемії грипу цього препарату в формі сиропу для дітей FDA дозволило провізорам та лікарям у рамках повноважень на застосування в невідкладних ситуаціях (Emergency Use Authorization — EUA) рекомендувати застосовувати його у дітей, розчинивши вміст капсули з препаратом у будь-якому кондитерському сиропі або підсолодженій воді.
Серед лікарських засобів, схвалених в ЄС, багато мають потенціал для того, щоби протягом двох найближчих років стати блокбастерами. Серед таких кандидатів варто відмітити вже згаданий вище Onglyza™. Цей препарат представлятимуть дві компанії, які до цього не мали досвіду роботи на ринку протидіабетичних засобів і тому повинні будуть наслідувати стратегію, яку використовують, наприклад, «sanofi-aventis» і «Merck&Сo.», а також конкурувати з такими препаратами, як Januvia™/Янувія (ситагліптин, «Merck&Сo.») та Galvus™ (вілдагліптин, «Novartis»), вважають експерти (Maggon K., 2010). Бестселерами в 2009?р. вже встигли стати протигрипозні пандемічні вакцини, які закуповувалися урядами країн на період пандемії свинячого грипу. Шанси стати бестселерами є і в інгібітора mTOR Afinitor™/Сертікан (еверолімус, «Novartis»), що застосовується для лікування нирково-клітинної карциноми, аналога людського глюкагоноподібного пептиду-1 (glucagon-like peptide-1 — GLP-1) Victoza™ (ліраглутид, Novo Nordisk), призначеного для лікування цукрового діабету, селективного інгібітору тирозинкінази рецепторів епідермального фактору росту Iressa™ (гефитиніб, «Astrazenеca»), що застосовується для лікування раку легені. Ще один претендент у бестселери — це Simponi™ (голімумаб, «Johnson&Johnson»/«Schering-Plough»), використання якого було схвалено з періодичністю 1?раз на місяць з метою терапії деяких форм ревматоїдного артриту, псоріатичного артриту та хвороби Бехтерєва. Не до кінця зрозумілою є поки що доля препарату Stelara™/Стелара™ (устекінумаб, «Centocor Ortho Biotech»/«Johnson&Johnson»), який був схвалений для застосування у дорослих, хворих на псоріаз середнього і важкого ступеня тяжкості, оскільки його може спіткати доля попередників — препаратів тієї ж групи (наприклад Raptiva™ (ефалізумаб) вже добровільно було відкликано з фармринку у зв’язку з ризиком розвитку бактеріального сепсису, вірусного менінгіту, інвазивних грибкових захворювань та інших опортуністичних інфекцій, що розвивалися на фоні його застосування).
Особливістю регуляторного процесу в США у 2009?р. стало те, що схвалені CDER лікарські засоби в основному представлені спеціалізованими продуктами, які призначені для лікування дуже вузького кола захворювань, а не препаратами для терапії поширених хвороб. Наприклад, «Novartis» отримала дозвіл на маркетинг 3?препаратів: Afinitor™ (артеметер+люмефантрин) для терапії малярії та Ilaris™ (канакінумаб) для лікування кріопіринасоційованого запального синдрому. Не менш успішним виявився 2009?р. і для «GlaxoSmithKline plc»: торік були схвалені дві її вакцини. По-перше, це вакцина Cervarix™, яка призначена для профілактики раку шийки матки і передракових станів, викликаних вірусом папіломи людини 16-го і 18-го типів у дівчат та жінок віком 10–25?років, і Hiberix™ для профілактики захворювання, що викликається для лікування метастазуючого нирково-клітинного раку, CoartemHaemophilus influenzae типу В (Hib), у дітей віком 15?міс (http://www.apteka.ua). До того ж, в США були схвалені маркетингові заявки на такі її препарати, як Arzerra™ (офатумумаб; спільно з «Genmab») для лікування хронічного лімфоцитарного лейкозу, і Votrient™ (пазопаніб) для лікування хворих на прогресуючий нирково-клітинний рак.
У 2009?р. в США було схвалено 4?заявки, що надійшли від біотехнологічних компаній. Так, було схвалено Folotyn™ (пралатрексат, «Allos Therapeutics»), вже згаданий Arzerra™ (офатумумаб, «Genmab»/«GlaxoSmithKline»), Istodax™ (ромідепсин, «Gloucester Pharmaceuticals»/«Celgene») і Kalbitor™ (екалантид, «Dyax Corp.»). CBER були схвалені дві заявки на нові біологічні препарати, одна з яких стосувалася препарату Feraheme™ (ферумокситол, «AMAG Pharmaceuticals Inc.»). Як відмічають експерти, 6 схвалених заявок на маркетинг біологічних препаратів — досить низький показник для біотехнологічної галузі. У попередні роки загальна кількість схвалених біопродуктів (включаючи оригінальні та аналогічні) дорівнювала 10–15. Експерти сподіваються, що в 2010?р. кількість схвалених BLA стане більшою і це виправдає інвестиції, які здійснюють великі фармацевтичні компанії в біотехнології. Також у попередньому році 9 заявкам FDA було наданий статус пріоритетного розгляду; 6 з них було надано статус препарату-сироти.
Великою проблемою лишається недостатня кількість антибактеріальних засобів для лікування антибіотикорезистентних інфекцій: схвалених FDA у 2009?р. препаратів Besivance™ (безіфлоксацин, «Bausch&Lomb») і Vibativ™ (телаванцин, «Astellas Pharma») недостатньо, вважають експерти. Ще однією терапевтичною галуззю, в якій необхідне схвалення більшої кількості лікарських засобів, експерти називають лікування цукрового діабету. Так, наприклад, схвалення ліраглутида в США у 2009?р. було відкладене (препарат був схвалений лише в кінці січня 2010?р.) у зв’язку з повідомленнями про ризик розвитку раку щитовидної залози при його застосуванні (). Взагалі, затримки зі схваленням FDA лікарських засобів лишаються особливістю регуляторного процесу в США, навіть у разі, коли заявці надають статус пріоритетного розгляду, а також незважаючи на те, що FDA було вжито деяких заходів для подолання цієї ситуації (наприклад управління поповнило штат). Та все одно на роботі цієї регуляторної агенції відбивається недостатність фінансування і завантаженість: на кінець січня 2010?р. 69% заявок зі статусом пріоритетного розгляду і 83% стандартних заявок досягли крайнього терміну, коли вони мали б бути розглянуті.
Незважаючи на те, що кількість схвалених нових активних субстанцій в США і Європі приблизно однакова, у загальній частці лікарських засобів, схвалених в ЄС (50), більше, ніж в США (38), — в цілому Європейським агентством з лікарських засобів було схвалено 26?нових активних субстанцій і 24?нових біологічних препарати. Так, наприклад, серед нових препаратів, заявки на які були схвалені в США, але не в ЄС, — Ixempra™ (іксабепілон, «Bristol-Myers Squibb»), Revlimid™ (леналідомід, «Celgene Corp.»), Savella™ (мілнаципран, «Forest Labs»/«Pierre Fabre»/«Cypress Bioscience») та Vibativ™ (телаванцин, «Astellas Pharma»/«Theravance»); серед тих, що буди схвалені в Європі та не отримали схвалення в США, — Bridion™ (сугамадекс, «Schering-Plough»), Prolia™ (денозумаб, «Amgen»), Fablyn™ (лазофоксіфен, «Ligand Pharma»), Onbrez™ Breezhaler™ (індакатерол, «Novartis»), Xarelto™ (ривароксабан, «Bayer Schering Pharma AG», підрозділ німецького концерну «Bayer AG»), Actemra™ (тоцилізумаб, «Genentech»; останній FDA схвалило лише у січні 2010?р.) та ін. ( ). До того ж FDA значною мірою не вкладається у часові рамки, відведені на розгляд маркетингових заявок (10?міс та 6?міс — для стандартних заявок і заявок зі статусом пріоритетного розгляду відповідно). Кількість спеціальних попереджень, так званих «black box» warnings, у 2009?р. становила 31 порівняно з 56?попередженнями, винесеними в 2008?р. Причиною тому — реалізація стратегії оцінки і мінімізації ризику (Risk Evaluation and Mitigation Strategies) в США. Таким чином, європейські регуляторні органи порівняно швидше схвалюють більшу кількість препаратів, ніж FDA. Все це дозволило Європі виступити лідером, узявши на себе ініціативу по інтенсивнішому схваленню життєво важливих лікарських засобів.
_______________________
*Дане визначення включає: хімічні, біологічні та радіофармацевтичні препарати, що раніше не схвалювалися в ЄС як лікарський засіб; ізомери або їх суміші, комплекси, нові похідні або солі раніше схвалених в ЄС субстанцій у випадку, якщо їх властивості відрізняються за своєю ефективністю та безпекою від раніше схваленої субстанції; біологічні субстанції, раніше схвалені як лікарський засіб на території ЄС, але якщо вони відрізняються за своєю молекулярною структурою, природою вихідного матеріалу або способу отримання (European Commission. Notice to Applicants. Volume 2A: procedures for marketing authorisation. Chapter 1: marketing authorisation. ).
**У віданні CDER знаходиться розгляд заявок на схвалення низькомолекулярних лікарських засобів, а також невеликої кількості біологічних препаратів, представлених моноклональними антитілами для застосування in vivo; цитокінів, факторів росту, ферментів, імуномодуляторів і тромболітиків; білків, призначених для терапевтичного застосування, які отримані з мікроорганізмів або тваринного матеріалу, у тому числі рекомбінантні версії цих продуктів (за винятком факторів згортання крові); а також лікувальних імунотерапевтичних препаратів, що не належать до вакцин. Усі вищезазначені продукти ми пропонуємо для ясності та з метою уникнення подальшої плутанини називати біофармацевтичними. Усі інші, окрім перерахованих тут продуктів, належать до відання CBER.

Коментарі