 У ряді країн поняття «орфанний препарат» визначається на рівні законодавства, а лікарським засобам, які відповідають заданим критеріям, надаються певні привілеї, зокрема, довший термін патентного захисту порівняно з іншими інноваційними препаратами. Крім того, фармацевтичним компаніям можуть надаватися різні фінансові пільги для реалізації проєктів щодо лікарських засобів для лікування рідкісних захворювань. Завдяки таким стимулам обсяг ринку орфанних препаратів на глобальній арені поступово збільшується.
У ряді країн поняття «орфанний препарат» визначається на рівні законодавства, а лікарським засобам, які відповідають заданим критеріям, надаються певні привілеї, зокрема, довший термін патентного захисту порівняно з іншими інноваційними препаратами. Крім того, фармацевтичним компаніям можуть надаватися різні фінансові пільги для реалізації проєктів щодо лікарських засобів для лікування рідкісних захворювань. Завдяки таким стимулам обсяг ринку орфанних препаратів на глобальній арені поступово збільшується.ГЛОБАЛЬНИЙ РИНОК ОРФАННИХ ПРЕПАРАТІВ
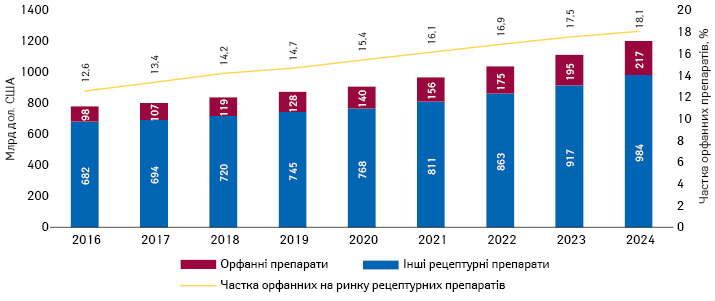
За даними дослідження «Orphan Drug Report 2020» аналітичної компанії «EvaluatePharma», за підсумками 2019 р. глобальний ринок орфанних препаратів оцінюється у 128 млрд дол. США. А у 2024 р. його обсяг може сягнути 217 млрд дол., або 18% глобального ринку рецептурних препаратів (рис. 1).
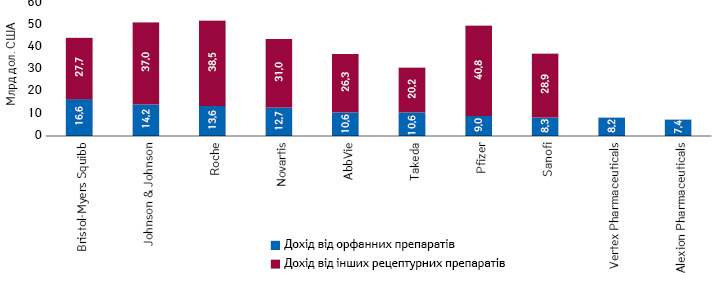
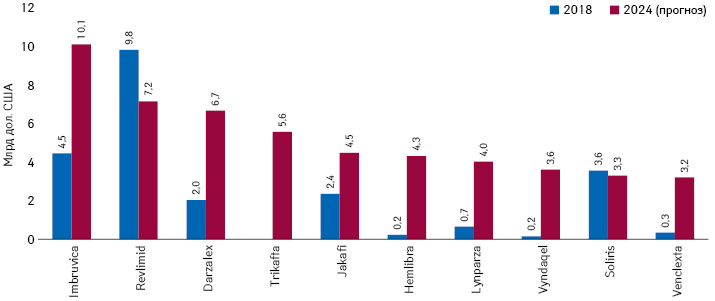
За оцінками «EvaluatePharma», топ-10 компаній за обсягом продажу орфанних препаратів у грошовому вираженні за підсумками 2024 р. сформують переважно великі фармацевтичні компанії (Big Pharma) — «Bristol-Myers Squibb», «Johnson & Johnson», «Roche», «Novartis», «AbbVie», «Takeda», «Pfizer», «Sanofi», — а також «Vertex Pharmaceuticals» і «Alexion Pharmaceuticals» (рис. 2). Успіх згаданим кампаніям забезпечать препарати Imbruvica (ібрутиніб; «AbbVie», «Johnson & Johnson»), Revlimid (леналідомід; «Bristol Myers Squibb»), Darzalex (даратумумаб; «Johnson & Johnson»), Trikafta (елексакафтор/івакафтор/тезакафтор; «Vertex Pharmaceuticals»), Jakafi (руксолітиніб; «Novartis»), Hemlibra (еміцизумаб; «Roche»), Vyndaqel (тафамідіс меглумін; «Pfizer»), Soliris (екулізумаб; «Alexion Pharmaceuticals»), Venclexta (венетоклакс; «AbbVie») (рис. 3). У топ-10 брендів орфанних препаратів за обсягом глобального продажу за підсумками 2024 р. також може увійти Lynparza (олапаріб; «AstraZeneca»). Серед перелічених препаратів переважна більшість застосовуються в терапії онкопатології, а також рідкісних генетичних захворювань, хвороб крові та захворювання центральної нервової системи.
Серед найбільш перспективних кандидатів у препарати, які наразі ще перебувають на стадії R&D, — препарати CAR-T клітинної терапії Ide-Cel та Liso-Cel, лікарський засіб для генної терапії гемофілії типу А валоктокоген роксапарвовек, а також препарат для зниження рівня антитіл IgG ефгартігімод.
За прогнозами «EvaluatePharma», обсяг продажу нових орфанних препаратів протягом 2021–2024 рр. зростатиме принаймні удвічі швидше порівняно з іншими новими (неорфанними) лікарськими засобами.
ЦІНА ПИТАННЯ
Орфанні препарати життєво необхідні певним групам населення із захворюваннями, які виявляють вкрай рідко, часто вони є генетично обумовленими та розвиваються ще в дитинстві, можуть призводити до поступової втрати дієздатності та скорочення тривалості життя. Проте вартість таких ліків часто буває досить високою. Зокрема, у 2019 р. відбувся лонч першої генної терапії для лікування дітей зі спинномозковою м’язовою атрофією Zolgensma (оптова вартість флакону оцінюється у 2,1 млн дол.; виплата розподіляється на 5 років — по 425 тис. дол. на рік).
Ще кілька десятиліть тому існувало вкрай мало варіантів лікування рідкісних хвороб. Щоб надати стимул фармкомпаніям розробляти препарати для терапії захворювань, які відмічають у невеликої популяції пацієнтів, у багатьох країнах передбачено ряд стимулів. Так, у 1983 р. законодавство у сфері регулювання орфанних препаратів запроваджено в США, у 1993 р. — в Японії, 1998 р. — в Австралії, 2000 р. — в ЄС (таблиця).
| 0знака | США | Японія | Австралія | ЄС |
| Нормативно-правова база | Orphan Drug Act (1983) | Orphan Drug Regulation (1993) | Orphan Drug Policy (1998) | Regulation (CE) N° 141/2000 (2000) |
| Адміністративний орган | Управління з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA) | Міністерство охорони здоров’я, праці та соціального захисту (Ministry of Health, Labour and Welfare — MHLW)/Organization for Pharmaceutical Safety and Research (OPSR) | Адміністрація з лікарських засобів Австралії (Therapeutic Goods Administration — TGA) | Європейське агентство з лікарських засобів (European Medicines Agency — EMA) |
| Рідкісними визначено захворювання, які відмічають у такої кількості осіб | Не більше 200 тис. осіб у популяції | Не більше 50 тис. осіб у популяції | Не більше 2 тис. осіб у популяції | Менше 1 з 2000 (5 на 10 тис.) населення |
| Надання маркетингової ексклюзивності | 7 років | 10 років | 5 років (переваги порівняно з іншими препаратами немає) | 10 років |
| Надання податкового кредиту | 25% на видатки, пов’язані з клінічними дослідженнями | 6% на видатки, пов’язані з будь-якими видами досліджень, а також обмеження податку на прибуток компанії до 10% | Немає | Визначається країнами — членами ЄС |
| Наявність грантів на дослідження | Програми Національних інститутів здоров’я (National Institutes of Health — NIH) та ін. | Державні фонди | Немає | Sixth Framework Programme (FP6) на рівні ЄС, а також заходи на національному рівні |
Зокрема, стимули, передбачені в США законом «Orphan Drug Act», включають: маркетингову ексклюзивність на 7 років (на 2 роки більше, ніж зазвичай надається новим препаратам); податковий кредит на видатки, пов’язані з клінічними дослідженнями (наразі ставка становить 25%), що сприяє зниженню вартості розробки; спрощення адміністративних процедур (скорочення періоду очікування та зменшення суми реєстраційних зборів); звільнення від стягування зборів під час подання заявок на розгляд FDA (що наразі становить майже 3 млн дол. для нового лікарського засобу); можливість отримання фінансування в рамках спеціальних програм, тощо.
Зазначені стимули сприяли збільшенню кількості орфанних препаратів на ринку, і, відповідно, обсягу витрат на такі ліки. Так, за підсумками 2019 р. FDA схвалено 48 нових препаратів, з яких 44% призначені для лікування рідкісних захворювань.
Слід зазначити, що деякі критики наявної системи надання стимулів для розробників орфанних препаратів виступають за її перегляд. Зокрема, зауважується, що спочатку податкові та ринкові стимули запроваджувалися з метою заохочення розробки препаратів для лікування рідкісних захворювань, які виявляють у відносно невеликої популяції пацієнтів і, відповідно, попит на які є обмеженим, а отже, й можливості для отримання прибутку також. Однак фактично сфера застосування орфанних ліків не обмежується лише рідкісними захворюваннями. Багато орфанних препаратів можуть мати декілька показань до застосування, у тому числі таких, що не належать до рідкісних хвороб. Наприклад, лікарський засіб може отримати допуск на ринок у статусі орфанного, а в подальшому отримати схвалення за іншими, у тому числі і «неорфанними» показаннями.
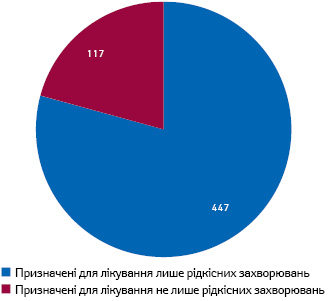
Дійсно, за даними дослідження IQVIA Institute «Orphan Drugs in the United States. Rare disease innovation and cost trends through 2019», з моменту прийняття закону «Orphan Drug Act» у 1983 р. до 2019 р. допуск на ринок у статусі орфанного отримали 564 препарати. Більшість з них мають показання для лікування винятково рідкісних станів (одного або більше), але деякі препарати мають кілька схвалених показань до застосування, у тому числі таких, що не відносяться до рідкісних хвороб (рис. 4). Так, за підсумками 2019 р. 64% обсягу продажу бевацизумабу (Avastin) в США пов’язані з терапією орфанних захворювань, а решта 36% — спрямовані на лікування захворювань, що не належать до рідкісних. А ось розподіл продажу адалімумабу (Humira) за аналогічним принципом становить 4:96 відповідно.
11% загальної суми витрат на лікарські засоби в США за підсумками 2019 р. становлять видатки на лікування орфанними препаратами рідкісних захворювань, 16% — на терапію орфанними ліками інших (неорфанних) захворювань (рис. 5).
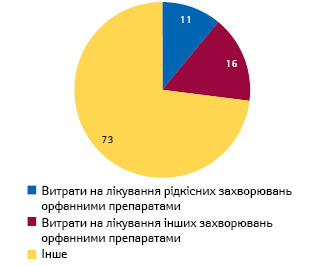
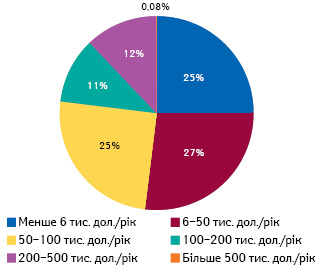
Слід зазначити, що в деяких випадках лікування орфанними препаратами може мати фантастично високу вартість (цю тенденцію посилює розвиток персоналізованої медицини). Але препаратів, вартість лікування якими становить більше 500 тис. дол. на рік, небагато. За даними IQVIA Institute, у 2019 р. лікування орфанними лікарськими засобами в США отримували 1,8 млн пацієнтів, з них тільки третина отримувала лікування препаратами з вартістю більше 100 тис. дол. на рік (рис. 6). Середньорічний обсяг витрат на лікування в розрахунку на 1 пацієнта становив 32 тис. дол.
Як свідчать прогнози, орфанні препарати займатимуть усе більш помітну частку в структурі продажу рецептурних лікарських засобів. Слід зазначити, що ринок орфанних препаратів має величезний потенціал та резерви для розвитку. Налічується близько 5–8 тис. рідкісних захворювань, та лише для невеликої їх частини наразі існує ефективне лікування.
за матеріалами evaluate.com, iqvia.com, eurordis.org,
fda.gov, ema.europa.eu, orpha.net

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим