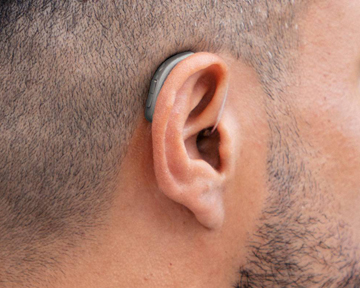
 Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 19 октября выпустило знаковое предложение, направленное на улучшение доступа к слуховым аппаратам и снижение их стоимости для миллионов американцев. FDA предложило правило об учреждении новой категории слуховых аппаратов, отпускаемых без рецепта (over-the-counter — OTC). После доработки правило позволит продавать слуховые аппараты этой категории напрямую потребителям в магазинах или через интернет без медицинского осмотра или настройки аудиологом. Предлагаемое правило разработано, чтобы помочь повысить конкуренцию на рынке, а также обеспечить безопасность и эффективность безрецептурных и рецептурных слуховых аппаратов.
Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 19 октября выпустило знаковое предложение, направленное на улучшение доступа к слуховым аппаратам и снижение их стоимости для миллионов американцев. FDA предложило правило об учреждении новой категории слуховых аппаратов, отпускаемых без рецепта (over-the-counter — OTC). После доработки правило позволит продавать слуховые аппараты этой категории напрямую потребителям в магазинах или через интернет без медицинского осмотра или настройки аудиологом. Предлагаемое правило разработано, чтобы помочь повысить конкуренцию на рынке, а также обеспечить безопасность и эффективность безрецептурных и рецептурных слуховых аппаратов.
Такие действия направлены на выполнение июльского указа президента Джо Байдена о содействии развитию конкуренции в американской экономике, который обязал FDA принять меры для обеспечения доступности ОТС слуховых аппаратов. Эти усилия также основываются на цели администрации Д. Байдена — Камалы Харрис по расширению доступа к высококачественному медицинскому обслуживанию и снижению затрат на него для населения США.
Примерно 15% взрослых американцев (37,5 млн) в возрасте 18 лет и старше сообщают о некоторых проблемах со слухом. Однако, несмотря на высокую распространенность и влияние потери слуха на общественное здоровье, слуховыми аппаратами пользуется только одна пятая людей, которым он может быть полезен.
Для обеспечения безопасности пациентов предлагаемое правило предусматривает установление максимального предела выходной мощности (громкости) для безрецептурных слуховых аппаратов, что предотвратит травмы от чрезмерного усиления звука. Кроме того, предлагаемое правило включает определенные требования к характеристикам устройства и конструкции, такие как пределы контроля искажений, пределы самогенерируемого шума, пределы задержки, диапазон и степень усиления частот, а также требование по ограничению глубины введения устройства. Предлагаемое правило также включает требования к маркировке.
Чтобы соответствовать предложенному правилу, FDA также выпустило обновленный проект руководства «Нормативные требования к слуховым аппаратам и персональным устройствам для усиления звука». Проект призван предоставить дополнительные разъяснения относительно различий между такими устройствами, которые помогают людям с нормальным слухом усиливать звуки, и слуховыми аппаратами. Американская ассоциация потери слуха (Hearing Loss Association of America), группа защиты прав потребителей, приветствовала это предложение, сообщил канал «NPR».
По материалам www.fda.gov

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим