 Почнемо з того, що рішення про віднесення лікарського засобу до лікарських засобів, рекламування яких заборонено, приймається під час державної реєстрації (перереєстрації) лікарського засобу з внесенням відповідної інформації до Державного реєстру.
Почнемо з того, що рішення про віднесення лікарського засобу до лікарських засобів, рекламування яких заборонено, приймається під час державної реєстрації (перереєстрації) лікарського засобу з внесенням відповідної інформації до Державного реєстру.
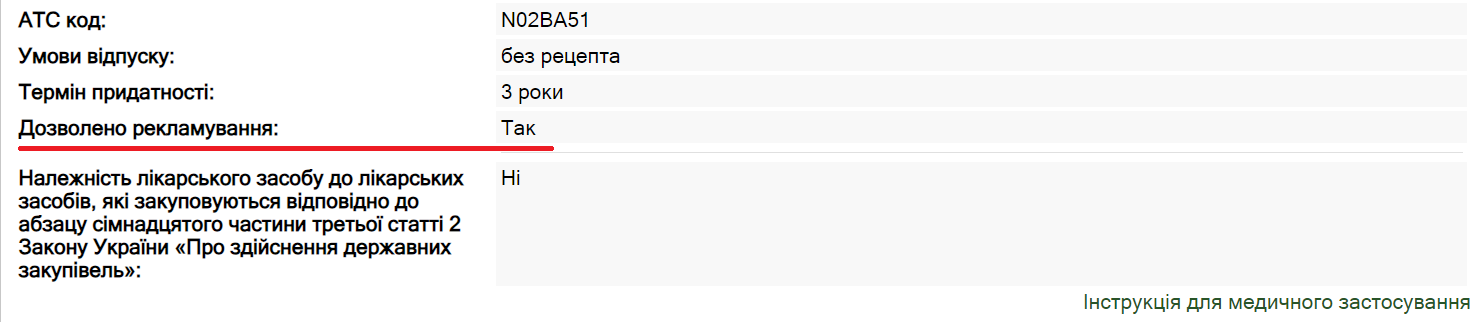
МОЗ на підставі рекомендацій ДП «Державний експертний центр Міністерства охорони здоров’я України» (далі — ДЕЦ) ухвалює рішення про віднесення лікарського засобу до таких, рекламування яких заборонено (не заборонено), а відповідні зміни вносяться до інформації про статус рекламування лікарського засобу в Державному реєстрі (рисунок).
Критерії, що застосовуються при визначенні лікарських засобів, рекламування яких заборонено
Критерії, що застосовуються при визначенні лікарських засобів, рекламування яких заборонено (далі — Критерії), затверджено наказом МОЗ від 06.06.2012 р. № 422 «Про деякі питання заборони рекламування лікарських засобів».
ДЕЦ має дотримуватися цих Критеріїв при проведенні експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію (перереєстрацію). Після ухвалення рішення про віднесення лікарського засобу до таких, рекламування яких заборонено, ДЕЦ необхідно забезпечити внесення відповідної інформації до Державного реєстру.
Отже, рішення про віднесення препарату до заборонених до рекламування ухвалюється МОЗ на підставі рекомендацій ДЕЦ за наявності хоча б однієї з таких умов:
- Відпуск лікарського засобу здійснюється тільки за рецептом лікаря.
- Лікарський засіб містить наркотичні засоби, психотропні речовини і прекурсори.
- Торговельна назва лікарського засобу та/або міжнародна непатентована назва (МНН) та форма випуску готового препарату така сама, як і лікарського засобу, рекламування якого заборонено.
- Застосування препарату може викликати синдром звикання, що зазначено в інструкції для медичного застосування, крім лікарських засобів для зовнішнього (місцевого) застосування.
- Лікарський засіб застосовується виключно для лікування жінок у період вагітності та годування грудьми.
- Лікарський засіб застосовується виключно для лікування дітей віком до 12 років.
- Лікарський засіб застосовується для лікування:
- венеричних захворювань;
- особливо небезпечних інфекційних хвороб;
- раку та інших пухлинних захворювань;
- хронічного безсоння;
- цукрового діабету;
- ожиріння (включаючи лікарські засоби, що використовуються для зменшення маси тіла);
- імпотенції (еректильної дисфункції).
- Лікарський засіб належить до групи анатомо-терапевтично-хімічної класифікації (АТХ) за кодом J05A «противірусні препарати прямої дії».
При цьому пункти 3 та 8 Критеріїв додані в лютому 2022 р.
Перелік ліків, заборонених до рекламування
Новий Перелік сформований відповідно до Критеріїв і містить 513 позицій безрецептурних препаратів, заборонених до рекламування. Коли він набуде чинності, втратить чинність попередній Перелік, затверджений наказом МОЗ України від 06.11.2012 р. № 876. Примітно, що старий Перелік містить 240 позицій заборонених до рекламування ліків, що вдвічі менше, ніж у новому.
На відміну від попереднього Переліку, новий містить колонку «Критерії, що застосовано при включенні лікарського засобу» із зазначенням відповідного пункту Критерію, на підставі якого препарат заборонено до рекламування. Натомість він не містить колонки із зазначенням номерів реєстраційних посвідчень на лікарські засоби, дати їх реєстрації і терміну закінчення реєстрації.
270 лікарських засобів, тобто більшість з нового Переліку, включені до нього на підставі такого критерію, як «Торговельна назва лікарського засобу та/або міжнародна непатентована назва (МНН) та форма випуску готового препарату така сама, як і лікарського засобу, рекламування якого заборонено».
Новий Перелік сформовано відповідно до відомостей Державного реєстру України станом на 30 травня 2023 р. І тут хочемо звернути увагу на 2 моменти.
По-перше, проведений нами попередній аналіз Переліку показав невідповідності за деякими позиціями з Державним реєстром. Так, наприклад, згідно з даними Державного реєстру, певний препарат дозволений до рекламування. Водночас цей самий препарат міститься в Переліку, відповідно, він заборонений до рекламування. У власників реєстраційних посвідчень виникає питання, чим керуватися — відомостями Державного реєстру чи Переліком?
По-друге, затверджений у липні Перелік може містити неактуальну інформацію, зважаючи, що за 1,5 міс дані в Державному реєстрі оновлювалися у зв’язку із державною реєстрацією (перереєстрацією) лікарських засобів.
Відповідно, постає питання щодо смислового навантаження та доцільності цього Переліку загалом, який, як правило, переглядається 1 раз на рік та не відповідає відомостям Державного реєстру, інформація в який вноситься на постійній основі.
До речі, тут також варто згадати і про нещодавно затверджений новий Перелік лікарських засобів, дозволених до застосування в Україні, які відпускаються без рецептів з аптек та їх структурних підрозділів. Тоді ми теж піднімали питання щодо актуальності цього переліку. Він набув чинності 19.06.2023 р. і містить ліки, які внесені до Державного реєстру станом на 10 квітня 2023 р. Відповідно, ліки, внесені до Державного реєстру після цієї дати, у цьому переліку не відображаються, а відтак його актуальність втрачається.
Враховуючи це, варто переглянути необхідність та доцільність затвердження таких переліків, оскільки вся актуальна інформація щодо категорії відпуску, статусу рекламування ліків та інші дані містяться в Державному реєстрі за посиланням .
Редакція «Щотижневика АПТЕКА», зі свого боку, звернулася за коментарями до фахівців ДП «Державний експертний центр Міністерства охорони здоров’я України».
Також готуємо і найближчим часом представимо розгорнутий аналітичний аналіз нового Переліку.
Катерина Горбунова

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим