 США является признанным флагманом мирового фармацевтического рынка, потому логично, что большинство ведущих мировых фармацевтических компаний начинают путь коммерциализации препаратов именно в этой стране. Первым шагом на этом пути для инновационных лекарственных средств является обеспечение патентной защиты тех новшеств, которые легли в их основу. Так, 2012 г. стал рекордным за последние годы по количеству одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) инновационных лекарственных средств. Интересно, что наряду с этим 2012 г. стал знаковым и в отношении количества и объема продаж, поставленных под удар вследствие давления генерической конкуренции препаратов, чей срок патентной защиты подошел к концу. Так, по данным аналитической компании «EvaluatePharma», в 2012 г. патентную защиту потеряли лекарственные средства, чей совокупный объем продаж в США по итогам 2011 г. оценивался на уровне 35,1 млрд дол. США, что тоже стало рекордом (рисунок).
США является признанным флагманом мирового фармацевтического рынка, потому логично, что большинство ведущих мировых фармацевтических компаний начинают путь коммерциализации препаратов именно в этой стране. Первым шагом на этом пути для инновационных лекарственных средств является обеспечение патентной защиты тех новшеств, которые легли в их основу. Так, 2012 г. стал рекордным за последние годы по количеству одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) инновационных лекарственных средств. Интересно, что наряду с этим 2012 г. стал знаковым и в отношении количества и объема продаж, поставленных под удар вследствие давления генерической конкуренции препаратов, чей срок патентной защиты подошел к концу. Так, по данным аналитической компании «EvaluatePharma», в 2012 г. патентную защиту потеряли лекарственные средства, чей совокупный объем продаж в США по итогам 2011 г. оценивался на уровне 35,1 млрд дол. США, что тоже стало рекордом (рисунок).
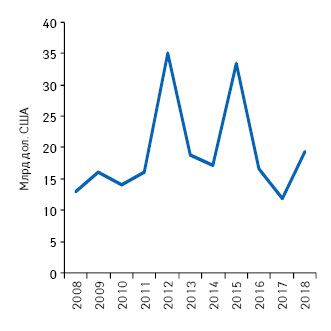
Текущий 2013 г. обещает дать некоторую передышку игрокам фармацевтического бизнеса. В этом году патентную защиту потеряют препараты, объем продаж которых в США в 2012 г. составил 18,9 млрд дол. Такая перспектива может мотивировать некоторые фармацевтические компании принимать более взвешенные инвестиционные решения и разрабатывать препараты, характеризующиеся хорошим соотношением цена/польза, что, безусловно, должно найти отклик как в сердцах пациентов, так и плательщиков. Других же подобная перспектива может заставить затаиться на время и сократить расходы. Также следует отметить, что проблема истечения срока патентной защиты может создать трудности для компании и в долгосрочной перспективе. При этом согласно мнению сотрудников «EvaluatePharma», около 70% потерь будет связано с выведением на рынок генерических препаратов.
|
Таблица |
Топ-10 препаратов по объему продаж в США по итогам 2012 г., срок патентной защиты которых истекает в 2013 г. |
| № | Препарат | Компания | Объем продаж в США по итогам 2012 г., млрд дол. | Срок действия патентной защиты |
| 1 | Cymbalta | Eli Lilly | 3,846 | 11 декабря 2013 г. |
| 2 | OxyContin | Purdue Pharma | 2,350 | 31 августа 2013 г. |
| 3 | Avonex | Biogen Idec | 1,783 | 31 декабря 2013 г. |
| 4 | Humalog | Eli Lilly | 1,449 | 7 мая 2013 г. |
| 5 | Rebif | Merck KGaA | 1,069 | 31 декабря 2013 г. |
| 6 | Neupogen | Amgen, Kirin, Roche, Royalty Pharma | 1,007 | 12 марта, 12 декабря 2013 г. |
| 7 | Lidoderm | Endo Health Solutions, EpiCept | 0,923 | 15 сентября 2013 г. |
| 8 | Niaspan | Abbott Laboratories, Teva Pharmaceutical Industries | 0,911 | 20 сентября 2013 г. |
| 9 | Procrit | Johnson&Johnson | 0,805 | 20 августа 2013 г. |
| 10 | Asacol | Warner Chilcott, UCB и Zeria Pharmaceutical | 0,701 | 30 июля 2013 г. |
Доля топ-10 препаратов из 129, срок патентной защиты которых истекает в 2013 г., составит 14,84 млрд дол. или 78,5% общего объема продаж (таблица). В данной публикации будет представлена топ-10 препаратов по объему продаж в прошедшем году в США, срок патентной защиты которых закончится в 2013 г., а также прогнозы в отношении влияния на доходы от их продаж генерической конкуренции.
Данные по объему продаж препаратов в США, представленные ниже, позволяют продемонстрировать воздействие генерической конкуренции на объем продаж, а также визуализировать отличия, связанные с характером действующего вещества лекарственного средства, — со сравнительно простой структурой молекулы или биопродуктом с высокой молекулярной массой. Примечательно, что в топ-10 препаратов по объему продаж в США срок патентной защиты, которых истекает в 2013 г., вошли 5 биопрепаратов. Ожидается, что биопрепараты в меньшей степени пострадают от давления генерической конкуренции в силу особенностей действующих веществ, входящих в их состав, и невозможности автоматической субституции.
Cymbalta (дулоксетин, «Eli Lilly»)
Компания «Eli Lilly» уже почувствовала негативное влияние генерической конкуренции на объем продаж препарата Zyprexa (оланзапин), срок патентной защиты которого истек не так давно. В ближайшем будущем компанию может ожидать сокращение доходов от продаж антидепрессанта Cymbalta, срок патентной защиты которого истекает в 2013 г. Добавьте к этому истечение срока патентной защиты препарата Humalog (инсулин лизпро), и становится понятно, почему для компании так остро стоит вопрос выведения на фармацевтический рынок новых лекарственных средств, которые имеют перспективу стать блокбастерами.
Согласно оценкам аналитической компании «Fitch Ratings» в ближайшем будущем снижение доходов компании вследствие усиления влияния генерической конкуренции может привести к сокращению расходов на R&D, которые последнее время находятся на отметке 25% дохода компании от продаж препаратов. При этом даже одобрение кандидатов в препараты, которые сейчас находятся на финальных стадиях разработки, по мнению специалистов компании, не смогут препятствовать уменьшению объема продаж компании в натуральном выражении на 8% после истечения срока патентной защиты Cymbalta. На данном этапе компания проводит клинические исследования применения препаратов у подростков. Однако, несмотря на то что пока не было получено обнадеживающих результатов, компания получила отсрочку — дополнительные полгода продления патентной защиты, которые в США и ЕС предоставляются как мера, призванная стимулировать изучение особенностей применения лекарственного средства у отдельных групп населения — детей, беременных, лиц пожилого возраста и др.
Таким образом, срок патентной защиты Cymbalta продолжен с июня 2013 г. до 11 декабря 2013 г. По прогнозам «EvaluatePharma», истечение срока патентной защиты в 2013 г. приведет к резкому сокращению доходов от продаж Cymbalta уже в 2014 г. — на 84,5% (595 млн дол.) по сравнению этим показателем по итогам 2012 г., а к 2018 г. объем продаж может снизиться до 81 млн дол. в год.
OxyContin (оксикодон, «Purdue Pharma»)
Первоначально срок истечения патентной защиты для препарата OxyContin намечался на I кв. 2013 г., однако эта дата была отодвинута на конец августа, поскольку «Purdue Pharma» провела исследования по применению препарата у детей в возрасте 6–16 лет, благодаря чему получила 6-месячную отсрочку. При этом данные исследования вызвали множество дискуссий в контексте необходимости и этичности проведения подобных изысканий с участием детей, особенно учитывая высокий риск формирования зависимости при применении OxyContin. Представители компании, в частности, отметили, что хотя они и не выступают за применение этого препарата у детей, но посчитали своим долгом предоставить данную информацию педиатрам, которым она будет полезна при лечении хронического болевого синдрома у детей. На конец августа компанией «Watson Pharmaceuticals» намечен лонч первой генерической версии данного препарата.
Согласно прогнозам истечение срока патентной защиты повлияет на объем продаж OxyContin в меньшей степени, чем, например, на Cymbalta. Так, ожидается, что в 2014 г. объем продаж сократится почти на 32% по сравнению с этим показателем по итогам 2012 г.
Avonex (интерферон БЕТА-1А, «Biogen Idec»)
Как и в случае многих других биопрепаратов, особенности патентной защиты лекарственного средства Avonex, предназначенного для лечения рассеянного склероза, сложно поддаются анализу. По оценкам специалистов компании «Evaluate Pharma», срок патентной защиты препарата Avonex может истечь уже в 2013 г. Это несколько противоречит мнению представителей маркетирующей компании «Biogen Idec», которые в 2009 г. назвали в качестве предполагаемой даты окончания срока действия патентной защиты препарата Avonex сентябрь 2026 г. Дело в том, что интеллектуальные права на технологию создания и действующее вещество Avonex защищают несколько патентов, с этим и связаны расхождения в сроках.
Однако несмотря на то, что не совсем точно известно, когда же все-таки Avonex столкнется с генерической конкуренцией, у компании «Biogen Idec» все же есть время для выведения на рынок BG-12 — кандидата в препараты, также предназначенного для лечения рассеянного склероза. Ожидается, что BG-12 может получить одобрение от регуляторных органов США уже в ближайшем будущем. Следует отметить, что хотя до недавнего времени выбор лечения для пациентов с рассеянным склерозом был достаточно ограниченным, ожидается, что ситуация скоро изменится. Так, компания «Genzyme», входящая в группу «Sanofi», недавно получила одобрение для Aubagio (терифлуномид), и другой разработанный этой компанией кандидат в препараты — Lemtrada (алемтузумаб) также может получить зеленый свет в ближайшее время.
Ожидается, что воздействие генерической конкуренции на объем продаж Avonex будет достаточно ограниченным. Так, по итогам 2014 г. объем его продаж сократится только на 10% по сравнению с 2012 г., а к 2018 г. снижение составит 31%. Такую устойчивость можно объяснить тем, что биопрепараты, к которым и относится Avonex, — интерферон бета-1а, в связи с особенностями производства, патентной защиты, процедуры одобрения и порядка назначения их биоаналогов, в меньшей степени подвержены влиянию конкуренции со стороны своих аналогов.
Humalog (инсулин лизпро, «Eli Lilly»)
Объем продаж Humalog снизился в III кв. 2012 г., не оправдав прогнозов аналитиков, которые ожидали, что его продажи будут стабильными в течение всего года. Ситуация изменилась в связи с тем, что, во-первых, плательщики стали в большей степени нацелены на получение скидок, а во-вторых, на рынок были выведены новые препараты для лечения сахарного диабета, например такие как Tradjenta (линаглиптин), которые перетянули на себя некоторую долю продаж на рынке, поскольку врачи заинтересованы в применении новых стратегий, позволяющих контролировать уровень глюкозы в крови без использования препаратов инсулина.
Учитывая, что истечение срока патентной защиты препарата Humalog уже не за горами, компании «Eli Lilly» необходимо, чтобы ее кандидаты в препараты, находящиеся на стадии клинических исследований, показали более чем обнадеживающие результаты, что дало бы возможность говорить о них как о будущих блокбастерах. И положительные результаты в сфере разработки препаратов для лечения сахарного диабета не заставили себя долго ждать: аналог глюкагоноподобного пептида-1 (Glucagon-Like Peptide-1 — GLP-1) — дулаглутид продемонстрировал положительные результаты III фазы клинических исследований.
Сегодня у «Eli Lilly» есть 4 препарата для лечения сахарного диабета, находящиеся на завершающих стадиях клинических исследований, на которые компания возлагает большие надежды. Однако стать успешными не так-то просто — регуляторные органы предъявляют высокие требования к профилю безопасности данных лекарственных средств. Однако в случае удачи они могут стать мегаблокбастерами на огромном рынке препаратов для лечения сахарного диабета, который растет не по дням, а по часам.
Сокращение объема продаж биопрепарата Humalog вследствие генерической конкуренции также невелико и составит, по прогнозам, менее 1% по итогам 2014 г. и 7% по итогам 2018 г.
Rebif (интерферон бета-1а, «Merck KGaA»)
Препарат для лечения рассеянного склероза Rebif является одним из самых продаваемых лекарственных средств. Однако даже он еще до истечения срока патентной защиты может столкнуться с серьезной конкуренцией. Так, уже были проведены клинические исследования завершающих стадий препарата Lemtrada компании «Sanofi», который продемонстрировал лучшие показатели по задержке прогрессирования заболевания по сравнению с Rebif. При этом особенности профиля безопасности Lemtrada могут создать некоторые ограничения для конкуренции последнего на рынке препаратов для лечения рассеянного склероза.
Кроме того, продажи препарата Gilenya (финголимод, «Novartis») также набирают обороты, влияя таким образом на объем продаж других препаратов, присутствующих на рынке. При этом процесс R&D-разработок компании «Merck KGaA» не внушает особых надежд. Так, завершающая фаза клинических исследований кандидата в препараты для лечения рассеянного склероза кладрибина продемонстрировала отсутствие ожидаемого эффекта при его применении. Эти неожиданные результаты даже привели к реструктуризации R&D-подразделения компании. Таким образом, приобретение «Merck KGaA» компании «Serono» пока не дало ожидаемых результатов. Однако «Merck KGaA» по-прежнему работает в данном направлении. Сегодня программа по разработке Rebif с пролонгированным высвобождением находится в фазе I клинических исследований, удачное завершение которой может способствовать увеличению срока патентной защиты препарата.
Снижение доходов от продаж препарата по итогам 2014 г. оценивается на уровне 9% по сравнению с 2012 г., а аналогичный показатель по итогам 2018 г. может составить 26%.
Neupogen (филграстим, «Amgen», «Kirin», «Roche», «Royalty Pharma»)
Neupogen применяют с целью увеличения количества нейтрофильных гранулоцитов в периферической крови и снижения частоты инфекционных осложнений при нейтропении, вызванной химиотерапией при онкологических заболеваниях. Neupogen присутствует на мировом фармацевтическом рынке с 1991 г., при этом в течение всего этого периода является одним из бизнесобразующих препаратов для компании «Amgen». Права на маркетирование данного лекарственного средства в различных регионах разделены между несколькими фармацевтическими компаниями. При этом львиную долю дохода от продаж препарата получает компания «Amgen». В августе регуляторные органы США одобрили Tevagrastim (филграстим) компании «Teva Pharmaceutical Industries» — биоаналог препарата Neupogen. Автоматическая субституция оригинальных препаратов генерическими или назначение по международному непатентованному наименованию широко распространены во многих странах, однако эти правила не касаются биоаналогов ввиду особенностей их производства и механизма действия.
Таким образом, многие биопрепараты даже после окончания срока патентной защиты продолжают удерживать свои позиции на рынке. Так, несмотря на то что компания «Teva Pharmaceutical Industries» провела клинические испытания для своего биоаналога и в ЕС он уже выведен на рынок, однако пока объем продаж биоаналога компании не превышает 5% в структуре рынка препаратов, применяющихся для снижения частоты инфекционных осложнений при нейтропении. В соответствии с условиями соглашения, подписанного «Amgen» и «Teva Pharmaceutical Industries», последняя может вывести на рынок США свой биоаналог препарата Neupogen в ноябре 2013 г., как раз в преддверии истечения срока его патентной защиты в этой стране. Еще одним потенциальным конкурентом для препарата Neupogen может стать Nivestim (филграстим) компании «Hospira», уже получивший одобрение в ЕС.
Таким образом, прогнозируется, что доходы от продаж препарата начнут снижаться еще в 2013 г. а объем продаж Neupogen в 2014 г. сократится на 13% по сравнению с 2012 г. и на 52% по итогам 2018 г.
Lidoderm (лидокаин 5% в форме пластыря, «Endo Health Solutions»/«EpiCept»)
В сентябре 2013 г. один из бизнесобразующих препаратов компании «Endo Health Solutions» — Lidoderm, предназначенный для купирования болевого синдрома, потеряет патентную защиту. Lidoderm является самым продаваемым препаратом компании. Так, по итогам II кв. 2013 г. доходы от продаж препарата Lidoderm составят 228 млн дол. или 29% общего объема продаж компании. Ранее патентную защиту уже потерял другой бизнесобразующий препарат компании — Opana ER. В этом случае компания пыталась всеми возможными способами снизить давление со стороны генериков, в том числе выражая сомнения в идентичности профиля безопасности генерических версий и оригинатора в связи с различными формами выпуска.
В мае 2012 г. «Endo Health Solutions» заключила соглашение с «Watson Pharmaceutical» о выведении генерической версии препарата в сентябре текущего года. Согласно условиям данной сделки «Watson Pharmaceutical» обязана выплачивать 25% доходов от продаж своего генерика в качестве роялти «Endo Health Solutions». Прогнозируется, что после истечения срока патентной защиты объем продаж препарата сократится по сравнению с 2012 г. на 68% в 2014 г. и на 85% в 2018 г.
Niaspan (ниацин, «Abbott Laboratories», «Teva Pharmaceutical Industries»)
Объем продаж препарата Niaspan начал уменьшаться задолго до истечения срока его патентной защиты из-за вопросов, касающихся эффективности лекарственного средства, предназначенного для контроля уровня холестерина в крови. Прогнозируемый объем продаж препарата был снижен после того, как финансируемая правительством программа по исследованию действия препарата была прекращена на 18 мес раньше, чем было запланировано.
В данном исследовании, получившем название AIM-HIGH и проведенном специалистами Национального института здоровья США (National Institute of Health — NIH), приняли участие около 3,5 тыс. пациентов с различной сердечно-сосудистой патологией, принимавших статины. У пациентов отмечали низкий уровень липопротеидов низкой плотности и высокий уровень триглицеридов. Пациенты были рандомизированы на 2 группы. Больные 1-й группы наряду со статинами принимали Niaspan, а 2-й — статины и плацебо. Всех пациентов наблюдали в течение нескольких лет. Основываясь на предварительных результатах, специалисты NIH прервали исследование на 18 мес раньше, поскольку не было отмечено какого-либо положительного воздействия Niaspan, что делало дальнейшую оценку ненужной. Полученные в ходе исследования результаты свидетельствовали о том, что применение Niaspan совместно со статинами не приводит к улучшению показателей по сравнению с приемом одних лишь статинов.
Тем не менее, в марте 2012 г. «Watson Pharmaceutical» подала заявку на одобрение генерической версии препарата Niaspan. Потеря патентной защиты особенно остро отразится на доходах от продаж Niaspan, которые сократятся по сравнению с 2012 г. на 84% уже в 2014 г. и на 94% в 2018 г.
Procrit (эпоэтин альфа, «Johnson&Johnson»)
Препарат Procrit, используемый для лечения анемии у некоторых пациентов с почечной недостаточностью, ВИЧ или раком, — успешный продукт «Johnson&Johnson», однако для этого компании пришлось преодолеть ряд трудностей. В частности, в ходе дозозависимых исследований было установлено, что прием Procrit в высокой дозе может быть ассоциирован с повышенным риском развития инсульта, тромбоза и даже смерти. В связи с этим FDA в 2007 г. установило ограничение дозировки для него и аналогичного препарата Epogen (эпоэтин альфа) компании «Amgen». Согласно данным, опубликованным Комиссией по ценным бумагам США (Securities and Exchange Commission — SEC), конкуренция со стороны препарата Aranesp (дарбепоэтин альфа) компании «Amgen», у которой «Johnson&Johnson» приобрела лицензию на маркетирование Procit, негативно повлияла на объем продаж последнего. Так, этот показатель снизился с 4 млрд дол. 10 лет назад до 2,2 млрд дол. в 2009 г., а по итогам 2012 г. оценивается на уровне 1,4 млрд дол.
На сегодня неизвестно о намерении каких-либо компаний выпустить генерическую версию препарата после истечения его срока патентной защиты, потому позиции «Johnson&Johnson» остаются достаточно крепкими. Это хорошая новость для компании, чьи последние R&D-разработки завершились, не оправдав возлагаемых на них надежд. Так, неудачно завершилась III фаза клинических исследований бапинейзумаба, препарата для лечения болезни Альцгеймера.
Ожидается, что в 2014 г. объем продаж препарата Procit сократится почти на 32% по сравнению с этим показателем по итогам 2012 г. и на 69% в 2018 г.
Asacol (мезаламин, «Warner Chilcott», «UCB» и «Zeria Pharmaceutical»)
Компания «Warner Chilcott» уже ощутила, какие последствия может иметь истечение срока патентной защиты препарата. Один из бизнесобразующих препаратов компании Actonel (ризедронат натрия) уже потерял патентную защиту в Европе, при этом его продажи снизились и в США. Теперь же один из наиболее значимых для компании продуктов Asacol, предназначенный для лечения неспецифического язвенного колита, находится на пороге истечения патентной защиты.
В начале февраля FDA одобрила препарат компании «Warner Chilcott» — Delzicol, в состав которого входит то же действующее вещество, что и в Asacol. По мнению аналитиков компании «Morgan Stanley», Delzicol был разработан с целью заменить Asacol в продуктовом портфеле «Warner Chilcott» и продлить патентную защиту препаратов для лечения неспецифического язвенного колита. Однако, как отмечают аналитики компании «Morgan Stanley», изменения, внесенные в формулу Delzicol, вряд ли позволят продлить срок патентной защиты.
Согласно прогнозам аналитической компании «EvaluatePharma» в 2014 г. продажи Asacol не сократятся, а останутся примерно на том же уровне (+1%) и только в 2018 г. сокращение составит 23% по сравнению с 2012 г.
P.S.
Итак, среди топ-10 препаратов по объему продаж в США, которые в 2013 г. утратят патентную защиту, 6 являются блокбастерами, из них 2 пересекли отметку 2 млрд дол., чем и обусловлено их высокое значение для формирования продуктовых портфелей компаний, их маркетирующих. Для сравнения в топ-10 препаратов в 2012 г. вошло 9 блокбастеров, 7 из которых преодолели 2-миллиардный рубеж. Следует напомнить, что в 2012 г. в мире было отмечено уменьшение объема продаж рецептурных препаратов, что, по оценкам «EvaluatePharma», произошло во много под давлением генерической конкуренции.
Потеря патентной защиты, безусловно, предсказуемое событие, и фармацевтические компании имеют возможность не только отсрочить его, но и подготовиться к нему. В частности, с целью продления срока патентной защиты многие фармацевтические компании проводят дополнительные исследования с участием различных групп пациентов (например детей) или же разрабатывают новые лекарственные формы маркетируемых препаратов.
Что же касается истечения срока патентной защиты, то компании стремятся разработать к этому времени препараты, которые стали бы достойной заменой былых блокбастеров. Однако поприще R&D-разработок достаточно непредсказуемо и порой компании не получают желаемых результатов.
по материалам www.fda.gov, www.uspto.gov, www.endo.com, /www.reuters.com, /www.evaluatepharma.com, www.forbes.com

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим