Натуропатичні препарати в кардіології
За ініціативою німецької компанії "Хомвіора" було організоване засідання круглого столу "Натуропатичні ліки в кардіології: реальність і перспективи", яке відбулося 20 жовтня 2003 року в Інституті кардіології ім. М.Д. Стражеска АМН України.
Актуальність використання ЛЗ рослинного походження у лікуванні захворювань серцево-судинної системи зумовлена насамперед дуже низькою ймовірністю розвитку непередбачених побічних ефектів, а також наявністю у їх складі активних компонентів з уже доведеною ефективністю, наприклад алкалоїдів та глікозидів. Було оголошено результати досліджень щодо клінічної ефективності натуропатичних препаратів виробництва компанії "Хомвіора" - ХОМВІОТЕНЗИНУ та ХОМВІОКОРИНУ, які використовують для лікування хворих з артеріальною гіпертензією (АГ) та серцевою недостатністю.
“Протек-Фарма” за здорову конкуренцію
ТОВ "Протек-Фарма було зареєстровано в Україні в серпні минулого року.
"Протек" у Росії знають як компанію, що відстоює інтереси легального бізнесу і бореться з такими негативними явищами, як поширення фальсифікованої, контрафактної продукції, функціонування тіньового ринку. На українському ринку "Протек-Фарма" дотримуватиметься тих самих принципів.
На даний час прайс-лист ТОВ "Протек-Фарма" містить понад 2500 і стрімко наближається до 3000 товарних позицій. Укладено близько 100 прямих контрактів з виробниками, з них близько 60 - з відомими зарубіжними фармацевтичними компаніями, 3 - з російськими, а інші - з українськими виробниками.
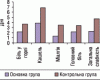
Застосування рецептур індонезійської традиційної медицини при уролітіазі та холелітіазі
У древніх трактатах східної медицини чи не основна увага приділяється лікувальній дії різних речовин рослинного і мінерального походження. У цій публікації розглядаються такі поширені захворювання, спричинені порушенням метаболізму, як уролітіаз і холелітіаз, та застосування рослинних засобів індонезійської традиційної медицини, зокрема ПРОЛІТУ.
АРБІДОЛ-ЛЕНС ефективність для профілактики і лікування грипу та інших ГРВІ у дітей
Захворювання органів дихання - найбільш поширена група дитячих хвороб. В середньому частота ГРВІ у дітeй, що часто хворіють, складає 4-9 випадків на рік. В Україні щороку реєструють 4,5-5 млн випадків ГРВІ і як наслідок - мільйони днів захворювання, пропусків шкільних занять.
АРБІДОЛ-ЛЕНС чинить пряму противірусну дію на збудників ГРВІ шляхом пригнічення проникнення вірусів у клітини та ранньої стадії реплікації, а також опосередковану - через індукцію синтезу ендогенного інтерферону, імуномодулювального ефекту та антиоксидантної активності.
АВЕЛОКС для інфузій: нові можливості протимікробної терапії
Моксифлоксацин - антибактеріальний препарат фторхінолонового ряду широкого спектра дії, розроблений всесвітньо відомою фармацевтичною компанією "Байєр АГ", що випускається під торговою назвою АВЕЛОКС. У 2001 р. препарат було зареєстровано в Україні у формі таблеток, а кілька місяців тому - у формі розчину для внутрішньовенних інфузій. Поява на фармацевтичному ринку України цієї лікарської форми препарату відкриває нові можливості у лікуванні хворих з інфекційною патологією тяжкого перебігу, і саме цій проблемі було присвячено конференцію "Сучасні підходи до антимікробної терапії: значення інфузійного моксифлоксацину", що відбулася 17 жовтня 2003 р. в Палаці мистецтв "Український Дім" у Києві. Організатором конференції виступило представництво компанії "Фармонікс" в Україні, яка вже понад 3 роки представляє інтереси компанії "Байєр АГ" і деяких інших західних фармацевтичних виробників у країнах СНД.
СИНУПРЕТ компанії “Біонорика АГ”Клінічне дослідження star у центрі уваги 2-го міжнародного симпозіуму з проблем синуситу
12 вересня 2003 р. у м. Ноймаркт, що поблизу Нюрнберга (земля Баварія, Німеччина) під егідою німецької фітонірингової компанії "Біонорика АГ" відбувся 2-й Міжнародний симпозіум з проблем синуситу. У рамках наукових доповідей та дискусій європейські вчені та клініцисти - отоларингологи, експерти в галузях клінічної фармакології та натуропатії обмінювались думками та накопиченим досвідом, аналізували результати останніх досліджень, визначали актуальність проблеми синуситу, або запалення приносових пазух (ПНП), для системи охорони здоров'я, обговорювали сучасні уявлення щодо етіології, патогенезу та клінічного перебігу цієї, на перший погляд, "тривіальної", але поширеної і небезпечної хвороби.
Головна увага учасників симпозіуму була прикута до питань, пов'язаних із втіленням у клінічну практику ефективних та безпечних з точки зору доказової медицини методів лікування та профілактики ускладнень синуситу, зокрема - фармакотерапії цього захворювання за допомогою комбінованого препарату рослинного походження виробництва компанії "Біонорика АГ" СИНУПРЕТ.
Міністерство охорони здоров’я УкраїниНаказ від 15.10.2003 р. № 486
Про внесення змін до наказу МОЗ України від 26.09.2000 р. № 229
“Фармацевтична компанія “Здоров’я”: більше актуальних препаратів
"Фармацевтична компанія "Здоров'я" належить до найбільших вітчизняних виробників лікарських засобів і є провідним фармацевтичним підприємством східного регіону України. За результатами рейтингу "Панацея-2003", що проводили Міністерство охорони здоров'я України і Фармацевтична асоціація України, підприємству було присуджено приз за впровадження у виробництво нових препаратів. Нещодавно кореспондент "Щотижневика АПТЕКА" побував у Харкові і зустрівся з генеральним директором компанії Олександром Доровським.
ІНТЕРХІМ – прорив на вітчизняному ринку лікарських препаратів
ВАТ "ІнтерХім" засновано в 1992 році в складі науково-технічного комплексу "Фізико-хімічний інститут ім. А.В. Богатського" НАН України. Компанія виробляє 6 фармацевтичних субстанцій: феназепам, гідазепам, тилорон (Аміксин), мебікар (Транквілар), клонідин (Клофелін) і неостигмін бромід (Прозерин), споживачами яких є найбільші фармацевтичні підприємства України, Росії і Латвії.
Донедавна компанія займалася розробленням технології виготовлення тільки активних речовин, впровадженням їх у виробництво, продажем субстанцій іншим виробникам, а потім реалізацією "чужої" продукції. Власного виробництва готових лікарських засобів компанія не мала. З введенням у дію виробничої ділянки з виготовлення лікарських препаратів у формі таблеток цей недолік буде ліквідовано.
Словакофарма від А до Я або компетентний погляд з позицій 11-річного досвіду роботи на українському фармринку
Кореспондент "Щотижневика АПТЕКА" взяв інтерв'ю у голови представництва компанії "Словакофарма" в Україні Сергія Полянського з метою отримати відповідь на запитання: "Як працювати з генеричними препаратами на такому великому за територією, але відносно невеликому за обсягами продажу та рівнем цін фармацевтичному ринку, як український?"
Новини фармації
Найактуальніші та найгарячіші матеріали, що охоплюють усі аспекти сучасної фармації в Україні та світі. Вчасно про найважливіші події, що відбуваються у вітчизняній та зарубіжній фармації з коментарями провідних експертів та лідерів думок. Огляди препаратів та фармацевтичних компаній, аналітичні публікації, що відстежують динаміку фармринку з максимальною оперативністю; R&D, питання маркетингу та менеджменту у фармації; найбільш актуальні нормативно-правові документи, що регулюють роботу фармацевтичної галузі.
Таким чином, кожен день на нашому сайті ви можете дізнатися про найактуальніші фармацевтичні новини в режимі онлайн.
Новини медицини
Медицина та фармація є невід’ємними складовими частинами системи охорони здоров’я, а лікарі та фармацевти роблять одну спільну справу. Саме тому на нашому сайті поряд із фармацевтичними новинами ви можете дізнатися про новини у сфері медицини.