 Эукариотические клетки отличаются от прокариотических тем, что обладают более сложной внутриклеточной организацией. У эукариотов специфические клеточные функции реализуются в специальных отсеках, так называемых органеллах. Таковыми являются ядро, где хранится генетическая информация, митохондрии — энергетические станции клеток — и другие. Они отграничены от цитоплазмы мембраной, и их внутренняя среда может сильно отличаться от клеточной. Такое функциональное разделение позволило повысить эффективность многих клеточных функций, что сыграло одну из главных ролей в эволюции жизни. Если бы не это, мы бы с вами, возможно, все еще были простыми одноклеточными организмами.
Эукариотические клетки отличаются от прокариотических тем, что обладают более сложной внутриклеточной организацией. У эукариотов специфические клеточные функции реализуются в специальных отсеках, так называемых органеллах. Таковыми являются ядро, где хранится генетическая информация, митохондрии — энергетические станции клеток — и другие. Они отграничены от цитоплазмы мембраной, и их внутренняя среда может сильно отличаться от клеточной. Такое функциональное разделение позволило повысить эффективность многих клеточных функций, что сыграло одну из главных ролей в эволюции жизни. Если бы не это, мы бы с вами, возможно, все еще были простыми одноклеточными организмами.
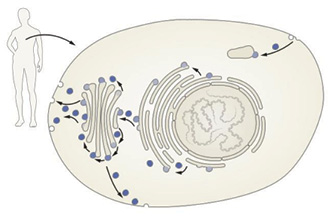
Для того чтобы клетка нормально функционировала, необходим постоянный обмен молекулами между различными органеллами (рис. 1). То есть, должен существовать механизм, который будет специфично направлять молекулы туда, где они должны работать. Ведь место их биосинтеза (сборки) также четко регламентировано.
Таким образом, без надлежащей транспортной системы царил бы настоящий хаос, и ее работа была существенно усложнена. Мировому научному сообществу долго не давал покоя вопрос, как при огромном количестве синтезируемых ежесекундно в клетке молекул они все правильно распределяются «по полочкам», и клетка может функционировать.
Немного истории…
Стоит отметить, что структура органелл изучена уже давно, за что в 1974 г. была присуждена Нобелевская премия по физиологии и медицине Альберту Клауду (Albert Claude), Джорджу Паладе (George Palade) и Кристиану де Дюву (Christian de Duve). Еще тогда было установлено, что секреторные белки (экспортирующиеся из клетки) синтезируются на рибосомах, расположенных на эндоплазматическом ретикуллуме (ЭПР), затем направляются в аппарат Гольджи (названный так по имени Нобелевского лауреата по физиологии и медицине 1906 г. Камилио Гольджи, Camillo Golgi).
Следующим этапом стало понимание того, как белки находят свой путь. Так, в 1999 г. Нобелевская премия по физиологии и медицине была присуждена Гюнтеру Блобелю (Günter Blobe) за открытие того, что у белков есть встроенные последовательности (прописанные еще в ДНК последовательности аминокислот), которые определяют локализацию белков и опосредуют их транспорт в указанное место (будь-то ЭПР или секреция).
Но даже тогда не все выяснилось: как молекулы, включая гормоны, транспортные белки, нейротрансмиттеры, попадают туда, куда нужно? На основании работ Д. Паладе было высказано предположение, что транспорт секреторных белков из ЭПР осуществляется при участии небольших одномембранных везикул, которые отпочковываются от мембран одной органеллы или компартмента и сливаются с другими. А за изучение того, что обусловливает специфичность этих процессов, и была присуждена Нобелевская премия по физиологии и медицине в 2013 г.
Исследование, идентификация и осознание — биохимический путь к просветлению
Рэнди Шекман избрал для научной работы пекарские дрожжи (Saccharomyces cerevisiae). Его выбор был обусловлен тем, что они секретируют гликопротеины (белки с присоединенными в ЭПР углеводами), что крайне удобно для исследования транспорта и слияния везикул. Он провел генетический анализ для выявления генов, регулирующих внутриклеточный транспорт, а затем, прибегнув к методу, основанному на специфических мутациях, исследовал влияние этих генов на транспорт белков. При мутациях нарушался транспорт белков, и они накапливались в цитоплазме.
В начале исследования ученым выявлены 2 гена (Sec1 и Sec2), а к его концу — 23 гена, продукты экспрессии которых — специфические белки — были разделены на 3 группы в зависимости от того, в мембране какой органеллы они встроены: ЭПР, аппарата Гольджи или плазматической (клеточной). Также он выделил везикулы, осуществляющие перенос белков между ЭПР и аппаратом Гольджи.
Таким образом, Р. Шекман открыл генетическую основу процессов везикулярного транспорта, идентифицировав ключевые регуляторные гены. Он систематизировал этапы такого запутанного процесса, как везикулярный транспорт и взаимодействие везикул со специфическими мембранами.
Джеймс Ротман создал особый метод воспроизведения in vitro, который позволил выделить и разделить этапы внутриклеточной транспортировки. Используя этот подход, он выделил в чистом виде белки, принимающие участие в процессе слияния везикул.
Поскольку исследование проводилось в 1970-е годы прошлого столетия, экспрессировать гены в животных клетках было достаточно сложно, Д. Ротман использовал для этой цели вирус везикулярного стоматита. В инфицированной клетке в большом количестве продуцируется специфический вирусный белок — VSV-G. Уникальная особенность этой системы заключается в том, что белок VSV-G, попадая в аппарат Гольджи, претерпевает модификацию специфическими углеводами — гликозилирование. То есть, на него вешается опознавательный значок, на основании которого ученые могут идентифицировать, когда он достигает своего места назначения.
Используя этот метод, Д. Ротман исследовал отпочковывание и слияние везикул, а также выделил из цитоплазмы белки, необходимые для транспорта. Первым выделен белок — N-этилмалеимидчувствительный фактор (N-ethylmaleimide-sensitive factor — NSF).
Открытие этого белка стало первым шагом в последовательной идентификации других белков, играющих важную роль в регулировании везикулярного слияния. Следующим выявлен растворимый NSF-связывающий белок (soluble NSF — attachment protein — SNAP). Белки этой группы связываются с мембраной и помогают присоединять к ней NSF.
На этом этапе работы судьбы двух ученых пересеклись: установлено, что Sec18 (дрожжевой белок) является аналогом NSF. Это, в свою очередь, подтвердило древнюю эволюционную природу данного вида транспорта. В дальнейшем Д. Ротман и Р. Шекман стали сотрудничать, клонировали Sec17 и доказали, что он является аналогом белка SNAP.
Впоследствии Д. Ротман избрал объектом исследования нервную ткань, где выделил белки SNARE (soluble NSF-attachment protein receptors). Отмечено, что три белка SNARE: VAMP/синаптобревин, SNAP25 и синтаксин находятся в клетке в стехиометрическом соотношении. На основании этого Д. Ротман предположил, что они функционируют сообща (в везикулярных и целевых мембранах).
Эти белки были идентифицированы ранее другими учеными (Richard Scheller, Kimio Akagawa, Reinhard Jahn and Pietro de Camill). Однако о них было известно лишь то, что они находятся в пресинаптической части (VAMP/синаптобревин — на везикуле, SNAP25 и синтаксин — на плазматической мембране), а их функция не была установлена.
Базируясь на этих данных, Д. Ротман выдвинул гипотезу SNARE, которая предполагала, что эти белки играют крайне важную роль в слиянии везикул с плазматической мембраной путем последовательного процесса, включающего синаптическую фиксацию, активацию и слияние.
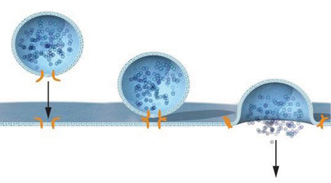
В дальнейших работах Д. Ротман предоставил подтверждения того, что эта система является высокоспецифичной. Так, белки t-SNARE (расположены на мембране, с которой сольется везикула) могут взаимодействовать только с одним или несколькими белками v-SNARE (расположены на везикуле) (рис. 2).
Таким образом, Д. Ротман поделил на составляющие механизм транспорта и слияния везикул и с помощью биохимических исследований создал модель, объясняющую, как везикулярный транспорт происходит с такой высокой специфичностью.
Томас Судоф изучал то, как контролируется слияние везикул в синапсе. Д. Ротман и Р. Шекман предоставили научной общественности фундаментальное понимание механизма слияния везикул, но то, как этот процесс контролируется во времени, было неизвестно. В организме слияние везикул должно держаться под строгим контролем. В частности, в некоторых случаях эти процессы должны осуществляться с высокой скоростью и точностью в ответ на поступление специфического сигнала. Примерами этого служат такие процессы, как высвобождение нейротрансмиттеров в нервной системе, а также секреция инсулина из панкреатических клеток.
Существенное развитие нейрофизиологии было осуществлено благодаря открытиям таких ученых, как Бернард Кац (Bernard Katz), Ульф фон Эулер (Ulf von Euler), Джулиус Аксельрод (Julius Axelrod), которым была присуждена Нобелевская премия по физиологии и медицине в 1970 г. за открытие процессов гуморальной трансмиссии в нейронных окончаниях и механизмах хранения, высвобождения и инактивации нейротрансмиттеров.
Т. Судоф был глубоко заинтересован вопросами регуляции такого быстрого и строго регламентированного во времени процесса, как экзоцитоз синаптических везикул, регулирующийся внутриклеточной концентрацией свободного кальция. Т. Судоф изучал роль кальция в высвобождении нейротрансмиттеров в нейронах и открыл два важнейших белка в кальцийзависимом слиянии везикул — комплексин и синаптотагмин.
Комплексин играет важную роль в реализации поздней стадии синаптического слияния везикул. Это было установлено с помощью нокаутирования (выключения) в нейронах мышей гена, продуктом экспрессии которого является белок комплексин. В этой модели продемонстрировано существенное снижение эффективности высвобождения трансмиттеров при снижении кальциевой чувствительности. Т. Судоф также открыл белок синаптотагмин-1 — трансмембранный кальцийсвязывающий белок, который является сенсором кальция и осуществляет удержание везикулы у пресинаптической мембраны.
Также ученый описал белок Munc18-1, который является аналогом открытого Р. Шекманом белка Sec-1. Впоследствии он получил название SM-белка (Sec/Munc). Munc18-1 взаимодействует с синтаксином. Эти белки являются составляющей интегральной части белкового комплекса, участвующего в слиянии везикул наряду с белками SNARE. Т. Судоф показал, что нокаутирование Munc18-1 у мышей приводит к полной приостановке процессов нейротрансмиттерной секреции из синаптических везикул.
Таким образом, ученый сделал несколько важнейших открытий, а именно: пролил свет на процессы контроля слияния везикул, а также регуляторную роль ионов кальция в процессе высвобождения нейротрансмиттеров в синаптической щели.
В чем заключается ценность этих открытий для медицины?
Благодаря работам этих ученых сегодня известно, как в клетках осуществляется внутриклеточный транспорт. Эти открытия позволили нам в большей степени понять, как происходит сортировка молекул в клетке и что регулирует их транспортировку. На основании того, что мы теперь знаем об этом процессе, становится совершенно очевидно, что возникновение нарушений на любом этапе контроля механизма транспорта и слияния везикул приведет к развитию заболеваний.
Например, к возникновению такого метаболического нарушения, как сахарный диабет II типа, приводят два нарушения, связанные с внутриклеточным транспортом, — в секреции инсулина из панкреатических бета-клеток и транслокации инсулинзависимого глюкозо-транспортера в клетках скелетных мышц и жировой ткани.
Функционирование иммунных клеток также базируется на механизме везикулярного транспорта, а именно секреции цитокинов и других эффекторных иммунных молекул, участвующих в реализации врожденного и адаптивного ответа.
На сегодня уже известно о мутациях в генах, кодирующих белки, принимающих участие в транспорте и слиянии везикул, которые приводят к развитию ряда заболеваний. Так, мутации в гене, кодирующем MUNC18-1, были описаны при некоторых формах эпилепсии.
В определенных подгруппах пациентов с наследственным гематофагоцитарным лимфогистиоцитозом выявлены мутации в генах, кодирующих белки MUNC13-4, MUNC18-2 и синтаксин-1. При данной патологии натуральные киллеры неправильно взаимодействуют с клетками-мишенями, вследствие чего развивается состояние гипервоспаления, которое может привести к летальному исходу.
Помимо этого, на везикулярную транспортную систему направлено воздействие ряда бактериальных токсинов. Так, ботулотоксин (продуцируется анаэробной бактерией Clostridium botulinum) приводит к распаду комплекса SNAP-25, VAMP/синаптобревин и синтаксин, в результате чего блокируется высвобождение ацетилхолина в нейро-мышечном синапсе. Нейротоксин тетанус (Clostridium tetani) воздействует на VAMP/синаптобревин, блокируя высвобождение глицина и гамма-аминомасляной кислоты, что приводит к спазматическому мозговому параличу.
Таким образом, открытия ученых прояснили механизмы развития многих заболеваний, на основании чего в будущем может быть создана эффективная терапия.
Заключение
В 2013 г. Нобелевская премия по физиологии и медицине была присуждена за фундаментальные открытия в сфере внутриклеточного транспорта, которые вносят ясность в понимание того, как внутриклеточные взаимодействия приводят к строгой сортировке молекул.
Внутриклеточная транспортная система играет важнейшую роль в функционировании клетки, органов и организма в целом, по сути являясь звеном, скрепляющим каждый компонент в единое целое.
по материалам www.nobelprize.org, www.ncbi.nlm.nih.gov, www.nature.com, www.cell.com

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим