|
|
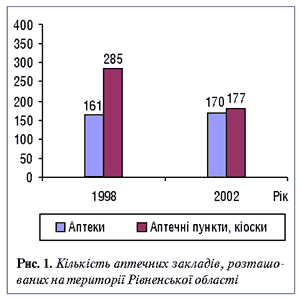
— ДІКЯ в Рівненській області як перший незалежний орган з контролю якості ЛЗ було створено 06.08.1997 р. згідно з наказом МОЗ України № 245. Потреба у створенні такого органу була викликана відсутністю вертикалі фармацевтичного управління, що існувала до 1995 р. (на той час — Головне аптечне управління України та виробничі об’єднання «Фармація» в областях), наявністю достатньо великої кількості суб’єктів підприємницької діяльності недержавної форми власності, неконтрольованими процесами реалізації ЛЗ у будь-яких місцях без дозвільних документів, збільшенням випадків здійснення фармацевтичної діяльності (в основному торгівля ЛЗ) особами без фармацевтичної освіти та суттєвим розширенням аптечної мережі в регіоні (рис. 1) і в державі в цілому.
Упродовж 1-го року роботи ДІКЯ було виявлено масу недоліків у діяльності суб’єктів господарської діяльності, зокрема, торгівля ЛЗ у місцях, не внесених до чинної ліцензії, — у 21 суб’єкта господарської діяльності, невідповідність споруди/приміщень — у 46 суб’єктів (із зареєстрованих 77), було виявлено 187 серій неякісних ЛЗ. Актуальним доповідач назвав прийняття у 1998 р. розпорядження голови Рівненської обласної держадміністрації за № 788 «Про державний контроль якості лікарських засобів», що дало змогу забезпечити роботу суб’єктів фармацевтичної діяльності правовими рамками незалежно від форми власності. Для цього ДІКЯ у Рівненській області було запропоновано схему потрійного контролю (таблиця).
 |
Таблиця
Схема потрійного контролю якості ЛЗ
|
Порушення виявлено вперше |
Суб’єкту надається припис про усунення виявлених недоліків у визначений термін |
|
Порушення виявлено вдруге |
Накладається адміністративне стягнення (залежно від ступеня порушення) |
|
Порушення виявлено втретє |
Матеріали перевірки направляються до органу ліцензування з пропозицією про призупинення дії та/або скасування виданої ліцензії |
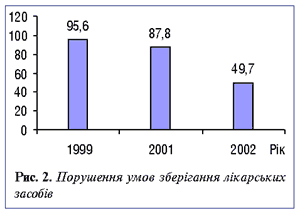
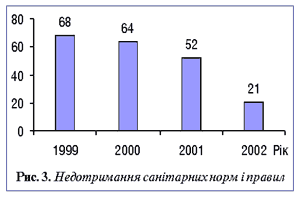
Вказана схема роботи цілком себе виправдовувала до 2002 р. (до моменту забезпечення фармацевтичного ринку аптечними закладами і відповідно ЛЗ). Якщо у 1999 р. порушення умов зберігання ЛЗ спостерігалося у 95,6% аптечних закладів області, то за 9 міс 2002 р. — у 49,7% (рис. 2). Кількість порушень санітарних норм і правил зменшилася з 68 у 1999 р. до 21 — у 2002 р. (рис. 3), тобто почала діяти схема запобігання порушенням законодавства.
 |
«Проблемою 2000» в системі контролю якості ЛЗ як Рівненської області, так і України в цілому В. Стеців назвав масову торгівлю незареєстрованими ЛЗ — порівняно з 1998 р. кількість випадків реалізації незареєстрованих ЛЗ збільшилася майже втричі. Для боротьби із цим явищем ДІКЯ в Рівненській області запровадила низку першочергових заходів: налагодження інформаційної роботи (надання консультацій з питань реєстрації ЛЗ); створення власної web-сторінки в Internet () з винесенням переліку ЛЗ, реєстрація яких в Україні закінчилася; проведення перевірок ЛПЗ з метою запобігання використанню незареєстрованих ЛЗ; надання інформації про реалізацію незареєстрованих препаратів до територіальної ДІКЯ за місцем розташування постачальника. Внаслідок вжитих заходів тенденція щодо зростання кількості випадків реалізації незареєстрованих ЛЗ у 2002 р. сповільнилася, хоча цей показник залишився достатньо високим.
 |
З початку 2000 р. глобального масштабу набула проблема реалізації фальсифікованих ЛЗ. Етапи захисту регіонального ринку від неякісної продукції у 2001–2002 рр. значною мірою були полегшені завдяки прийняттю низки законодавчих та нормативних документів: Доручення Президента України «Про посилення заходів за ввозом, виробництвом, реалізацією на внутрішньому ринку фальсифікованих, неякісних та незареєстрованих лікарських засобів», накази МОЗ України № 436 від 30.10.2001 р. «Про затвердження інструкції про порядок контролю якості лікарських засобів під час оптової та роздрібної торгівлі», № 497 від 27.12.2001 р. «Про порядок заборони (призупинення) та вилучення з обігу неякісних, фальсифікованих та незареєстрованих лікарських засобів».
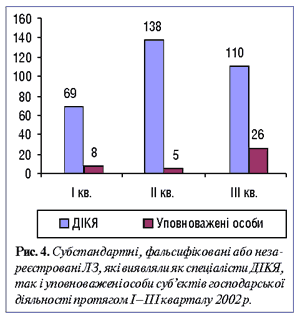
Зокрема, до процесу контролю якості ЛЗ уперше законодавчо були залучені аптечні заклади шляхом введення посади «Уповноважена особа». Таким чином, в аптеці з’явилася людина, яка безпосередньо має відповідати за контроль якості ЛЗ, реалізація яких здійснюється в цьому закладі. Однак ефективність роботи уповноважених осіб залишається на вкрай низькому рівні (рис. 4).
 |
Як зазначив В. Стеців, досвід фахівців ДІКЯ, а також наявність лабораторії з аналізу якості ЛЗ дають змогу виявляти значно більше субстандартних препаратів, ніж це може здійснити будь-яка уповноважена особа, однак значна кількість субстандартних ЛЗ, що були забраковані ДІКЯ за візуальними показниками, могли бути виявлені й уповноваженими особами на етапі надходження їх до аптеки (рис. 5).
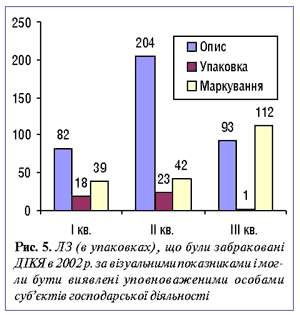 |
Окремо доповідач зупинився на питанні виготовлення ЛЗ в умовах аптеки, зокрема, інфузійних розчинів. Протягом I кварталу 2002 р. ДІКЯ в Рівненській області проведено повторні перевірки аптек, які займаються виготовленням цієї форми ЛЗ. Аналіз результатів перевірок засвідчив, що майже всі керівники аптечних закладів Рівненської області не підійшли серйозно до цієї проблеми — кількість порушень не зменшилася, а навпаки, збільшилася, недоліки, що виявлені під час попередньої перевірки, не усунено, матеріальна база в незадовільному стані, часто навіть відсутні особи, відповідальні за ці ділянки роботи, — завідувачі виробничих відділів, провізори-аналітики та ін. Майже у 100% перевірених аптек виявлено відсутність належної документації на устаткування, що використовується для виробництва ЛЗ (бактерицидні лампи, рефрактометри, сушильні шафи, автоклави, аквадистилятори тощо). Майже серед усіх аптек виявлено порушення умов виробництва ЛЗ; як у 2001 р., так і в 2002 р. не проводиться контроль виготовленої продукції за показником «Пірогенність». У 85% аптечних закладів бракує необхідного для виробництва ЛЗ обладнання, в 60% — виявлено порушення щодо ведення журналів, в 50% — відсутні сертифікати якості виробника та сертифікати аналізу уповноважених лабораторій на субстанції, що використовуються для виготовлення лікарських форм, в 40% — відсутня система очищення повітря, в 30% — склад виробничих приміщень не відповідає діючим вимогам, в 20% — виробничі приміщення потребують ремонту тощо.
Стратегічне вирішення проблем фармацевтичної галузі в системі контролю якості ЛЗ, а саме створення умов для забезпечення населення якісними препаратами, ДІКЯ в Рівненській області вбачає в необхідності формулювання чітких завдань та визначення шляхів їх вирішення. Для підвищення фахового рівня працівників фармацевтичної галузі в Рівненській області було створено єдину базу даних фармацевтичних кадрів, уперше проведено курси підвищення кваліфікації для провізорів-аналітиків на базі ДІКЯ, для забезпечення якості ЛЗ у лікувально-профілактичних закладах необхідно змінити нормативну базу (прийняти наказ про порядок контролю якості ЛЗ в ЛПЗ), поглиблювати інформаційну співпрацю з лікарями. Для підвищення ефективності роботи уповноважених осіб проводити навчання, семінари, посилити відповідальність уповноважених осіб, внести зміни до переліку посад фармацевтичних працівників (з чітким визначенням посади «Уповноважена особа»). Для зменшення кількості випадків реалізації незареєстрованих, фальсифікованих ЛЗ необхідно активізувати співпрацю з правоохоронними органами, налагоджувати інформування про всі випадки виявлення фальсифікованих та незареєстрованих ЛЗ через ЗМІ. Щодо порядку розгляду скарг громадян у разі придбання неякісних ЛЗ внести зміни до законодавства із чітким визначенням ролі ДІКЯ та заходів стосовно аптек, які допустили реалізацію неякісної продукції. Активізувати взаємодію з органом ліцензування з метою забезпечення видачі ліцензії суб’єктам господарської діяльності, які допускають мінімум порушень чинного законодавства. З метою забезпечення належних умов щодо виготовлення ЛЗ в умовах аптеки налагодити видачу ліцензій виключно тим аптечним закладам, в яких створено необхідні умови. Для забезпечення належного виписування рецептів на ЛЗ рецептурного списку та впорядкування рецептурно-безрецептурного відпуску ЛЗ посилити взаємодію з Управлінням охорони здоров’я та ЛПЗ Рівненської області.
Максим Плошенко
Фото Євгена Кривші


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим