|
АКТИВНИЙ ФАРМАЦЕВТИЧНИЙ ІНГРЕДІЄНТ (АФІ) — стандартизована біологічно активна речовина (БАР) (або їх суміш) природного (людського, тваринного, рослинного), синтетичного, біотехнологічного чи мінерального походження, яка має певну фармакологічну дію та використовується з метою виробництва (виготовлення) ЛП. Термін «АФІ» має низку синонімів: лікарська речовина, діюча речовина, активна речовина, лікарська субстанція, які широко використовуються в науковій і практичній фармації та медицині. АФІ повинні мати властивості відповідно до вимог Державної Фармакопеї України (ДФУ) або аналітично-нормативної документації (АНД) та дозвіл уповноваженого органа на медичне використання. Для АФІ, що є стандартизованою сумішшю БАР тваринного або рослинного походження, а також неорганічною речовиною, можливі додаткові вимоги, які зазначені в окремих статтях ДФУ. Остаточний висновок про якість АФІ роблять з урахуванням відповідності його виробництва вимогам GMP за конкретною технологією та умовами реалізації (транспортування, зберігання). Усі зміни, що вносяться виробником у технологію виробництва АФІ, супроводжуються поданням до уповноваженого органу (який відповідає за виробництво або якість готової фармацевтичної продукції) даних, що підтверджують можливість контролю його якості за вимогами відповідної монографії ДФУ або АНД. Зразки всіх серій АФІ, використаних для виробництва ЛП, зберігаються на підприємстві не менше 2 років після випуску готової продукції. АФІ, що використовуються для виробництва ветеринарних ЛП, повинні також відповідати вимогам Європейської Фармакопеї (ЄФ) або ДФУ.
Усі АФІ, перш за все, поділяють на оригінальні та відтворені відповідно до оригінальних (генеричні). За ступенем токсичності АФІ поділяють на: отруйні (з дуже високою біологічною активністю, які прописують, відпускають, зберігають, здійснюють їх облік за певними правилами, встановленими Міністерством охорони здоров’я (МОЗ); вони включені до списку отруйних лікарських речовин); сильнодіючі (з високою біологічною активністю, які прописують, відпускають, зберігають, здійснюють їх облік за певними правилами, встановленими МОЗ; вони включені до списку сильнодіючих лікарських речовин) та звичайні. Виділяють також наркотичні, психотропні речовини та прекурсори, які також мають свої особливі правила обігу, встановлені МОЗ України. Інколи в окрему групу виділяють рослинні субстанції. Витяжки з рослин, що використовують для виробництва ліків, також вважаються субстанціями. Можлива класифікація АФІ за іншими ознаками, наприклад, залежно від фармакологічної дії, можливості накопичуватись в організмі, молекулярної маси, стійкості до температури, здатності до іонізуючого випромінювання, ступеня розчинності, забарвленості тощо. Для систематики та ідентифікації активних субстанцій, які виведені на фармринок, використовується класифікаційна система міжнародних непатентованих назв (МНН) — International Nonproprietary Noms (INN), за якою кожному АФІ надається тільки одна назва. Класифікаційні системи МНН та АТС (див. Класифікаційні системи лікарських препаратів) доповнюють одна одну і використовуються як методологічна основа та міжнародний стандарт у маркетингових (статистичних) дослідженнях ЛП на фармринку України (Лист МОЗ України № 1801.05/907 від 30.05.2000 р.). Це дозволяє ідентифікувати ЛП за складом, здійснювати контроль за обігом на ринку та оптимізувати їх використання.
Літ.: Закон України «Про лікарські засоби»; зі змінами і доповненнями 14.02.1997 р. № 70/97 — ВР та 30.06.1999 р. № 783 — ХІV; Державна Фармакопея України. — Х., 2005; Настанова 42-02-2002 Лікарські засоби: Належна виробнича практика активних фармацевтичних інгредієнтів. — К., 2002; Еженедельник АПТЕКА. — 2004. — № 30; Directive 2001/82 EC relating to veterinary medicinal products (O.J.L. 311, 28.11.2001).
ЗАСІБ як термін може визначати декілька різносторонніх понять (спосіб, прийом, захід, пристрій, знаряддя, якусь спеціальну дію тощо) і використовуватись у найрізноманітніших сферах діяльності людини: спілкуванні, праці, освіті, пересуванні, виробництві, лікуванні, при переліку предметів і продуктів праці, інформації та ін. Наприклад, З. для зміцнення здоров’я, З. виробництва, технічний З., транспортний З., З. фармацевтичної інформації, закупорювальний З., З. навчання та ін. В економіці та фінансах термін З. може означати кошти, капітал, кредити або часткове їх призначення, наприклад, обігові З. Незважаючи на таке широке використання терміну його змістовне значення (дефініція) відсутнє в енциклопедичних виданнях та більшості тлумачних і довідкових словників, включаючи словник В.І. Даля, а якщо й наводиться, то тільки в словосполученні.
З. у словосполученні широко використовується в медицині, фармації, косметології, ветеринарії та інших сферах, відбиваючи найрізноманітніші поняття. Наприклад, лікувальні З. означають предмети або заходи впливу (у тому числі процедури) на організм людини чи тварини, призначені для діагностики, запобігання хворобі або її усунення (ліки, З. від кашлю, дезінфекційні З., перев’язувальні З. тощо). Отже, лікарські З. теж належать до групи лікувальних З. Відповідно до українсько-англійського медичного словника Дорланда (у 2 томах, містить близько 122 000 термінів), що є перекладом 30-го американського видання, знаходимо: «засіб agent (agens — діючий) — будь-яка речовина, яка може викликати фізичну, хімічну або біологічну дію, або device — що-небудь, розроблене для конкретних цілей. З численних прикладів витікає, що «засіб» може використовуватись (перекладатись) в значенні речовини (найчастіше) чинника, агента, рідко — препарата, медикамента. Медикамент (лат. medicamentum) — лікувальна речовина або агент. Термін «медикаментозний» — такий, що використовується як ліки, стосується їх або ними спричиняється. Отже, в медицині використовується багато зручних, але не конкретних термінів, причому навіть в такому авторитетному тлумачному словнику Дорланда, який протягом 100 років формує термінологію усіх розділів медицини, фармації, ветеринарії та інших галузей знань, дотичних до медицини.
У фармацевтичній галузі лікарські З. (Medicamina) — це дуже різноманітна група продукції, яка відрізняється за призначенням, складом, походженням, агрегатним станом, зовнішнім виглядом тощо. Лікарським З. може бути лікарська рослинна сировина (Medicamina cruda), що піддавалась простій обробці (сушінню) і залишилась цілою (листя, коріння, квіти, трава), або була перероблена у промислових умовах (Medicamina prаeparata) на настойки, сиропи, екстракти і т.д., які, в свою чергу, як вихідна сировина можуть використовуватись для виготовлення ліків. До лікарських З. належать також лікарські субстанції різної природи: синтетичні, продукти життєдіяльності мікроорганізмів або отримані з органів, тканин і соків живих організмів, ізотопи радіоактивних елементів та ін. (див. Активний фармацевтичний інгредієнт), а також лікарські препарати, що являють собою не вихідну сировину для виробництва ліків, а продукцію, готову до вживання хворою людиною (див. Лікарський препарат).
Отже, у медицині під терміном «лікарський З.» розуміють всю продукцію і заходи, які використовують для лікування, діагностики та профілактики різних захворювань, що не може бути прийнятним у фармацевтичній галузі. Тому у фармації, особливо в науковій, навчальній та довідковій літературі, якщо мова йде про конкретну асортиментну продукцію, яка відповідає ознакам готової продукції, слід використовувати термін лікарський препарат, а у разі, коли мова йде про лікарські субстанції, тобто вихідну сировину, слід застосовувати термін АФІ, а не лікарський З., оскільки змістовне значення (дефініція) останнього може тлумачитись по-різному, що не є прийнятним (див. Фармацевтична термінологія). Це важливо ще й тому, що фармацевтичні терміни використовуються міжнародними уніфікованими класифікаційними системами (див. Класифікаційні системи лікарських препаратів), безпосередньо стосуються фармакотерапії (див. Фармакотерапія) і як соціально значимі чинники можуть впливати на стан надання медичної допомоги.
Літ.: Закон України «Про лікарські засоби». — АВВР. — 1996. — № 22.; Перцев І.М. Про значення фармацевтичних термінів в сьогоденні // Вісник фармації. — 1993. — № 1–2; Перцев И.М. Размышления о фармацевтической терминологии // Провизор. — 2004. — № 1; Перцев И.М. Лекарственное средство или лекарственный препарат // Провизор. — 2006. — № 22; Большой толковый словарь русского языка / Глав. ред. С.А. Кузнецов — СПб., 1998; Новий тлумачний словник української мови. У трьох томах. — К., 2001; Наказ МОЗ України від 20.07.2006 р. Про затвердження Переліків назв лікарських форм та упаковок для лікарських засобів; Світлична Є.І., Толок І.О. Латинська мова — Х., 2004; Українсько-англійський ілюстрований медичний словник Дорланда. У двох томах. — Львів, 2007; Чернявский М.Н. Латинский язык и основы фармацевтической терминологии. — М., 1984.
ЛIКУВАЛЬНІ ЗAСОБИ (Remedium) об’єднують усі чинники та сприятливі умови, які прямо або опосередковано впливають на хворий організм і сприяють відновленню здоров’я або запобігають захворюванню. До цього комплексу понять відносять курортний режим, ванни, дієту, світлолікування, діатермію, електризацію та багато інших фізичних чинників і, звичайно, вплив ліків. Отже, лікарська терапія є ключовим, але не єдиним методом, що використовується сучасною медициною з метою запобігання та боротьби з хворобами (див. також Засіб).
Літ.: Півненко Г.П. Аптечна технологія ліків. — К., 1962; Муравьев И.А., Технология лекарств. — М., 1971.
ПРЕПАРАТ (лат. preparatus — виготовлений) може означати: 1) хімічний або фармацевтичний продукт лабораторного чи заводського виготовлення для лікування або іншого призначення; 2) організм або речовину, виготовлену для наукового дослідження, демонстрації чи спостереження. У біології, медицині та фармації П. найчастіше використовується у словосполученні, наприклад, мікробіологічний П., анатомічний П., лікарський П., фармацевтичний П. тощо. У давні часи, коли ліки виготовлялись з об’єктів рослинного, тваринного або мінерального походження, найчастіше використовувався термін «препарат», наприклад, галенові П. На початку ХХ ст. деякі субстанції, що вироблялись хіміко-фармацевтичною промисловістю і були готовою продукцією, також отримували назву препаратів, наприклад, сульфаніламідні П., гормональні П. Пізніше, з інтенсивним розвитком фармацевтичної галузі, значним розширенням асортименту фармацевтичної продукції поряд з ЛП став широко використовуватися термін «Лікарський засіб», який визначає широкий спектр понять (див. Засіб), а тому є зручним у загальній та медичній лексиці, однак є неприйнятним у фармації, де неможливе використання неконкретних та двозначних за змістом термінів, таких, як лікарський засіб, який при виробництві ліків може водночас визначати вихідну сировину (лікарську субстанцію), та готову фармацевтичну продукцію, яка безпосередньо використовується для лікування, профілактики чи діагностики певної хвороби, наприклад, ЛП. Необхідність уніфікації фармацевтичної термінології підтверджується також численними виданнями нормативної, навчальної, довідкової літератури в медицині та фармації, де зазначені терміни нерідко використовуються як синоніми, що може призвести до їх неправильного тлумачення та помилкового використання фахівцями в практичній діяльності.
Літ.: Закон України «Про лікарські засоби» № 123/96-ВР; Машковский М.Д. Лекарственные средства. — М., 2007; Чернявский М.Н. Латинский язык и основы фармацевтической терминологии. — М., 1984; Перцев І.М. Про значення фармацевтичних термінів в сьогоденні // Вісник фармації. — 1993. — № 1–2; Світлична Є.І., Толок І.О. Латинська мова. — Х., 2004; Івченко А.О. Тлумачний словник української мови. — Х., 2006; Словарь русского языка / Под общ. ред. акад. С.П. Обнорского. — М., 1953; Перцев И.М. Стандартизация фармацевтических терминов необходима // Еженедельник АПТЕКА. — 2007. — № 2; Українсько-англійський ілюстрований медичний словник Дорланда. У двох томах. — Львів, 2007.
ЛІКАРСЬКИЙ ПРЕПАРАТ (лат. Medicamina — ЛП або Medicamina praeparatus — ЛП, виготовлений штучно) — продукт фармацевтичної діяльності, що має певний склад, певну лікарську форму, упаковку, термін придатності та рекомендації до застосування (див. Листок-вкладиш), рідше — фармацевтичний препарат, що означає — ліки. ЛП призначають людині чи тварині з метою діагностики, лікування чи зменшення вираженості симптомів захворювання або зміни (поліпшення) фізіологічного чи патологічного стану організму, а також профілактики (наприклад контрацептивні або стрес-препарати) і мають широковживаний синонім «Ліки». До ЛП висуваються суворі вимоги щодо терапевтичної ефективності, безпеки, точності дозування діючих речовин та ін.; вони дозволяються до застосування в медичній практиці тільки після державної реєстрації (див. Державний реєстр лікарських засобів) і підлягають обов’язковій стандартизації та сертифікації. Якість ЛП контролюється відповідно до вимог АНД та показників біодоступності (див. Аналітично-нормативна документація, Біологічна доступність). Останнім часом відмічають тенденцію до підвищення вартості розробки (див. Фармацевтична розробка) та складності виведення ЛП на ринок внаслідок підвищення вимог до його якості (збільшення кількості та складності фармацевтичних і клінічних досліджень). Так, вартість оригінального ЛП у 1995 р. становила близько 600 млн дол. США, у 2000 р. — більше 800 млн дол., а нині нерідко досягає 1–1,5 млрд дол.
Єдиної класифікації ЛП не існує. Більшість класифікацій базується на системному принципі дії ЛП, де перевага надається направленості впливу на функції окремих систем організму: серцево-судинну, органів дихання, травлення тощо. Часто ЛП класифікують за їх основним фармакологічним ефектом або видом біологічної активності (снодійні, анальгетичні, жовчогінні, проносні, наркотичні, психотропні та ін.) або за фармакотерапевтичним принципом (протиепілептичні, протипаркінсонічні, протиаритмічні та ін.). Інколи ЛП систематизують за локалізацією і характером дії на рівні специфічних рецепторних систем (холіноміметики і холіноблокатори, адреноміметики і адреноблокатори). При більш докладній систематизації їх поділяють з урахуванням направленості дії на окремі типи рецепторів, наприклад, М-холіноміметичні, М-холіноблокуючі, М- і Н-холіноміметичні, a-адреноміметичні, b-адреноміметичні та ін.). У деяких випадках систематизація ЛП проводиться на основі органної локалізації (серцеві глікозиди, маткові ЛП), механізму дії (інгібітори моноамінооксидази А, антихолінестеразні та ін.), належності ЛП до певних класів речовин біогенної природи (вітамінні, гормональні, ферментні та ін.). Протимікробні та протипаразитарні ЛП поділяють за спектром їх дії (протитуберкульозні, протигрибкові, противірусні, протипухлинні тощо) або за переважними особливостями застосування (антисептичні, дезінфекційні, рентгеноконтрастні). З профілактичною метою використовують головним чином дезінфекційні, хіміотерапевтичні, вітамінні та деякі інші ЛП. Можлива систематизація ЛП за напрямком призначення у медицині (офтальмологічні, стоматологічні, косметологічні, гомеопатичні, імунобіологічні) та за іншими ознаками. Наприклад: за складом (прості, комбіновані); вмістом певних лікарських речовин (препарати натрію, калію, кальцію, бромідів, гормонів); за ступенем токсичності (отруйні, сильнодіючі, звичайні); за видом лікарської форми (таблетки, мазі, емульсії і т.д.); за шляхом уведення в організм (ін’єкційні, ректальні, трансдермальні тощо); за здатністю контролювати вивільнення АФІ з лікарської системи (див. Терапевтичні лікарські системи); за правилами відпуску з аптеки (рецептурні, безрецептурні); за властивістю накопичуватись в організмі; за належністю до певної групи (інноваційні (оригінальні), відтворені (генеричні) чи життєво необхідні ліки) та іншими ознаками (препарати рослинного походження (фітопрепарати), біотехнологічний ЛП тощо). В окремі групи виділяють неякісні ЛП, які не повинні бути в обігу на фармринку (див. Неякісні ліки), препарати для захисту рослин від шкідників та хвороб (фунгіциди та ін.), для лікування хвороб у тварин (див. Ветеринарні препарати).
Кожна класифікація має свої переваги і недоліки, а різноманіття класифікаційних підходів робить їх непридатними для одержання статистичних даних про наявність ЛП на фармринку, для планування необхідного обсягу їх виробництва, контролю за оптимальним використанням, класифікації їх побічної дії та в інших випадках, коли необхідні узагальнені дані. З цією метою в другій половині XX ст. ВООЗ були запропоновані уніфіковані класифікаційні системи ЛП, які одночасно враховують механізм їх дії, показання до застосування та хімічну структуру АФІ (див. Класифікаційні системи лікарських препаратів). Кожному ЛП певного складу, дозування (сили дії) і лікарської форми (ЛФ) присвоюється тільки один АТС-код. Більше одного АТС-коду може бути надано ЛП, які виробляються в різних дозуваннях, або ЛФ з чітким розмежуванням показань до медичного застосування.
Вибір ЛП з метою використання в терапії (див. Фармакотерапія) здійснюють з урахуванням їх фармакокінетичних та фармакодинамічних характеристик, особливо при комбінованій лікарській терапії (див. Фармакокінетика, Фармакодинаміка), а також з урахуванням лікарської форми і шляхів уведення (див. Лікарська форма, Шляхи введення ліків) та можливих небажаних ефектів (див. Побічна дія ліків). При одночасному прийомі двох і більше ЛП враховують їх можливу взаємодію (див. Взаємодія ліків).
Літ.: Взаимодействие лекарств и эффективность фармакотерапии / Л.В. Деримедведь, И.М. Перцев, О.В. Шуванова и др. — Х., 2002; Закон України «Про лікарські засоби» зі змінами і доповненнями 14 лютого 1997 р. № 70/97-ВР та 30 червня 1999 р. № 783 — XIV; Настанова 42-02-2002. Лікарські засоби. Належна виробнича практика активних фармацевтичних інгредієнтів. — К., 2002; Настанова 42-3.4: 2004. Настанови з якості. Лікарські засоби. Виробництво готових лікарських засобів. — К. 2004; Первый отечественный форум по клиническим испытаниям // Еженедельник АПТЕКА. — 2006. — № 44; Фармакологія / За ред. І.С. Чекмана. — К., 2001; Українсько-англійський ілюстрований медичний словник Дорланда. У двох томах. — Львів, 2007; Фармацевтичні та медико-біологічні аспекти ліків / За ред. І.М. Перцева. — Вінниця, 2007; Фармацевтическая опека / И.А. Зупанец, В.П. Черных, С.Б. Попов и др. — Х., 2003.
ОРИГІНАЛЬНИЙ (ІННОВАЦІЙНИЙ) ЛІКАРСЬКИЙ ПРЕПАРАТ (лат. originalіs — первісний, початковий, тобто справжній, автентичний) — вперше виведений на фармринок ЛП, що містить новий синтезований чи отриманий іншим способом АФІ і пройшов повний цикл доклінічних та клінічних досліджень, дозволений до медичного застосування та, як правило, захищений патентом на певний строк (у більшості країн світу пріоритет розробника охороняється законодавчо). Можливі інші визначення терміну, так, відповідно до визначення Європейського медичного агентства (European Medicines Agency — EMEA) оригінальний, або інноваційний, ЛП містить нову активну субстанцію або уже відомий один чи декілька фармацевтичних продуктів з новим показанням до застосування. Управління за контролем харчових продуктів і лікарських препаратів (FDA) США зазначає, що інноваційний ЛП може містити як нову активну речовину (хімічну субстанцію), що раніше не застосовувалась, так і активну речовину, яка раніше була відомою, але зараз вживається в іншій дозі або іншим способом надходить до організму. Такі інноваційні ЛП FDA називає модифікованими. Прикладом модифікованого ЛП є АРИФОН® РЕТАРД, в якому діюча речовина індопамід у вигляді гранул рівномірно розподілена в гідрофільному матриксі таблеток, покритих оболонкою, які забезпечують гіпотензивний ефект протягом 24 год (звичайні таблетки проявляють гіпотензивну дію протягом 2 год), має пролонговану дію, захищає організм від ускладнень, пов’язаних з перепадами артеріального тиску, містить меншу кількість АФІ та добре переноситься. Також прикладом може бути комбінований ЛП ФЕЗАМ (цинаризин з пірацетамом). Отже, інноваційний ЛП — новий, вперше зареєстрований відповідно до повного реєстраційного досьє і відрізняється від оригінального ЛП тим, що є його модифікацією.
Для компенсації великих витрат на фармацевтичну розробку оригінального або інноваційного ЛП фірми-виробники підтримують високі ціни протягом певного строку, часто враховуючи і витрати на інші ЛП, які з різних причин не були виведені на ринок. Цим пояснюється значно вища вартість оригінальних ЛП порівняно з відтвореними. Однак оригінальні, або інноваційні, ЛП зумовлюють більш високу ефективність при фармакотерапії багатьох захворювань, в тому числі тих, які раніше мало піддавались лікуванню або не лікувались взагалі. На сьогодні вони є стандартами і використовуються як референтні ЛП (див. Референтний препарат).
Літ.: БСЭ. — М., 1974. — Т. 18; Словарь русского языка / Под общ. ред. акад. С.П. Обнорского. — М., 1953; Безюк Н.Н. АРИФОН® РЕТАРД: значение инновационной формы для пациентов с АГ // Еженедельник АПТЕКА. — 2006. — № 46.
ВІДТВОРЕНИЙ ЛІКАРСЬКИЙ ПРЕПАРАТ — копія, яка за терапевтичною ефективністю і безпекою повинна відповідати оригінальному, або інноваційному, препарату, що виробляється фармацевтичними підприємствами після закінчення терміну дії патентного захисту (див. Референтний препарат). За визначенням Європейської федерації асоціацій фармацевтичних виробників (EFPIA), відтворений ЛП — генерик (дженерик) взаємозамінний з оригінальним аналогом, виведений на ринок після закінчення терміну його патентного захисту. Можливі інші визначення терміну (залежно від площини розгляду). Найчастіше рекомендується використовувати термін відтворений (непатентований, багатоджерельний) ЛП, тобто препарат, що використовується у медичній практиці як взаємозамінний з оригінальним препаратом, що виробляється, як правило, без ліцензії або інших виняткових прав від компанії-розробника і реалізується після закінчення строку дії патенту. Цей термін не слід плутати з генеричними назвами АФІ, де зазвичай використовують міжнародні непатентовані назви (див. Класифікаційні системи лікарських препаратів). На фармринку відтворені ЛП можуть реалізувати під звичайними непатентованими назвами або під певними торговими марками. Торгові марки відтворених ЛП, які мають індивідуальність, позиціонування (див. Позиціонування товару) та певну цінність у свідомості споживачів, стають брендами (див. Бренд), тобто широко відомими та конкурентоспроможними на фармринку. Для виробника вони стають головним надбанням (нематеріальними активами підприємства). Велика різноманітність торгових марок відтворених ЛП декількох поколінь та кінцева невизначеність в термінологічному плані нерідко змушує використовувати в літературі їх неузгоджену класифікацію. Наприклад, генеричні генерики (амлодипін, дротаверин) — давно відомі на ринку ЛП, які стали надбанням суспільства. Вони не підлягають юридичному захисту і можуть вироблятись будь-яким виробником ліків або мати назву «парасолькових» торгових марок, наприклад, амлодипін-Здоров’я, дротаверин-Дарниця. Брендові генерики — нові торгові марки, які стали популярними на фармринку (наприклад із субстанції амлодипіну: амло, нормодипін тощо). Парасолькові бренди–генерики (амлоприл-Дарниця, вазостат-Здоров’я) можуть бути юридично захищені свідоцтвами.
Основною проблемою виведення нового генерика на ринок є документальне підтвердження його відповідності оригінальному, або інноваційному, ЛП за біоеквівалентністю як основний доказ, що копія відповідає оригіналу за терапевтичною ефективністю і безпекою. Однак для виробництва відтворених ЛП можливе використання різних за якістю та виробництвом АФІ та інших складових компонентів чи матеріалів (допоміжних речовин, пакувальних матеріалів для виготовлення первинної тари), також можуть бути різними науково-технічний рівень виробників, технологічний процес, використане обладнання та ін., що може зумовити його неповну ідентичність з оригінальним ЛП. У зв’язку з цим у розвинутих країнах існує практика умовного розподілу зареєстрованих відтворених ЛП на дві категорії: з доведеною терапевтичною еквівалентністю (категорія А) та без такої (категорія Б). У США така інформація з 1970 р. публікується в спеціальному збірнику (Orange Book). Необхідність розподілу відтворених ЛП на дві категорії пояснюється тим, що фахівці та пацієнти повинні мати доступ до інформації про терапевтичну ефективність ліків. В Україні така інформація про генерики поки відсутня, що може стати причиною невпевненості фахівців та пацієнтів в якості ЛП. За такої ситуації рекомендується ширше використовувати інформацію про якість ЛП у публікаціях авторитетних міжнародних організацій (ВООЗ, Європейського агентства з оцінки ЛП та ін.).
Оскільки відтворений ЛП не проходить усіх стадій клінічних випробувань, він є більш доступним за ціною (але не повинен бути менш ефективним і безпечним). Формальні вимоги до виробництва оригінальних, або інноваційних, ЛП і відтворених (генеричних) ЛП повинні бути однаковими і відповідати правилам Належної виробничої практики (GMP), які гарантують достатній рівень якості фармацевтичної продукції. В усіх країнах світу основним способом лікування малозабезпечених категорій хворих є імпортні або власного виробництва відтворені ЛП. Сучасний фармринок України в основному (~85%) є ринком відтворених ЛП. Подібну ситуацію відмічають і на фармринку інших країн. Так, обсяг продажу відтворених ЛП у 2003 р. сягав у США понад 25%, у Німеччині — 35%, Великобританії та Угорщині — 55%, Польщі — 60%, Росії — 78% і т.д. Темпи росту їх продажу в розвинутих країнах у 2 рази випереджають темпи продажу оригінальних ЛП. Так, обсяг продажу відтворених ЛП на світовому фармринку в 2004 р. становив майже 40 млрд дол., а в 2005 р. — близько 45 млрд дол. Прогнозується, що темпи росту продажу відтворених ЛП збережуться (на рівні 12–14% на рік) до 2010 р. і досягнуть 80–83,9 млрд дол. (рис. 1).
|
Причому в першу чергу будуть збільшуватись обсяги продажу генериків-брендів (див. Бренд). У той же час обсяг продажу оригінальних ЛП прогнозується не вище 5–7%. Головними чинниками, що будуть сприяти збільшенню обсягу ринку відтворених ЛП, є втрата маркетингової ексклюзивності низки ЛП, високі ціни оригінальних ліків, скорочення витрат на охорону здоров’я урядами різних країн. У зв’язку з прагненням до скорочення витрат на лікарське забезпечення малозабезпечених категорій населення у США, Франції, Іспанії та ін. країнах виробництво відтворених ЛП стимулюється державою, а їх «популяризація» зведена до рангу офіційної політики. Відтворені ЛП закуповують для забезпечення населення, армії, державних та благодійних програм. У країнах з дефіцитом бюджету на охорону здоров’я рекомендується, щоб лікарська політика ґрунтувалася на переважному використанні відтворених ЛП. За визначенням ВООЗ, регулювання ринку генериків є актуальним для всіх без винятку країн світу.
Літ.: Белоусов Ю. Дженерики — мифы и реалии // Ремедиум. — 2003. — № 7–8; Выдача Разрешений на маркетинг лекарственных препаратов с акцентом на многоисточниковые (генерические) препараты // Еженедельник АПТЕКА. — 2004. — № 30; Мешковский А.П. Место дженериков в лекарственном обеспечении // Фарматека. — 2003. — № 3; Передерий В.Г., Безюк М.М. Бренды и генерики. Друзья или враги Две стороны одной медали // Укр. мед. часопис. — 2004. — № 5; Еженедельник АПТЕКА. — 2005. — № 4; Там же. — 2006. — № 50.
Далі буде

 Одним з відповідальних та авторитетних видань, що планується видати до VII Національного з’їзду фармацевтів України, є Фармацевтична енциклопедія. Раніше (див. «Щотижневик АПТЕКА» та ) повідомлялось про те, що редакційна рада Фармацевтичної енциклопедії продовжує роботу з підготовки нового 2-томного видання та запрошує фахівців фармацевтичної галузі взяти активну участь у цій важливій справі. Дещо пізніше (див. «Щотижневик АПТЕКА» ) було порушено питання про необхідність перегляду дефініцій деяких базових термінів, що часто використовуються фахівцями у практичній діяльності, та пропонувались шляхи його вирішення. Так, частовживаний в медичній лексиці термін «лiкарський зaсіб»* — надзвичайно зручний у медичній практиці, бо поєднує все, що використовується в терапії, профілактиці та діагностиці різних захворювань (лікарські препарати, процедури, предмети медичного призначення, наприклад, засоби для перев’язування тощо). Проте цей термін не зовсім прийнятний у фармації через неконкретність та двоїстість за змістовним значенням. Найгірше те, що він часто поєднує такі поняття, як активний фармацевтичний інгредієнт (лікарська субстанція), що є вихідною сировиною при виготовленні ліків, і лікарський препарат, що є готовим фармацевтичним продуктом (див. Закон України «Про лікарські засоби»). До речі, термін «активний фармацевтичний інгредієнт» на фармацевтичному ринку також може мати статус готової продукції, наприклад, для фармацевтичних фірм, що виготовляють лікарські субстанції. Поєднання продукції, яка має різні характеристики та призначення, в єдиному понятті «лікарський засіб» спричиняє певну змістовну плутанину, принижує значущість фармацевтичної галузі, де над створенням, вивченням, виробництвом, контролем якості, реалізацією та оптимальним використанням ліків працює велика армія спеціалістів. Тому непрофесійне використання цих термінів фахівцями, м’яко кажучи, є некоректним. Обидва терміни безпосередньо стосуються лікарської терапії і як соціально значимі чинники можуть вплинути на якість надання медичної допомоги. Крім того, відповідно до положень класичної термінології кожен термін слід використовувати професійно за призначенням, а їх дефініції не повинні мати двоякого тлумачення. З цього погляду назріла нагальна необхідність в уніфікації або стандартизації низки фармацевтичних термінів, які часто використовуються фахівцями. Спеціалісти-науковці підкреслюють, що стандартизація фармацевтичних термінів важлива як для навчального процесу, так і для практичної фармації в цілому, наприклад, при вивченні фармацевтичного ринку, плануванні обсягу та структури споживання ліків, виявленні їх недоліків, розробці та використанні стандартів у медицині та фармації (правильне призначення, передбачення взаємодій, побічних реакцій, врахування особливостей стану пацієнта, контроль результативності тощо). Молоді спеціалісти повинні опановувати фармацевтичні терміни і професійно їх використовувати в практичній діяльності, що має особливе значення в умовах «Інтеграції України до європейського простору» (див. «Щотижневик АПТЕКА» .). Адже термінологія полегшує взаєморозуміння й взаємодію фахівців на ринковому просторі та використання ними набутого світового досвіду. Впровадження у медичну практику і широке використання комп’ютерної техніки та уніфікованих класифікаційних систем викликає труднощі у визначенні багатьох проблемних питань щодо ліків, наприклад, маркетингу лікарських препаратів (ЛП) на ринку, обсягу оптимального використання ЛП, класифікації їх побічної дії та ін., що вимагає точного визначення дефініцій таких базових термінів, як активний фармацевтичний інгредієнт, лікарська форма, лікарський препарат та лікарський засіб. Враховуючи викладене, на суд фахівців фармацевтичної галузі виноситься перша низка дефініцій базових термінів, які після обговорення їх змісту з метою уточнення будуть внесені до бази даних 2-го видання Фармацевтичної енциклопедії. Перелік дефініцій термінів для обговорення наводиться нижче.
Одним з відповідальних та авторитетних видань, що планується видати до VII Національного з’їзду фармацевтів України, є Фармацевтична енциклопедія. Раніше (див. «Щотижневик АПТЕКА» та ) повідомлялось про те, що редакційна рада Фармацевтичної енциклопедії продовжує роботу з підготовки нового 2-томного видання та запрошує фахівців фармацевтичної галузі взяти активну участь у цій важливій справі. Дещо пізніше (див. «Щотижневик АПТЕКА» ) було порушено питання про необхідність перегляду дефініцій деяких базових термінів, що часто використовуються фахівцями у практичній діяльності, та пропонувались шляхи його вирішення. Так, частовживаний в медичній лексиці термін «лiкарський зaсіб»* — надзвичайно зручний у медичній практиці, бо поєднує все, що використовується в терапії, профілактиці та діагностиці різних захворювань (лікарські препарати, процедури, предмети медичного призначення, наприклад, засоби для перев’язування тощо). Проте цей термін не зовсім прийнятний у фармації через неконкретність та двоїстість за змістовним значенням. Найгірше те, що він часто поєднує такі поняття, як активний фармацевтичний інгредієнт (лікарська субстанція), що є вихідною сировиною при виготовленні ліків, і лікарський препарат, що є готовим фармацевтичним продуктом (див. Закон України «Про лікарські засоби»). До речі, термін «активний фармацевтичний інгредієнт» на фармацевтичному ринку також може мати статус готової продукції, наприклад, для фармацевтичних фірм, що виготовляють лікарські субстанції. Поєднання продукції, яка має різні характеристики та призначення, в єдиному понятті «лікарський засіб» спричиняє певну змістовну плутанину, принижує значущість фармацевтичної галузі, де над створенням, вивченням, виробництвом, контролем якості, реалізацією та оптимальним використанням ліків працює велика армія спеціалістів. Тому непрофесійне використання цих термінів фахівцями, м’яко кажучи, є некоректним. Обидва терміни безпосередньо стосуються лікарської терапії і як соціально значимі чинники можуть вплинути на якість надання медичної допомоги. Крім того, відповідно до положень класичної термінології кожен термін слід використовувати професійно за призначенням, а їх дефініції не повинні мати двоякого тлумачення. З цього погляду назріла нагальна необхідність в уніфікації або стандартизації низки фармацевтичних термінів, які часто використовуються фахівцями. Спеціалісти-науковці підкреслюють, що стандартизація фармацевтичних термінів важлива як для навчального процесу, так і для практичної фармації в цілому, наприклад, при вивченні фармацевтичного ринку, плануванні обсягу та структури споживання ліків, виявленні їх недоліків, розробці та використанні стандартів у медицині та фармації (правильне призначення, передбачення взаємодій, побічних реакцій, врахування особливостей стану пацієнта, контроль результативності тощо). Молоді спеціалісти повинні опановувати фармацевтичні терміни і професійно їх використовувати в практичній діяльності, що має особливе значення в умовах «Інтеграції України до європейського простору» (див. «Щотижневик АПТЕКА» .). Адже термінологія полегшує взаєморозуміння й взаємодію фахівців на ринковому просторі та використання ними набутого світового досвіду. Впровадження у медичну практику і широке використання комп’ютерної техніки та уніфікованих класифікаційних систем викликає труднощі у визначенні багатьох проблемних питань щодо ліків, наприклад, маркетингу лікарських препаратів (ЛП) на ринку, обсягу оптимального використання ЛП, класифікації їх побічної дії та ін., що вимагає точного визначення дефініцій таких базових термінів, як активний фармацевтичний інгредієнт, лікарська форма, лікарський препарат та лікарський засіб. Враховуючи викладене, на суд фахівців фармацевтичної галузі виноситься перша низка дефініцій базових термінів, які після обговорення їх змісту з метою уточнення будуть внесені до бази даних 2-го видання Фармацевтичної енциклопедії. Перелік дефініцій термінів для обговорення наводиться нижче.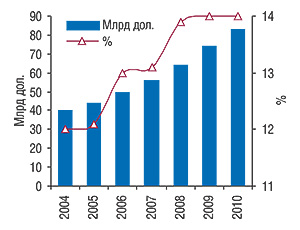
Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим