 У більшості країн основні елементи системи реєстрації препаратів є важливою складовою частиною законодавства про лікарські засоби. Регуляторні органи розвинених країн приймають рішення про необхідність лікарського засобу для національної охорони здоров’я на підставі повної інформації про препарат, яка надається заявником, та оцінки співвідношення користь/ризик при його застосуванні з урахуванням регіональних особливостей та розповсюдження захворювань.
У більшості країн основні елементи системи реєстрації препаратів є важливою складовою частиною законодавства про лікарські засоби. Регуляторні органи розвинених країн приймають рішення про необхідність лікарського засобу для національної охорони здоров’я на підставі повної інформації про препарат, яка надається заявником, та оцінки співвідношення користь/ризик при його застосуванні з урахуванням регіональних особливостей та розповсюдження захворювань.
Спрощена процедура державної реєстрації лікарських засобів, яка запроваджена сьогодні в Україні, зокрема лікарського засобу, призначеного виключно для лікування туберкульозу, ВІЛ/СНІДу, вірусних гепатитів, онкологічних та рідкісних (орфанних) захворювань, який зареєстрований компетентним органом США, Швейцарії, Японії, Австралії, Канади або ЄС, та лікарського засобу, який підлягає закупівлі спеціалізованою організацією, позбавляє від проведення повної оцінки лікарського засобу, який постачається для потреб охорони здоров’я. Це призводить до відсутності знань про цей лікарський засіб. Його безпеку та ефективність гарантує тільки заявник, як правило, представник заявника в Україні — юридична або фізична особа, своїм підписом.
Нагадаємо, що ініціатива щодо спрощеної реєстрації належить Благодійному фонду (БФ) «Пацієнти України». І хоча ця організація позиціонується як пацієнтська, тобто вона об’єднує пацієнтів, а не експертів з питань державної реєстрації лікарських засобів, Кабінет Міністрів, всупереч проголошеному курсу на гармонізацію українського законодавства з вимогами ЄС та здоровому глузду, підтримав одіозну ініціативу.
Основною метою цих інновацій задекларовано прискорення реєстрації лікарських засобів в Україні шляхом анулювання «непрофесійної та корупційної, а, відповідно, зайвої» процедури експертизи матеріалів реєстраційного досьє. Насправді ж запропонована Урядом модель спрощеної реєстрації позбавляє народ України впевненості у ефективності, якості та безпеці ліків.
На хвилі «євроінтеграції» Україна самостійно визнала себе державою, регуляторна система якої у сфері обігу лікарських засобів далека від ідеалу, хоча це не відповіідає висновкам міжнародних експертів. Тому вона (регуляторна система) не повинна брати участь у регулюванні обігу препаратів, а ліки мають постачатися на територію нашої держави лише на підставі надання громадянином нашої країни (представником власника реєстрації — нерезидента) гарантії щодо їх якості, безпеки та ефективності.
Для цього нам навіть не потрібно спілкування ані з самим власником реєстраційного посвідчення (в Україні дозволяється власнику реєстраційного посвідчення бути нерезидентом та спілкуватися з регуляторними органами України через призначеного представника — юридичну або фізичну особу, якій надається доручення), ані з регуляторними органами щодо зареєстрованого там лікарського засобу (Україна не залучена до механізму отримання інформації від регуляторних органів країн, з яких можна завозити препарати без експертизи), хоча деякі урядовці вважають, що Україна має договори про взаємне визнання.
Достатньо, якщо власник реєстраційного посвідчення на лікарський засіб доручить своєму представнику на території України передавати відповідну інформацію щодо його препарату до МОЗ України та у разі, якщо цей представник вважатиме за потрібне таке доручення виконати.
Така спрощена процедура допуску лікарських засобів на ринок будь-якої країни, навіть з нерозвиненою регуляторною системою (для таких країн ВООЗ здійснює програму прекваліфікації лікарських засобів), не застосовується.
Реєстрація лікарських засобів у США, Швейцарії, Японії, Австралії, Канаді, країнах — членах ЄС, які вже були зареєстровані у одному з цих регуляторних органів, не відбувається за заявницьким принципом. Якщо лікарський засіб зареєстрований у США, то для його реєстрації на території ЄС заявник повинен подавати документи відповідно до прийнятої у ЄС процедури.
Так само відбувається, якщо препарат зареєстрований у ЄС, навіть за централізованою процедурою. Для реєстрації його у США або Канаді, або Японії, або Австралії необхідно проходити реєстрацію відповідно до регуляторних вимог даних країн. Тобто з поданням реєстраційного досьє та проходженням експертизи.
На додаток до вже існуючих процедур спрощеної реєстрації лікарських засобів в Україні (Закон України «Про лікарські засоби») Уряд ухвалив постанову КМУ від 20.04.2016 р. № 312 «Про внесення змін до Порядку державної реєстрації (перереєстрації) лікарських засобів», яка передбачає скорочення термінів реєстрації в Україні лікарських засобів, зареєстрованих компетентним органом США, Швейцарії, Японії, Австралії, Канади або ЄС.
Які наслідки отримає Україна від таких інновацій? Багато лікарських засобів змусить зарубіжного виробника знизити ціни. Через існування техніко-економічних обґрунтувань будь-якого виробництва: вартість виробництва + запланований прибуток, навряд чи світова компанія буде постачати в Україну препарати нижче собівартості та навряд чи транспортні витрати, сплата податку на додану вартість (ПДВ), прибуток вітчизняного дистриб’ютора, роздрібні націнки тощо не будуть враховані у їх вартості.
За даними аналітичної системи дослідження ринку «PharmXplorer»/Фармстандарт» компанії «Proxima Research», обсяг фармацевтичного ринку України у натуральному вираженні, починаючи з 2014 р., зменшився з 1,43 млрд упаковок у 2012 р. до 1,21 млрд упаковок у 2014 р. та до 1,10 млрд упаковок у 2015 р. (рис. 1).
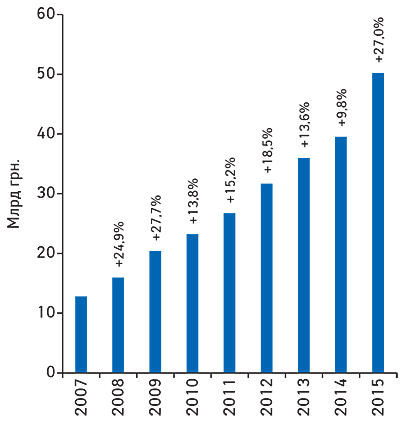
При цьому обсяг реалізованої фармацевтичної продукції у грошовому вираженні у валюті за курсом НБУ, починаючи з 2014 р., різко скоротився — до 3,4 млрд дол. США (падіння зафіксовано на рівні 24,4 % до 2013 р.) (рис. 2).
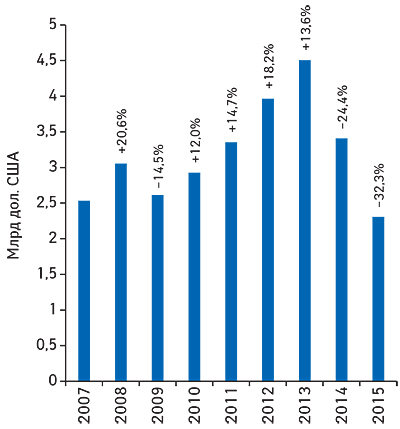
У 2015 р. негативна динаміка збереглася, скорочення обсягів ринку у грошовому еквіваленті в 2015 р. сягнуло 32,3% порівняно з 2014 р.
У роздрібному сегменті частка вітчизняної фармацевтичної продукції у грошовому вираженні в 2015 р. становила 41%, а імпортної — 59%, а в натуральному вираженні вітчизняна та імпортна продукція займає, відповідно, 76,8 та 23,2%.
У госпітальному секторі частка лікарських засобів вітчизняного виробництва у грошовому вираженні в 2015 р. становила 48,8%, імпортного — 51,2%, а в натуральному вираженні (упаковках) — відповідно 89 та 11%.
Середньозважена вартість 1 упаковки лікарського засобу вітчизняного виробництва у 4,8 раза дешевше зарубіжного, у 2015 р. становила відповідно 22,7 та 108,1 грн.
На цінову динаміку лікарських засобів в Україні суттєво впливає курс гривні. За офіційними даними Державної служби статистики України, індекс споживчих цін у жовтні 2015 р. (до грудня попереднього року) становив 139,5%. Індекс зміни курсу гривні до долара США за період січень–жовтень 2015 р. становив 19,1%. Така негативна динаміка є продовженням процесів, що були започатковані у 2014 р.
За даними компанії «Proxima Research», середній індекс зростання цін на лікарські засоби у березні 2016 р. до березня 2015 р. становив 5,2%.
Показовими є іспанської неурядової . Порівнювалися ціни на 14 основних препаратів у 61 країні світу (в основному в країнах, що розвиваються). Дослідження фінансувалися (European Journalism Centre) та Фондом Білла і Мелінди Гейтс.
В Європейському регіоні дані порівнюються для таких країн, як Бельгія, Німеччина, Італія, Молдова, Росія, Іспанія та Україна.
Виходячи з даних, представлених на сайті для Європейського регіону, в Україні — найнижчі ціни практично на всі лікарські засоби, навіть порівняно з Молдовою і Росією, не кажучи вже про Німеччину, Бельгію й Італію.
Щодо зниження цін на препарати в Україні після прискореної появи їх на ринку без перевірки їх безпеки, ефективності та якості можна навести такий приклад.
Після набрання чинності в Україні спрощеної процедури був зареєстрований без проведення експертизи черговий препарат золедронової кислоти, вироблений у Канаді (невідомо, чи маркетується він у Канаді, чи виробляється для інших країн). Це був 21-й препарат золедронової кислоти в Україні (серед них 3 вітчизняних), але вартість інших 20 лікарських засобів не змінилася у менший бік та вартість канадського препарату навряд чи буде нижчою, ніж вартість вітчизняних аналогів.
Якщо ця норма запрацює, пацієнти України ще більше наражатимуться на небезпеку від застосування лікарських засобів з неперевіреними безпекою, ефективністю та якістю, оскільки це відкриває доступ на ринок України усіх без винятку лікарських засобів (на відміну від вже існуючих процедур, які стосувалися лише лікарських засобів для лікування певних захворювань та тих, що закуповуються за державними програмами лікування певних захворювань).
Крім того, у постанові КМУ від 26 травня 2005 р. № 376 «Про затвердження Порядку державної реєстрації (перереєстрації) лікарських засобів і розмірів збору за їх державну реєстрацію (перереєстрацію)» не зазначено, що лікарські засоби мають бути зареєстровані у ЄС за централізованою процедурою. Тобто допуск на ринок може отримати будь-який лікарський засіб, зареєстрований у країні ЄС, навіть за національною процедурою. Але необхідно пам’ятати, що до ЄС входять країни, регуляторні органи яких дуже далекі до їх визнання такими, що застосовують стандарти, рекомендовані ВООЗ.
Так, можна очікувати, що ринок України заполонять будь-які препарати з будь-яким складом, зареєстровані у країнах ЄС, наприклад, препарати із сушених комах, гусениць, рослин, не притаманних для нашого регіону, які схвалені ботанічним інститутом відповідно до національного законодавства.
Яким чином такі лікарські засоби приноситимуть користь пацієнтам України та здешевлять їх витрати на лікування, поки що не дуже зрозуміло. Зрозуміло лише те, що пацієнти лікуватимуться наявними лікарськими засобами, а не тими, у яких є потреба.
Невирішеною залишається проблема фізичної доступності окремих препаратів, яка пов’язана із непривабливістю медичного простору України. Наприклад, це ціла низка життєво необхідних лікарських засобів — антидотів (таблиця).
| Таблиця | Антидотні засоби, що не зареєстровані в Україні (станом на 20.05.2016 р.) |
| Алілнорморфін | |
| Амілнітрит | |
| Аміностигмін | |
| Амріон | |
| Сироватка Антикобра | |
| Сироватка Антигюрза | |
| Апоморфін | |
| Аскорбінат натрію (0,5–1% розчин) | |
| Дантролен | |
| Двовуглекислий амоній (1–3% розчин) | |
| Дигіталіс-антитоксин (80 мг в ампулі) | |
| Діетиксим | |
| Диметиламінофенол | |
| Етимізол | |
| Ізонітрозин | |
| Натрію нітрит (1–3% розчин) | |
| Поліетиленгліколь | |
| Пралідоксим (2-РАМ) | |
| Препарати унітіолу (парентеральні форми) | |
| Протизміїна полівалентна сироватка | |
| Протикаракуртова сироватка | |
| Тримедоксиму бромід | |
| Фізостигмін | |
| Флюмазеніл (0,5 мг/5 мл) | |
| Хлорид амонію (1–3% розчин) | |
| Цитрат магнію (10% розчин) |
Як бачимо, ініціатива Уряду щодо спрощення доступу на ринок України лікарських засобів не має нічого спільного з європейським законодавством, не відповідає українському законодавству та фактично унеможливлює отримання достовірної інформації про лікарський засіб (не потрібне реєстраційне досьє) та здійснення державного контролю якості, ефективності та безпеки препаратів, які вироблятимуться будь-де для експорту в Україну або взагалі для національного ринку країни походження.
Якщо у очах деяких посадовців це виглядає як європейська процедура взаємного визнання, то необхідно чітко усвідомлювати, як відбувається дана процедура.
Заявник подає заяву про реєстрацію та реєстраційне досьє до регуляторного органу «референтної країни». Після проведення експертизи регуляторний орган «референтної країни» приймає рішення про реєстрацію на території країни, складає експертний звіт, затверджує коротку характеристику лікарського засобу (Summary of Product Characteristics — SmPC), текст маркування упаковок.
Після отримання реєстрації на території «референтної країни» заявник може ініціювати реєстрацію даного лікарського засобу в інших країнах — членах ЄС («зацікавлені країни») та повідомляє «референтну країну» про ініціацію реєстрації в інших країнах.
Регуляторний орган «референтної країни» передає до регуляторних органів «зацікавлених країн» експертний звіт з оцінки даного лікарського засобу.
Якщо у регуляторних органів «зацікавлених країн» не виникає питань щодо проведеної оцінки, то лікарський засіб вважається зареєстрованим.
Якщо виникають додаткові запитання, то заявник надає відповіді або запитані додаткові матеріали до регуляторного органу, який зробив запит.
Після цього регуляторний орган «зацікавленої країни» повідомляє «референтну країну» про визнання реєстрації на своїй території.
«Референтна країна» регулярно повідомляє інші країни, у яких визнана реєстрація певного лікарського засобу, про будь-які зміни, внесені заявником до реєстраційного досьє, запобіжні заходи щодо препарату, результати фармаконагляду тощо.
Тобто мова йде про визнання суто між регуляторними органами, а не між МОЗ України та фізичною особою, яка має доручення від заявника та певні документи, які можна отримати з офіційного веб-сайту регуляторного органу, а не обов’язково від заявника, а тим паче регуляторного органу.
Таким чином європейська та українська процедури не мають нічого спільного, й українська не гарантує безпеку та ефективність лікарського засобу.
Між тим робота над спотворенням системи обігу лікарських засобів в Україні, а у перспективі — повним її знищенням, триває й далі. Навколо нових пропозицій щодо відкриття кордонів для фармацевтичної продукції точаться неабиякі баталії. Ініціатори посилаються на вимоги населення надати йому доступ до всього, чим лікуються у світі, навіть якщо це шкодить здоров’ю та загрожує життю. При цьому йде посилання на Конституцію, яка гарантує громадянам право вибору. Але ж цей вибір має бути з достойних пропозицій, а не з «на тобі, Боже, що мені не гоже».
На що можуть очікувати справжні пацієнти України, якими опікується БФ «Пацієнти України», — найзавзятіший ініціатор урядових інновацій у сфері реєстрації лікарських засобів від вже впроваджених до запланованих ініціатив. Ось деякі з ризиків, які вже можна оцінити.
Реєстрація лікарських засобів у США, Австралії, Японії здійснюється для застосування препаратів на території зазначених країн. Якщо зареєстровані у Японії чи Австралії препарати планується виводити на фармацевтичний ринок європейських країн, вони повинні пройти процедуру реєстрації у відповідних регуляторних органах. При цьому заявник повинен надати результати клінічних досліджень, проведених на території Європи. Ця вимога зумовлена тим, що для японців та австралійців застосовуються значно нижчі дози препаратів, які не ефективні для європейців.
Вимога надання результатів клінічних досліджень, проведених на території європейських країн, застосовується і для лікарських засобів, що походять із США. Останнє зумовлено тим, що дози ліків, які застосовуються у США, перевищують такі, що необхідні для європейських пацієнтів.
Процедура, що діє в Україні, не дозволяє перевірити наявність таких досліджень, тобто показання, режими дозування, тривалість лікування будуть непридатними для населення нашої країни, що призведе, у кращому випадку до відсутності ефекту, а у гіршому — до інвалідизації чи зростання смертності, особливо коли йдеться про протипухлинні препарати.
Як приклад можна навести такі лікарські засоби.
Анадин (парацетамол), таблетки
У Великобританії затверджено такий режим прийому: по 1000 мг кожні 4 год (в Україні так само), у США — по 1000 мг кожні 6 год або по 650 мг кожні 4 год.
Таванік (левофлоксацин), таблетки, вкриті оболонкою
У Великобританії затверджено такий режим прийому: по 500 мг на добу протягом 10 днів (так, як в Україні), у США — по 750 мг на добу протягом 5 днів.
Якщо лікарський засіб зареєстрований регуляторним органом США, Швейцарії, Японії, Австралії, Канади або ЄС — це ще не означає, що цей препарат зареєстрований для реалізації на ринку цих країн.
Необхідно зазначити, що у перелічених країнах, як і в багатьох інших країнах світу, реєстрації підлягають усі лікарські засоби, як для використання на території цих країн, так і ті, що виробляються тільки для експорту. Такі препарати виробляються з дешевшої сировини на виробничих потужностях, розташованих у третіх країнах (з більш дешевою робочою силою) та не підлягають суворому контролю з боку суворих регуляторних органів країн, де знаходиться заявник.
На такі лікарські засоби регуляторним органом видається сертифікат фармацевтичного продукту (який в Україні приймається як підтвердження реєстрації у країні виробника) для експорту.
Наприклад, на виробничій дільниці, яка знаходиться в будь-якій країні світу, але належить резиденту країни — члена ЄС, вироблятимуться лікарські засоби, призначені лише для експорту в треті країні, в тому числі й Україну.
При цьому діючим законодавством України передбачено, що такі препарати можуть реєструватися за спрощеною процедурою.
Перелік документів для спрощеної реєстрації не вимагає надання даних щодо системи фармаконагляду власника реєстраційного посвідчення та щодо наявності уповноваженої/контактної особи з фармаконагляду в Україні.
Це означає, що лікарські засоби, що потрапляють на фармацевтичний ринок України за такими процедурами, покинуті напризволяще. Тобто після їх реєстрації заявник не здійснює адекватного нагляду за безпекою препарату та не надає документів, що підтверджують здійснення моніторингу безпеки та ефективності зареєстрованих у такий спосіб препаратів, а саме: планів управління ризиками, доповнень до клінічного огляду, регулярно оновлюваних звітів з безпеки.
Спрощена нанівець процедура реєстрації не передбачає, щоб заявник проводив та надавав оцінку співвідношення користь/ризик, а також вносив зміни до матеріалів досьє у разі появи нових застережень, пов’язаних із виявленими проблемами безпеки. Безпеку та ефективність таких препаратів гарантує держава на рівні Закону України «Про лікарські засоби». Але наразі держава звільнила власника реєстраційного посвідчення від цих обов’язкових функцій.
А відповідальність за негативні наслідки також нестиме держава?
Нижче наведені декілька прикладів з метою нагадування про ті трагедії, які сталися у світовому масштабі через нерозуміння необхідності здійснення фармаконагляду, а також приклади, коли своєчасно вжиті заходи попередили ймовірність їх виникнення.
Талідомід. Трагедія, що пов’язана із застосуванням талідоміду (1957–1961 рр.), ніколи не повинна забуватися людством.
Всередині 1950-х років таблетки талідоміду надійшли в продаж у країнах Західної Європи під торговою маркою Контерган. Крім нього, на західноєвропейському ринку з’явилися препарати, що містять талідомід в комбінації з іншими речовинами, — ацетилсаліциловою кислотою, хініном, фенацетином — для лікування риніту, бронхіальної астми, мігрені та підвищеної збудливості.
Препарати талідоміду користувалися високим попитом і швидко завоювали ринки. У результаті багато фармацевтичних компаній Великобританії, Канади, Японії та ряду інших країн придбали права на продаж та реалізацію препаратів, що містять талідомід. В інструкції щодо застосування, а також в рекламі талідоміду особлива увага приділялася відсутності токсичності. Тому талідомід рекомендували вагітним як заспокійливий, снодійний та антидепресивний препарат. Майбутні мами були в захваті від нових ліків: прийом талідоміду надавав їм можливість легко й приємно спати, ефективно усував нервозність і тривогу. Однак після народження довгоочікуваної й бажаної дитини багато жінок про безтурботний сон забули. Деякі — назавжди.
З середини 1959 р. від лікарів Німеччини (і не тільки) почали надходити відомості про випадки периферичної нейропатії у дорослих пацієнтів: парестезії, оніміння пальців рук. Більшість хворих відчували надзвичайно сильний м’язовий біль і судоми, слабкість в суглобах, у них виявляли порушення координації рухів, судомні посмикування м’язів обличчя, утруднення мови і двоїння в очах. Приблизно в цей самий час англійські медики повідомили про декілька десятків випадків поліневриту.
У жовтні 1960 р. на конгресі педіатрів, який відбувся в Мюнхені, були продемонстровані новонароджені немовлята з вадою розвитку, з якою вчені і лікарі ніколи раніше не стикалися. Ця патологія отримала назву «фокомелія», — аномальний розвиток проксимальних відділів кінцівок (від грец. Phoke — тюлень, melos — кінцівки). Було висловлено припущення, що цю ваду розвитку міг спричинений новий препарат.
Тільки в Німеччині із зміненими кінцівками народилося понад 10 тис. дітей. Ноги і руки у них або були відсутні взагалі, або являли собою щось схоже на тюленячі ласти. Загальна кількість маленьких жертв талідоміду (а незабаром було доведено, що саме цей препарат став причиною появи дітей із названими аномаліями) налічувала понад 30 тис.
Як з’ясувалося, талідомід є найсильнішим тератогеном (від грец. Teras — рід, teratos — чудовисько, потвора), який, порушуючи процес ембріонального розвитку, викликає формування аномалій у плода. Він негативно впливає не лише на розвиток кінцівок, але й на зоровий і слуховий аналізатори, травну і сечостатеву системи. Навіть одноразового застосування талідоміду досить для ураження плода.
Через рік лікарські засоби, що містять талідомід, було вилучено з продажу на території Німеччини. Міністерство охорони здоров’я Західної Німеччини зробило заяву про те, що Контерган є основним чинником, що викликає фокомелію. Практично одразу після цього повідомлення талідомід був вилучений з продажу й в інших країнах.
Диетилстілбестрол. Французькі дослідники встановили, що побічні реакції деяких препаратів можуть виявлятися навіть у третьому поколінні. З’ясувалося, що препарат диетилстілбестрол (DES), що часто призначався вагітним до 1970 р., викликає серйозні аномалії вже у їхніх онуків.
Препарат DES є синтетичним аналогом жіночого статевого гормону естрогену. Протягом майже 30 років в період 1940–1970 рр. він користувався популярністю, і лікарі часто призначали його вагітним для полегшення перебігу вагітності. Вважалося, що DES значно знижує ризик викидня і передчасних пологів.
У вказаний період у країнах Західної Європи і США DES був призначений не менше ніж 6 млн пацієнток.
Однак поступово накопичувалися тривожні дані, які свідчили про те, що «звичайний» препарат загрожує такою страшною побічною реакцією, як рак піхви у плода жіночої статі. При цьому злоякісна пухлина виникала ще в період внутрішньоутробного розвитку дитини.
Крім того, дівчатка, народжені від матерів, які приймали DES у період вагітності, часто народжувалися з іншими дефектами, а згодом самі не могли стати матерями.
З цієї причини ще 40 років тому DES був заборонений до застосування.
Однак препарат знову нагадав про себе грізним відлунням далекого минулого. Група французьких вчених з Університету Монпельє (Universite Montpellie) під керівництвом професора Нікола Калфа (Nicolas Kalfa) виявила, що хлопчики, які народжуються нині у жінок, чиї матері свого часу під час вагітності приймали DES, набагато частіше з’являються на світ з гіпоспадією — серйозною вадою розвитку статевого члена, що характеризується неправильним розташуванням сечівника. Такий дефект був виявлений у 8% хлопчиків з цієї специфічної групи, що набагато вище за середні показники.
Тіоацетазон. Серед дітей та дорослих з ВІЛ-інфекцією та туберкульозом був виявлений високий рівень летальності при застосуванні схем лікування, що містили тіоацетазон (1980–1990 рр.). Оцінка ВООЗ наявної інформації призвела до вилучення цього препарату із схем першої лінії комбінованого лікування і переведення його у статус резервного препарату.
Церивастатин був введений у клінічну практику в 1997 р. у якості лікарського засобу, що регулює вміст ліпідів. До 2000 р. у Центр співпраці ВООЗ з міжнародного моніторингу лікарських засобів в Уппсалі (Швеція) надійшла інформація про 549 випадків гострого некрозу скелетних м’язів, пов’язаного із застосуванням церивастатину. Згодом було поширено попередження про те, що церивастатин викликає міопатію та гострий некроз скелетних м’язів.
У листопаді 1999 р. в США й у березні 2000 р. в Канаді до інструкції щодо цього препарату було включено протипоказання — заборона одночасного застосування церивастатинй й гемфіброзилу (іншого лікарського засобу, що регулює вміст ліпідів).
Аналогічні заходи проведені й в Австралії в лютому 2001 р. Зокрема, для лікарів було поширено попередження про можливість розвитку гострого некрозу скелетних м’язів при прийомі препаратів з групи статинів.
У червні 2001 р. вжиті відповідні заходи в масштабі всієї Європи із зазначенням протипоказань щодо комбінованого застосування церивастатину й гемфіброзилу. 8 серпня того ж року компанія-виробник церивастатину вилучила його з продажу.
Аристолохія. Використання елементів рослини аристолохія, що містить аристолохову кислоту, підвищує ризик виникнення раку нирки у зв’язку із властивостями цієї речовини спричинювати генні мутації. Ця рослина є дуже токсичною для нирок. При цьому вона широко застосовується у традиційній китайській медицині, міститься у таблетках для зменшення маси тіла у Бельгії.
Таких прикладів, на жаль, є дуже багато. Дієвим інструментом, що мінімізує несприятливі, а іноді трагічні наслідки застосування лікарських засобів, є здійснення фармаконагляду. Інформацію щодо результатів фармаконагляду в Україні можна отримати за наступним посиланням: .
Що стосується препаратів, які надійдуть на ринок України за запропонованою Урядом спрощеною процедурою, то виникає питання — хто наглядатиме за їх безпекою та ефективністю на території нашої країни та хто вживатиме заходів з мінімізації ризиків внаслідок їх застосування?
Інформація щодо застосування лікарських засобів надається представником власника реєстраційного посвідчення та не підлягає оцінці.
Тобто інструкція містить тільки інформацію, затверджену регуляторним органом країни походження, без урахування регіональних та етнічних особливостей нашої держави. Не усі показання, притаманні жителям країн Азії, а також США, Канади, Австралії тощо, підходять для українців, тож потреба населення у певних препаратах сумнівна.
Крім того, не береться до уваги стан вітчизняної системи охорони здоров’я, наприклад, відсутність державної програми профілактичних оглядів населення. Тобто жителі України не володіють інформацією про наявні у них захворювання, якщо симптоми відсутні.
Так, у розвинених країнах управління ризиками для нових молекул зводиться до попередження медичного працівника не застосовувати або застосовувати з обережністю препарат при певних супутніх захворюваннях, а в Україні це попередження має носити характер «пацієнт повинен пройти обстеження».
Хто буде за цим слідкувати, якщо відсутня експертиза?
Тобто ця спрощена процедура, напевно, принесе прибуток тільки її ініціаторам (винагороду від власників препаратів) через надання змоги зарубіжним виробникам отримати великий ринок збуту своєї продукції без докладання жодних зусиль та витрат з їх боку, а також звільнення їх від відповідальності за негативні наслідки від застосування цих лікарських засобів.
Крім того, спрощений доступ лікарських засобів на ринок України, які походять із зарубіжних країн, особливо нових молекул, без експертизи матеріалів реєстраційного досьє дасть змогу заявникам проводити на території України постмаркетингові клінічні дослідження, особливо якщо такі дослідження проводилися лише за участю пацієнтів певних етнічних груп, результати яких не можуть бути придатними для населення нашої країни.
Таку ситуацію Україна вже має. Програмою розвитку ООН (ПРООН) закуплено для України вакцину для профілактики гемофільної інфекції типу b виробництва Serum Institute of India Private Ltd., Індія, яка була зареєстрована в Україні без проведення експертизи.
Досвід застосування даної вакцини у монодозній формі у світі є вкрай незначним. Згідно з даними, опублікованими на сайті ПРООН, на сьогодні Serum Institute of India Private Ltd. поставила всього лише 172 тис. доз такої вакцини у 26 країн світу. Незважаючи на те, що в якості однієї зі складових п’ятивалентного препарату Нib компонент застосовувався більше ніж у 457 млн доз п’ятивалентної вакцини, це не дає об’єктивних підстав вважати, що показники імуногенності, реактогенності та епідеміологічної ефективності багатокомпонентної вакцини можна екстраполювати на такі у моновакцини.
Тобто у даній ситуації Україна буде виступати як клінічна база для збору виробником (інших можливостей він не має через обережність провідних країн) інформації щодо ефективності та безпеки даної вакцини. Причому виробник не несе жодних витрат на дослідження, а навпаки, отримав бюджетні кошти України за її реалізацію.
Як компроміс для надходження на ринок необхідних для пацієнтів України лікарських засобів можна прийняти запропонований у проекті Закону України «Про лікарські засоби» від 15.04.2016 р. № 2162-д механізм, відповідно до якого «за спрощеною процедурою здійснюється державна реєстрація лікарського засобу, що містить діючу речовину, відсутню в Державному реєстрі лікарських засобів України, який зареєстрований компетентним органом США, Швейцарії, Австралії, Канади або країн ЄС, внесений до настанов щодо лікування або формуляра цих країн». Тобто спростити доступ в Україну для відсутніх на ринку лікарських засобів із визнаною ефективністю для лікування певних захворювань (включених до протоколів лікування).
Але й тут необхідно бути обережними та не відмовлятися повністю від експертизи реєстраційних досьє. Для цих препаратів можна запропонувати застосовувати процедуру експертизи, яка вже декілька років діє в Україні (визначена пунктом 10 наказу МОЗ України від 09.09.2005 р. № 460).
За цією процедурою експертиза реєстраційних досьє здійснюється позачергово та терміни експертизи не перевищують 45 робочих днів (по факту не більше 30 робочих днів). Цей час не призведе до значних затримок для появи лікарського засобу в Україні, проте інструкція для медичного застосування буде повністю відповідати вимогам до його безпеки та ефективності з урахуванням регіональних та етнічних особливостей. В іншому разі будуть виникати ситуації, наведені у прикладах вище.
Прес-служба «Щотижневика АПТЕКА»

Коментарі