|
В Украине регуляторным органом, на который возложен надзор за побочными реакциями (ПР) ЛС, является Государственный фармакологический центр (ГФЦ) МЗ Украины, его подразделение — отдел фармакологического надзора.
Для организации и контроля за осуществлением ФН в Украине во всех регионах были созданы 14 региональных отделений (РО), входящих в структуру отдела фармакологического надзора ГФЦ МЗ Украины.
Сегодня в составе РО работают 72 специалиста: фармакологи, врачи, а также главные внештатные специалисты по специальности «терапия» главных управлений здравоохранения (ГУЗ) городских и областных государственных администраций (ОГА).
Хотелось бы отметить неоценимую роль сотрудников РО в проведении образовательной, консультативно-методической и просветительской деятельности по вопросам безопасности ЛС среди врачей на региональном уровне, а также их взаимодействие с УЗ областных и городских госадминистраций по вопросам функционирования системы ФН в регионах.
Уровень развития национальной системы контроля за безопасностью ЛС зависит от количества и качества информации о ПР ЛС, получаемой из разных источников с помощью различных методов.
Согласно нормативным документам (приказ МЗ Украины от 27.12.2006 г. № 898) в информировании о ПР ЛС задействованы врачи, руководители лечебно-профилактических учреждений (ЛПУ), главные специалисты, а также производители ЛС (или их представители).
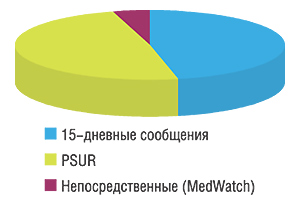
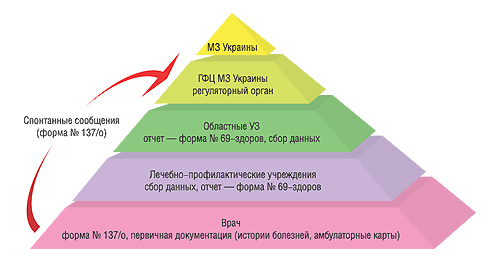
В развитых странах мира производитель ЛС является непосредственным и основным участником информирования о ПР ЛС в системе фармаконадзора. В США в 2006 г. из 471 679 сообщений о подозреваемых побочных реакциях ЛС, поступивших в Центр по оценке и исследованиям лекарственных средств (Center for Drug Evaluation and Research — CDER) Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administrаtion — FDA), только 4% поступили непосредственно от специалистов здравоохранения и пациентов, а остальные 96% — от производителей ЛС* (рис. 1). В Украине производители ЛС (и их представители) только начинают делать первые шаги в формировании системы ФН на производствах и в представительствах. По реальным оценкам, учитывая нюансы ее развития, вероятнее всего, результаты такой деятельности будут ощутимы к 2011–2012 гг. Сегодня можно утверждать, что в Украине к началу второго десятилетия XXI в. именно врач по-прежнему будет вносить основной вклад в получение данных о безопасности ЛС при их медицинском применении. По состоянию на 01.01.2008 г. банк данных о ПР ЛС в Украине составляет более 22 500 сообщений, поступивших от врачей. Алгоритм поступления карт-сообщений о ПР ЛС от врача представлен на рис. 2.
|
|
При возникновении ПР ЛС врач заполняет форму № 137/о (карта спонтанного сообщения о ПР ЛС) и направляет ее в отдел фармакологического надзора ГФЦ МЗ Украины (в случае несерьезной ПР — в течение 15 дней, серьезной — в течение 48 ч), при этом копия карты остается в ЛПУ (у ответственного за ФН) для составления годовой отчетности по форме № 69-здоров.
Отметим, что, сообщая о ПР ЛС, врач не обязательно должен быть уверен в наличии причинно-следственной связи между приемом препарата и возникновением ПР — достаточно и подозрения на такую связь.
В Украине, как и во всем мире, предоставленная врачом информация о ПР ЛС является строго конфиденциальной, и врач не преследуется и не наказывается за ее предоставление. Тем не менее именно наказания за сообщение о ПР ЛС безосновательно остерегаются врачи, что ведет к значительному уменьшению информирования регуляторных органов о возникших ПР при медицинском применении ЛС. Нам бы хотелось сделать акцент на том, что даже если при анализе полученной информации становится ясно, что ПР произошла в результате врачебной ошибки, то ни при каких обстоятельствах этот факт не наказуем и не предается огласке. Данные о ПР, возникших в результате медицинских ошибок, публикуются в обобщенном виде во избежание их дальнейшего повторения.
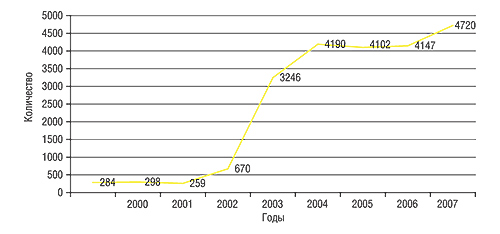
По данным 2006 г. в Украине лишь 6,8% врачей информируют регуляторные органы о возникновении ПР при медицинском применении ЛС (рис. 3). Это может быть связано с особенностями ментальности большинства врачей, а именно с непониманием важности осуществления контроля за безопасностью ЛС, со страхом ответственности со стороны врача за предоставленную информацию, зависимостью от административных решений руководства ЛПУ.
|
В недостаточном привлечении врачей в процесс осуществления ФН непоследнюю роль играет также и ошибочное мнение врача о том, что на заполнение карты-сообщения требуется «огромное» количество времени, как и отсутствие «обратной связи» между врачом и регуляторным органом. Насколько же объективны эти утверждения?
Карта-сообщение о ПР ЛС состоит из 6 разделов, содержащих 30 пунктов. При заполнении таких из них, как: последствия ПР; продолжается ли ПР; категория ПР; получал ли больной подозреваемое ЛС ранее; если да, то какие ПР возникали; средства коррекции ПР; причинно-следственная связь между ПР и подозреваемым ЛС — врачу следует поставить лишь отметку, например галочку или знак «+».
Немного времени требуется и на то, чтобы написать инициалы больного, номер истории болезни/амбулаторной карты, обозначить пол пациента буквой М или Ж, указать клинический диагноз (с шифром по МКБ-10), данные лабораторно-инструментальных исследований, анамнеза, которые могли повлиять на возникновение ПР.
Что же касается ПР, то указывается дата ее возникновения, окончания и описывается сама ПР. Относительно подозреваемого ЛС записывают его торговое название, лекарственную форму, производителя, страну, показание к назначению, разовую дозу, кратность приема, способ введения, дату начала терапии подозреваемым ЛС. В пункте «Данные о ЛС, которые принимал пациент одновременно с подозреваемым ЛС» отображают информацию об их торговом названии, разовой дозе, кратности приема, способе введения, дате начала и окончания терапии. Затем указывается Ф.И.О. уведомителя, контактный телефон, название и местонахождение ЛПУ, где работает врач.
Таким образом, на заполнение карты-сообщения о ПР ЛС необходимо в среднем 10–15 мин.
Следует отметить, что форма № 137/о полностью соответствует той, которая рекомендована ВОЗ и используется во всем мире для информирования регуляторных органов о неблагоприятных последствиях применения ЛС.
Заполнив карту о ПР ЛС, врач должен отправить ее непосредственно в ГФЦ МЗ Украины. Однако эта информация зачастую первично направляется в РО ГФЦ МЗ Украины. Последнее, к сожалению, приводит к поступлению данных о выявленных случаях ПР ЛС в ГФЦ МЗ Украины со значительным опозданием, что не позволяет своевременно реагировать на те или иные ситуации, связанные с безопасностью применения ЛС, зарегистрированных в Украине. В связи с этим отметим, что основной задачей сотрудников РО (согласно приказу № 898) является организация и контроль за осуществлением ФН в Украине при поддержке руководителей всех звеньев здравоохранения и врачей учреждений здравоохранения независимо от подчинения и форм собственности, производителей/заявителей (или их представителей), руководителей и работников Государственной инспекции по контролю качества лекарственных средств, а также образовательная и просветительская деятельность. Такая работа РО и в дальнейшем будет способствовать увеличению своевременного поступления сообщений о ПР ЛС от врачей в ГФЦ МЗ Украины.
Конечно, как и в любой пионерской деятельности, в осуществлении ФН еще есть нерешенные вопросы, недостатки, упущения, проблемы, решение которых должно происходить как на отраслевом уровне, так и в рамках деятельности ГФЦ МЗ Украины, самого отдела фармакологического надзора.
Анализируя критические замечания, которые звучат в адрес тех, кто осуществляет и координирует ФН в Украине, хотим отметить, что организация и качество этой деятельности, умение донести информацию о необходимости проведения контроля за безопасностью ЛС в Украине в разных регионах неодинаковы. По-разному относятся к ФН в представительствах и на производствах, порой безосновательно уверяя всех, и даже регуляторные органы, в том, что это временное явление.
К сожалению, сотрудникам системы ФН приходится сталкиваться с непониманием, безразличием и пренебрежительным отношением к вопросам контроля за безопасностью ЛС со стороны организаторов системы здравоохранения Украины. Однако результаты осуществления контроля за безопасностью ЛС свидетельствуют о том, что система ФН в Украине функционирует и развивается. С одной стороны, подтверждением этого является динамика поступления карт-сообщений от врачей (см. рис. 3), а с другой — регуляторные решения относительно медицинского применения и оборота ЛС в Украине на основании анализа полученной информации о ПР ЛС (таблица).
Таблица
Некоторые группы или отдельные ЛС, относительно оборота или медицинского применения которых в Украине приняты соответствующие регуляторные решения
|
Год |
Название |
Решение |
| 1996 |
Фенацетин |
Запрещено медицинское применение |
|
1996 |
Циметидин |
Запрещено медицинское применение |
|
1999 |
Гемодез |
Запрещено медицинское применение |
|
2001 |
Фенилбутазон |
Ограничено медицинское применение |
|
2002 |
Гентамицин |
Ограничено медицинское применение: – ограничение возраста детей, которым назначают эти ЛС, до 3 лет. Детям до 3 лет гентамицин назначается исключительно по жизненным показаниям в дозе 6,0–7,5 мг/кг массы тела в сутки по 2,0–2,5 мг/кг массы тела через каждые 8 ч; – дополнен раздел «Противопоказания»: «Выраженные нарушения почек и слухового аппарата, повышенная чувствительность микроорганизмов к гентамицину или иным аминогликозидным антибиотикам»; – указаны меры предосторожности и контроля функции почек и слуха во время применения гентамицина: «При длительном применении доза препарата должна быть такой, которая бы обеспечивала концентрацию гентамицина в крови, не превышающую максимально допустимую (12 мг/мл), для чего необходимо осуществлять ее контроль в крови больного»; – в разделе «Особенности применения» обращено внимание на то, что ототоксичность увеличивается при обезвоживании организма и у лиц пожилого и старческого возраста, в связи с чем необходимо, чтобы пациент получал достаточное количество жидкости. В случае развития резистентности, антибиотик необходимо отменить и назначить другую адекватную терапию |
|
2003 |
Нитрофурал (фурацилин) |
Запрещено медицинское применение таблетированных форм перорально |
|
2003 |
Нитрофураны |
Ограничено медицинское применение |
|
2003 |
Препараты, содержащие кава-кава |
Запрещено медицинское применение |
|
2003 |
Дезинтоксикационные растворы, содержащие низкомолекулярный поливинилпирролидон |
Ограничено медицинское применение |
|
2005 |
Метамизол натрия (анальгин) |
Ограничено медицинское применение: – ограничения возраста детей при его назначении в таблетированной форме — до 12 лет; – указаны группы пациентов, у которых возможен риск развития ПР (с отягощенным аллергологическим анамнезом, заболеваниями крови, нарушениями функции печени и почек); – длительность непрерывного применения этих препаратов — не более 3 сут для всех возрастных групп (в средней терапевтической дозе для взрослых 0,5–1,0 г) |
|
2005 |
Рофекоксиб |
Ограничено медицинское применение: – ограничена максимальная суточная доза (не более 50 мг в сутки); – противопоказания к применению: лица с повышенным риском со стороны сердечно-сосудистой системы (перенесенным инфарктом, инсультом, прогрессирующими клиническими формами атеросклероза); возраст старше 65 лет |
|
2006 |
Тиоридазин (сонапакс, ридазин) |
Ограничено медицинское применение: – ограничена максимальная суточная доза (не более 300 мг в сутки) – показания к применению: пограничные психические состояния, психоневротические состояния, расстройства психики алкогольного генеза |
|
2006 |
Эуфиллин |
Запрещено медицинское применение лекарственных форм, содержащих стабилизатор этилендиамин |
|
2007 |
Нимесулид |
Ограничено медицинское применение: – запрещено использование у детей до 12 лет; – показания к применению: острая боль, симптоматическое лечение болевого остеоартрита, первичная дисменорея; – противопоказания: пациенты с повышенной температурой тела и гриппоподобными симптомами; – особые меры предосторожности: при повышении температуры тела и появлении гриппоподобных симптомов у больных, получающих нимесулид, следует прекратить прием препарата |
|
2007 |
Озельтамивир |
Внесены изменения в инструкцию, касающиеся потенциального риска возникновения нейропсихических расстройств на фоне применения озельтамивира, особенно у детей |
Среди основных направлений осуществления ФН чрезвычайно важное значение имеет информационное обеспечение врачей, руководителей здравоохранения, фармацевтов, провизоров, производителей ЛС, населения.
За последние несколько десятилетий значительно расширился и обогатился фармацевтический рынок Украины. Появляется все больше ЛС, высокая эффективность которых нивелируется проблемами безопасности. Именно вопросы безопасного применения ЛС перешагнули границы медицины и все более и более находятся в центре публичных интересов общества. Известен тот биологический, социально-экономический ущерб, который наносит обществу нерациональное использование ЛС. Поэтому врач должен быть вооружен знаниями о свойствах ЛС, черпая их из справочников, учебников и руководств. Врач должен ориентироваться в реальной современной ситуации, которая возникает в мире, в Украине, в регионе, где он живет, в ЛПУ, где он работает, и получать современное своевременное и объективное представление относительно безопасности применения препаратов, порой вопреки имеющимся классическим взглядам на то или иное ЛС, что требует постоянного информационного обеспечения.
В последнее время в адрес регуляторных органов, осуществляющих контроль за безопасностью ЛС в Украине, высказывают претензии, что врачи недостаточно информированы о том, что же происходит в этом направлении, как обстоят дела с выявлением негативных свойств ЛС при их медицинском применении, каковы последующие действия регуляторных органов в отношении дальнейшего медицинского применения опасных ЛС.
Хотелось бы отметить, что вся информация о ПР ЛС, которая поступает в отдел фармакологического надзора, анализируется, обобщается и публикуется как в центральных специализированных медицинских и фармацевтических изданиях, так и в региональных информационных изданиях. Отдел фармакологического надзора практически с момента своего основания старается сделать эту информацию достоянием максимального количества специалистов различного профиля. С 1996 г. количество публикаций, посвященных вопросам безопасности ЛС при их медицинском применении, постоянно растет.
Где же можно ознакомиться с результатами проведенной работы в осуществлении ФН?
Лишь за истекший 2007 г. сотрудниками отдела фармакологического надзора были опубликованы более 40 статей в профильных медицинских журналах и газетах. Данные о безопасном применении ЛС были представлены в материалах и тезисах научных конгрессов, съездов и конференций, проведенных в Украине и странах СНГ (Россия, Казахстан) в 2007 г.
Хотелось бы отметить, что в 2007 г. впервые в истории нашего государства МЗ Украины, АМН Украины, ГФЦ МЗ Украины, международной общественной организацией «Международный фонд клинических исследований» была организована и проведена Первая научно-практическая конференция «Безопасность лекарств: от разработки до медицинского применения» (Киев, 31 мая — 1 июня).
В ходе работы конференции были обсуждены различные организационные и методические проблемы, связанные с безопасностью ЛС, состоянием и перспективами системы ФН и клинических испытаний; обозначена роль регуляторных органов, производителей ЛС и врачей в осуществлении контроля за безопасностью препаратов, обсуждены вопросы своевременности принятия соответствующих регуляторных решений, обучения врачей и провизоров, а также подготовки специалистов в сфере ФН; этико-правовые аспекты осуществления ФН. Также был представлен глубокий научный анализ особенностей развития и течения ПР ЛС, рассматривались методы изучения, профилактики, лечения ПР ЛС, их фармакоэкономической оценки.
Эта конференция привлекла внимание представителей ВОЗ, сотрудников регуляторных органов Украины и стран СНГ (Беларуси, Казахстана, Кыргызстана, Молдовы, России, Узбекистана), представителей практического здравоохранения, провизоров, руководителей органов УЗ, ведущих ученых научно-исследовательских институтов, преподавателей медицинских и фармацевтических вузов, производителей ЛС. Предполагается, что этот форум станет традиционным и будет проводиться регулярно 1 раз в два года. Надеемся, что он будет иметь более активную поддержку со стороны МЗ и АМН Украины.
К проведению этой конференции было приурочено издание первого отечественного руководства по ФН: «Безопасность лекарств. Руководство по фармаконадзору» под редакцией А.П. Викторова, В.И. Мальцева, Ю.Б. Белоусова (МОРИОН, 2007), которое поможет производителям ЛС, практикующим врачам всех специальностей, провизорам, фармацевтам, а также научным работникам, преподавателям и студентам медицинских и фармацевтических вузов более профессионально подойти к вопросам контроля за безопасностью ЛС.
В 2007 г. сотрудниками отдела фармакологического надзора подготовлены и изданы методические рекомендации «Принципи складання та порядок подання виробником інформації про побічні реакції лікарського засобу», утвержденные ГФЦ МЗ Украины. Кроме того, в таких масс-медийных изданиях, как газеты «День», «Комсомольская правда», «Факты», «Сегодня», «24» в течение 2007 г. были опубликованы интервью, связанные с проблемами безопасного применения ЛС. На разных каналах украинского телевидения сотрудники отдела фармакологического надзора приняли участие в ряде передач, где освещались вопросы, связанные с безопасностью ЛС.
На протяжении 2007 г. сотрудники отдела выступили с 34 докладами на различных конгрессах, съездах, конференциях, семинарах, коллегиях ГУЗ ОГА и тренингах перед врачами различных специальностей, фармацевтами, провизорами, сотрудниками фармацевтических компаний.
Проведенный 13–14 декабря 2007 г. семинар ГФЦ МЗ Украины «Современное состояние и перспективы процедуры регистрации и перерегистрации лекарственных средств в Украине» осветил вопросы осуществления ФН в Украине производителями ЛС и их представителями.
В выступлениях и публикациях сотрудниками отдела фармакологического надзора также постоянно освещаются результаты анализа сообщений о ПР, возникших при медицинском применении ЛС в Украине, вопросы классификации и механизмов развития ПР, влияния полиморбидности, полипрагмазии на их возникновение, проблемы медикаментозной аллергии, системных проявлений ПР со стороны различных органов и систем, а также частные вопросы контроля за безопасностью как фармакологических групп ЛС (анальгетиков-антипиретиков, нитрофуранов, ингибиторов АПФ, антагонистов кальция, блокаторов β-адренорецепторов, нестероидных противовоспалительных препаратов, антигистаминных, антибактериальных ЛС), так и отдельных препаратов: эналаприла, мелоксикама, нимесулида, ацетилсалициловой кислоты, тиамина, рофекоксиба, альфа-липовой кислоты, диклофенака, никотиновой и аскорбиновой кислоты.
Кроме того, на офицальном сайте ГФЦ МЗ Украины представлена информация о деятельности ГФЦ МЗ в осуществлении контроля за безопасностью применения ЛС в Украине и принятых регуляторных решениях. Любой медицинский и фармацевтический работник, производители ЛС и их представители в случае необходимости могут воспользоваться этой информацией.
Учитывая вышеизложенное, утверждение о том, что отсутствует «обратная связь» между врачом, информирующем о ПР ЛС, и регуляторным органом, как и утверждение о том, что никто ничего не знает относительно безопасности ЛС при их медицинском применении в Украине, потому что об этом нигде не сообщается, не имеют объективного основания.
В заключение отметим, что только активная позиция врача и производителя в информировании ГФЦ МЗ Украины о ПР ЛС при их медицинском применении будет способствовать оперативному анализу полученных данных, своевременному принятию соответствующих регуляторных решений с последующим информированием об этом врача, провизора, производителя ЛС на страницах специализированных медицинских изданий. n
*В виде сообщений, подаваемых в 15-дневный срок (производитель обязан сообщить обо всех серьезных и непредвиденных побочных явлениях как можно скорее, но не позднее чем через 15 дней после выявления проблемы), и регулярно обновляемых отчетов по безопасности (Periodic Safety Update Report — PSUR).
А.П. Викторов, Е.В. Матвеева, И.А. Логвина,
В.П. Яйченя (ГФЦ МЗ Украины), Д.С. Полякова

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим