 «SIGA Technologies, Inc.» (Велика Британія) оголосила 10 січня, що Європейське агентство з лікарських засобів (European Medicines Agency — EMA) схвалило заявку SIGA на маркетинг препарату тековирімату для перорального застосування. У липні 2018 р. під торговою маркою TPOXX® він був схвалений Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA). Наприкінці 2021 р. (1 грудня) SIGA оголосила, що TPOXX також схвалений Health Canada. Препарат призначений для лікування ортопоксвірусних інфекцій (натуральна, мавпяча, коров’яча віспа та ускладнення вакцинації).
«SIGA Technologies, Inc.» (Велика Британія) оголосила 10 січня, що Європейське агентство з лікарських засобів (European Medicines Agency — EMA) схвалило заявку SIGA на маркетинг препарату тековирімату для перорального застосування. У липні 2018 р. під торговою маркою TPOXX® він був схвалений Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA). Наприкінці 2021 р. (1 грудня) SIGA оголосила, що TPOXX також схвалений Health Canada. Препарат призначений для лікування ортопоксвірусних інфекцій (натуральна, мавпяча, коров’яча віспа та ускладнення вакцинації).
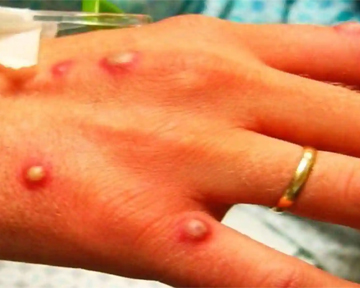
Ліквідація віспи, координована ВООЗ і сертифікована 40 років тому, привела до припинення рутинної вакцинації в більшості країн. Підраховано, що понад 70% населення світу більше не захищені від натуральної віспи, а також близькоспоріднених ортопоксвірусів, таких як мавпяча — інфекція, що відроджується (re-emerging disease). Зокрема, у 2018–2019 рр. відбувся експорт віспи мавп з Нігерії до Великобританії, Ізраїлю та Сінгапуру. Припускають, що це захворювання може заповнити епідеміологічну нішу, що звільнена натуральною віспою*.
Заявку в ЕМА було подано в рамках централізованого процесу, який дозволяє маркетинг, включаючи закупівлю для створення запасів, у всіх країнах — членах Європейського Союзу (ЄС), а також у Норвегії, Ісландії та Ліхтенштейні. У червні 2019 р. SIGA уклала міжнародну угоду про просування з Meridian Medical Technologies, Inc., що сприятиме продажу перорального тековирімату на всіх міжнародних ринках за межами Сполучених Штатів.
«Пандемія COVID-19, що триває, підкреслила важливість готовності, що забезпечують уряди в усьому світі, створюючи надійні запаси для підтримання ефективної відповіді на спалахи інфекційних захворювань, таких як віспа, та значну загрозу біотероризму, яка може бути ще більш руйнівною, ніж COVID-19, — зазначив Філ Гомес (Phil Gomez), генеральний директор SIGA. — Схвалення EMA є важливим кроком у нашій міжнародній стратегії, спрямованій на забезпечення доступності тековирімату на європейському ринку та за його межами».
Препарат з орфанним статусом буде доступний у вигляді твердих капсул по 200 мг для застосування у дорослих та дітей з масою тіла не менше 13 кг. Тековирімат є синтетичним противірусним засобом (код АТС: J05AX24), що пригнічує активність білка периферичної мембрани ортопоксвірусу.
Експертний комітет (Committee for Medicinal Products for Human Use) EMA видав позитивну рекомендацію стосовно препарату за виняткових умов (In exceptional circumstances). Таку процедуру передбачено застосовувати з урахуванням певних конкретних зобов’язань, які переглядаються щорічно, зокрема, за неможливості надати вичерпні дані щодо ефективності та безпеки лікарського засобу.
24 вересня 2019 р. FDA оголосило про схвалення Jynneos — живої вакцини, що не реплікується, проти натуральної віспи та віспи мавп для дорослих віком 18 років і старше з високим ризиком зараження. Це єдина в даний час схвалена FDA вакцина для профілактики захворювання на віспу мавп. Віспа мавп, що має легший перебіг, ніж натуральна, передається людям від різних диких тварин, таких як гризуни та примати. У 2003 р. спалах мавпячої віспи стався у США — вперше за межами Африки. Схвалення вакцини надано у пріоритетному порядку компанії Jynneos Bavarian Nordic A/S.
*Simpson K., Heymann D., Brown C.S. et al. (2020) Human monkeypox — After 40 years, an unintended consequence of smallpox eradication. Vaccine. Jul, 14; 38(33): 5077–5081. doi: 10.1016/j.vaccine.2020.04.062. Epub 2020 May 13. PMID: 32417140.
За матеріалами www.ema.europa.eu

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим