|
 Первое пленарное заседание открыл ректор НфаУ, лауреат Государственной премии Украины, заслуженный деятель науки и техники Украины, заслуженный изобретатель Украины, член-корреспондент НАН Украины, профессор Валентин Черных, он поздравил украинских и зарубежных участников конгресса, причастных к развитию фармацевтической отрасли, с началом работы и пожелал интересных докладов и плодотворных обсуждений. Он подчеркнул, что фармацию нельзя рассматривать как явление однозвеньевое, ей присуща поливалентная структура, включающая и образование, и науку, и производство, и аптечную сеть, и контроль качества лекарственных препаратов, и информационное поле. Характерным сегодня является создание большого количества различных ассоциаций, занимающихся решением целого ряда вопросов, актуальных для фармацевтической отрасли.
Первое пленарное заседание открыл ректор НфаУ, лауреат Государственной премии Украины, заслуженный деятель науки и техники Украины, заслуженный изобретатель Украины, член-корреспондент НАН Украины, профессор Валентин Черных, он поздравил украинских и зарубежных участников конгресса, причастных к развитию фармацевтической отрасли, с началом работы и пожелал интересных докладов и плодотворных обсуждений. Он подчеркнул, что фармацию нельзя рассматривать как явление однозвеньевое, ей присуща поливалентная структура, включающая и образование, и науку, и производство, и аптечную сеть, и контроль качества лекарственных препаратов, и информационное поле. Характерным сегодня является создание большого количества различных ассоциаций, занимающихся решением целого ряда вопросов, актуальных для фармацевтической отрасли.
 С приветственным словом выступил также глава Национального совета по вопросам здравоохранения, член-корреспондент АМН Украины Николай Полищук. Он подчеркнул, что развитие всех аспектов фармации в Украине, включая фармацевтическое образование, науку и производство, является вопросом безопасности государства, и выделил приоритеты в отрасли — развитие аптечной
С приветственным словом выступил также глава Национального совета по вопросам здравоохранения, член-корреспондент АМН Украины Николай Полищук. Он подчеркнул, что развитие всех аспектов фармации в Украине, включая фармацевтическое образование, науку и производство, является вопросом безопасности государства, и выделил приоритеты в отрасли — развитие аптечной  сети, расширение внутриаптечного производства, внедрение системы возмещения стоимости приобретенных лекарственных средств, повышение уровня подготовки по клинической фармакологии в вузах медицинского профиля. По его мнению, такие меры приведут к повышению ответственности и врача, и пациента, и фармацевтического работника, и будут способствовать улучшению здоровья нации в целом. Также с приветственным словом выступил директор Государственного предприятия «Научно-экспертный фармакопейный центр» профессор Александр Гризодуб. В своем докладе он впервые презентовал второе дополнение к Государственной фармакопее Украины.
сети, расширение внутриаптечного производства, внедрение системы возмещения стоимости приобретенных лекарственных средств, повышение уровня подготовки по клинической фармакологии в вузах медицинского профиля. По его мнению, такие меры приведут к повышению ответственности и врача, и пациента, и фармацевтического работника, и будут способствовать улучшению здоровья нации в целом. Также с приветственным словом выступил директор Государственного предприятия «Научно-экспертный фармакопейный центр» профессор Александр Гризодуб. В своем докладе он впервые презентовал второе дополнение к Государственной фармакопее Украины.
Первое пленарное заседание конгресса было посвящено общим вопросам и перспективам развития фармацевтической отрасли в мире и Украине. Так, В. Черных в своей лекции уделил внимание одному из направлений глобальной технологической революции, а именно нанотехнологиям. По его словам, именно нанотехнологии позволят ответить на три главных вопроса фармации: «Как обеспечить специфичную доставку », «Как научиться контролировать фармакокинетику », «Как добиться «персонализации» лекарственного препарата ». Перспективными областями медицины с точки зрения использования нанотехнологий являются, в первую очередь, онкология, кардиология, а также разработка нового типа внутриклеточного лечения — медицинских нанороботов. В. Черных подчеркнул, что несмотря на существенное отставание Украины в развитии нанотехнологий по сравнению с другими странами мира (наша страна не входит ни в первую, ни во вторую десятку лидеров), большой научный потенциал украинских ученых позволяет успешно развивать эту отрасль.
 Заместитель главы Государственной службы лекарственных средств и изделий медицинского назначения МЗ Украины Константин Косяченко представил доклад «Состояние и перспективы развития фармации Украины», в котором привел официальную статистику импорта, производства, дистрибьюции лекарственных средств, развития аптечных сетей и др. Он подчеркнул, что программой Кабинета Министров «Украинский прорыв» определены приоритетные направления развития фармацевтической отрасли в государстве, в том числе повышение конкурентоспособности отечественной фармацевтической продукции, усовершенствование системы регистрации препаратов, внедрение системы оценки, мониторинга и контроля качества фармацевтического образования и др. Реализация заданий правительства, по словам докладчика, позволит оптимизировать работу фармацевтической отрасли и будет способствовать улучшению состояния здоровья всего населения Украины.
Заместитель главы Государственной службы лекарственных средств и изделий медицинского назначения МЗ Украины Константин Косяченко представил доклад «Состояние и перспективы развития фармации Украины», в котором привел официальную статистику импорта, производства, дистрибьюции лекарственных средств, развития аптечных сетей и др. Он подчеркнул, что программой Кабинета Министров «Украинский прорыв» определены приоритетные направления развития фармацевтической отрасли в государстве, в том числе повышение конкурентоспособности отечественной фармацевтической продукции, усовершенствование системы регистрации препаратов, внедрение системы оценки, мониторинга и контроля качества фармацевтического образования и др. Реализация заданий правительства, по словам докладчика, позволит оптимизировать работу фармацевтической отрасли и будет способствовать улучшению состояния здоровья всего населения Украины.
 Виктор Чумак, директор государственного предприятия «Государственный фармакологический центр» МЗ Украины, остановился на вопросах взаимозаменяемости лекарственных средств и законодательного обеспечения их качества в Украине. Он пояснил, что термин «биоэквивалентность» исторически трактуется по-разному в разных регионах — так, в США под ним подразумевают терапевтическую эквивалентность, а в ЕС — метод доказательства фармакокинетической эквивалентности. Поэтому ВОЗ рекомендовала заменить «биоэквивалентность» на «взаимозаменяемость» как более функциональный и унифицированный термин.
Виктор Чумак, директор государственного предприятия «Государственный фармакологический центр» МЗ Украины, остановился на вопросах взаимозаменяемости лекарственных средств и законодательного обеспечения их качества в Украине. Он пояснил, что термин «биоэквивалентность» исторически трактуется по-разному в разных регионах — так, в США под ним подразумевают терапевтическую эквивалентность, а в ЕС — метод доказательства фармакокинетической эквивалентности. Поэтому ВОЗ рекомендовала заменить «биоэквивалентность» на «взаимозаменяемость» как более функциональный и унифицированный термин.
Наиболее доступные для населения первый и второй уровни медицинской помощи базируются в первую очередь на фармакотерапии, поэтому качество лекарственных средств имеет огромное значение. Система государственной регистрации, в свою очередь, отвечает на вопрос «Какие лекарства нужны, и как ими пользоваться ». В Украине с 2007 г. проводится адаптация руководств по оценке биоэквивалентности ВОЗ (которые разработаны на основе рекомендаций США). Основная философия взаимозаменяемости состоит в том, что генерик должен быть не лучше и не хуже оригинального препарата, а таким же, как он. Система обеспечения качества генерика начинается с фармацевтической разработки препарата, проецирования (масштабирования) производственного процесса и т.д. — без надлежащего выполнения этого этапа клинические исследования биоэквивалентности просто теряют весь смысл. В. Чумак остановился более подробно на законодательных требованиях в Украине (приказ МЗ № 426), рассказал о методах исследования биоэквивалентности в зависимости от класса лекарственного средства по биофармацевтической классификационной системе, указал на основные проблемы разработки лекарственных средств, существующие в мире (включая индивидуальные особенности пациентов, различную активность ферментов печени, сочетание препаратов между собой и с продуктами питания, гендерные различия в эффективности и безопасности). Закончил свой доклад В. Чумак замечательным высказыванием американского юмориста Льюиса Гриззарда: «Жизнь подобна собачьей упряжке. Если не идешь впереди, то всегда видишь одно и то же», — которое, безусловно, заставляет задуматься.
 Заместитель главного государственного инспектора Украины по контролю качества лекарственных средств Валерий Стецив в своем выступлении рассказал о структуре Государственной инспекции, осветил проблемы деятельности инспекции на нормативно-правовом уровне, остановился на государственной программе по борьбе с фальсификацией препаратов (программа, разработанная до 2008 г., заканчивается, и уже внесена на рассмотрение Кабинета Министров новая программа — на 2009–2012 гг.). В. Стецив обозначил приоритетные направления и программные задания Государственной инспекции, к которым причислил 100% финансирование из Государственного бюджета, дооснащение современным оборудованием, усовершенствование информационной системы, внесение в законодательство изменений, необходимых для упрощения аннулирования лицензий при выявлении нарушений и др.
Заместитель главного государственного инспектора Украины по контролю качества лекарственных средств Валерий Стецив в своем выступлении рассказал о структуре Государственной инспекции, осветил проблемы деятельности инспекции на нормативно-правовом уровне, остановился на государственной программе по борьбе с фальсификацией препаратов (программа, разработанная до 2008 г., заканчивается, и уже внесена на рассмотрение Кабинета Министров новая программа — на 2009–2012 гг.). В. Стецив обозначил приоритетные направления и программные задания Государственной инспекции, к которым причислил 100% финансирование из Государственного бюджета, дооснащение современным оборудованием, усовершенствование информационной системы, внесение в законодательство изменений, необходимых для упрощения аннулирования лицензий при выявлении нарушений и др.
Акцент второго пленарного заседания был поставлен на разработке и функционировании систем контроля качества на всех этапах создания, производства и применения лекарственных средств. В этом русле прозвучало несколько основополагающих докладов.
 Так, сообщение А. Мешковского касалось новых документов раздела «качество» Международной конференции по гармонизации (International Conference on Harmonization, ICH) — Q8, Q9, Q10. В историческом аспекте предвестником появления этих документов стали американские инициативы в сфере GMP (2002 г.) о необходимости сближения регистрации, производства в соответствии с принципами надлежащей производственной практики (Good Manufacturing Practice — GMP) и инспектирования по GMP, внедрения системы управления рисками, базирования на научных данных, предоставленных разработчиками, внедрения системного подхода. Дискуссия между США, ЕС и Японией об этих инициативах была перенесена в Международную фармацевтическую федерацию (International Pharmaceutical Federation — FIP), где они были переформатированы и выделены в 3 основных направления — фармацевтическая разработка, управление рисками, системный подход, то есть система качества фармацевтического производства, которые в рамках ICH преобразовались в три документа — Q8, Q9 и Q10 соответственно. Таким образом очевидно, что эти три документа нужно рассматривать только вместе, поскольку необходимо сочетание всех перечисленных элементов. Успешное же внедрение представленных в них рекомендаций может преобразовать фармацевтический бизнес, привести к революционным изменениям в сфере создания и производства фармацевтических продуктов, а также в практике государственного надзора за этой деятельностью. Уже сейчас, хотя работа еще продолжается, они существенно изменяют регуляторную среду (нормативы и ожидания регуляторных органов).
Так, сообщение А. Мешковского касалось новых документов раздела «качество» Международной конференции по гармонизации (International Conference on Harmonization, ICH) — Q8, Q9, Q10. В историческом аспекте предвестником появления этих документов стали американские инициативы в сфере GMP (2002 г.) о необходимости сближения регистрации, производства в соответствии с принципами надлежащей производственной практики (Good Manufacturing Practice — GMP) и инспектирования по GMP, внедрения системы управления рисками, базирования на научных данных, предоставленных разработчиками, внедрения системного подхода. Дискуссия между США, ЕС и Японией об этих инициативах была перенесена в Международную фармацевтическую федерацию (International Pharmaceutical Federation — FIP), где они были переформатированы и выделены в 3 основных направления — фармацевтическая разработка, управление рисками, системный подход, то есть система качества фармацевтического производства, которые в рамках ICH преобразовались в три документа — Q8, Q9 и Q10 соответственно. Таким образом очевидно, что эти три документа нужно рассматривать только вместе, поскольку необходимо сочетание всех перечисленных элементов. Успешное же внедрение представленных в них рекомендаций может преобразовать фармацевтический бизнес, привести к революционным изменениям в сфере создания и производства фармацевтических продуктов, а также в практике государственного надзора за этой деятельностью. Уже сейчас, хотя работа еще продолжается, они существенно изменяют регуляторную среду (нормативы и ожидания регуляторных органов).
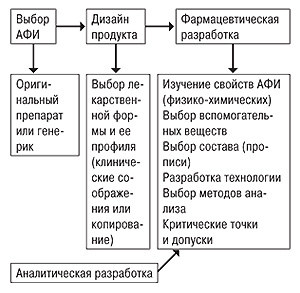
Руководство по фармацевтической разработке является, тем не менее, наиболее важным из трех рассматриваемых документов, так как содержит методические указания по подготовке соответствующей части регистрационного досье. В этой части деятельности фармпредприятия можно выделить несколько компонентов: характеризация (предварительное изучение активного фармацевтического ингредиента (АФИ), совместимость, выбор прописи и технологии, аналитических методов), оптимизация (устойчивость, критические параметры, реалистичные допуски в операциях контроля качества), верификация (валидация и квалификация, масштабирование, перенос технологии на другую площадку, текущее усовершенствование технологии) (рис. 1).
|
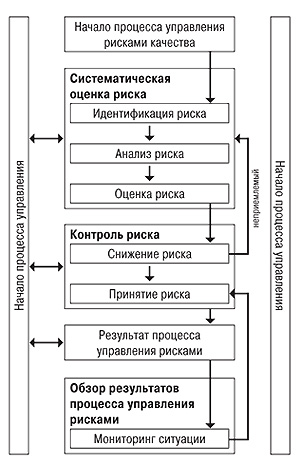
Документ Q9, посвященный управлению рисками, был разработан в 2005 г. на основе уже существующих документов отрасли (главным образом ІSО 14971), он касается в первую очередь рисков для потребителя лекарственных средств, связанных с их качеством. Общая схема процесса управления рисками состоит из таких основных этапов: систематическая оценка рисков, контроль рисков, обзор результатов процесса (рис. 2).
|
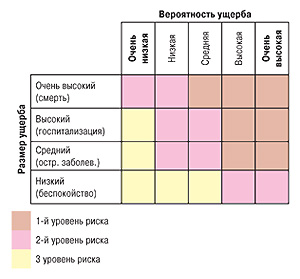
Одним из самых сложных моментов в управлении рисками, по мнению А. Мешковского, является количественная оценка (квантификация) рисков. Среди инструментов управления рисками докладчик выделил простые методы (схемы, диаграммы), критические контрольные точки (Hazard Analysis and Critical Control Point — HACCP), статистические методы (карты Шухарта и др.), а также анализ причин и последствий отказа (Failure Mode and Effects Analysis — FMEA), анализ критичности отказов (Failure Modes, Effects and Criticality Analysis — FMECA), анализ дерева ошибок (Fault Tree Analysis — FTA), исследования опасностей и пригодности к эксплуатации (Hazard and Operability Study — HAZOP), предварительное исследование опасностей (Preliminary Hazard Analysis — PHA), ранжирование рисков и другие инструменты (матрицы рисков, дерево событий и др.). На рис. 3 представлен пример классификации рисков, связанных с качеством препарата, для потребителя (пациента), а на табл. 1 пример ранжирования рисков и связанных с ним действий.
|
Таблица 1
Пример ранжирования рисков
| Оценка в баллах | Ранг | Управление риском |
| >23 | Высокий | Требуется дальнейшее снижение риска |
| 16–23 | Средний | Контролируется системой качества (GMP) + контроль производства и готовой продукции |
| <16 | Низкий | Контролируется системой качества (GMP) |
А. Мешковский подчеркнул, что необходимо как минимум досконально изучать терминологию и идеологию зарубежных коллег, даже если не во всем с ними соглашаться и не следовать всем рекомендациям.
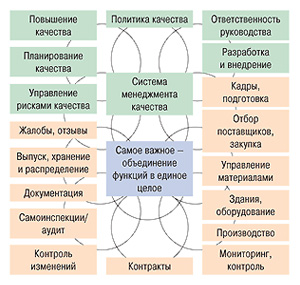
Документ ICH Q10 посвящен системам качества, он во многом основан на стандартах ISО 9000, но не является их прямым пересказом и отражает особенности фармотрасли, учитывает требования и правила GMP, связан с организацией работы инспекторатов, а также с документами ICH Q8 и Q9. Акцент здесь ставится на политике качества, планировании качества, ответственности руководства и непрерывном повышении качества продукции путем совершенствования системы качества производителя. Сочетание элементов систем управления качеством и правил GMP представлено на рис. 4.
|
В заключение А. Мешковский отметил, что документы ICH постоянно развиваются. Например, на последнем заседании Руководящего комитета ICH (11 апреля 2008 г.) была утверждена концепция нового руководства Q11, посвященного разработке и производству химических и биотехнологических лекарственных субстанций.
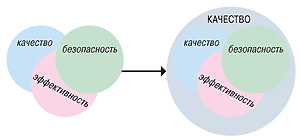
 Доклад директора биоаналитической лаборатории «Клинфарм», доктора фармацевтических наук, профессора кафедры управления качеством НФаУ Юрия Подпружникова был посвящен актуальным вопросам гармонизации систем качества в сфере оборота лекарственных средств в Украине. Он начал свое сообщение с определения понятия «качество лекарственного средства» — способность лекарственного средства удовлетворять существующие и предполагаемые потребности потребителей (пациентов и врачей). Качество препарата в глобальном смысле представляет собой сочетание его качества, эффективности и безопасности (рис. 5).
Доклад директора биоаналитической лаборатории «Клинфарм», доктора фармацевтических наук, профессора кафедры управления качеством НФаУ Юрия Подпружникова был посвящен актуальным вопросам гармонизации систем качества в сфере оборота лекарственных средств в Украине. Он начал свое сообщение с определения понятия «качество лекарственного средства» — способность лекарственного средства удовлетворять существующие и предполагаемые потребности потребителей (пациентов и врачей). Качество препарата в глобальном смысле представляет собой сочетание его качества, эффективности и безопасности (рис. 5).
|
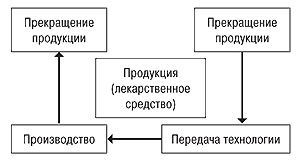
Затем докладчик остановился на структуре и функциях Международной конференции по гармонизации (ICH), перечислил основные документы раздела «качество» и остановился более подробно на жизненном цикле продукции, который включает все фазы существования лекарственного средства от начала его разработки через пребывание на рынке и до окончания его пребывания на рынке (рис. 6).
|
Еще в 2004 г. КМУ обязал постановлением от 28.10.2004 г. № 1419 Министерство здравоохранения обеспечить начиная с января 2009 г. оборот лекарственных средств в соответствии с требованиями надлежащей производственной, дистрибьюторской, лабораторной и клинической практики, гармонизированных с соответствующими директивами ЕС и ВОЗ. По мнению Ю. Подпружникова, первоочередными задачами для гармонизации в области стандартизации являются актуализация GMP Украины с GMP ЕС, а также подготовка и утверждение в МЗ Украины требований GLP, соответствующих Европейской GLP. Среди первоочередных задач для гармонизации в правовой сфере докладчик выделил необходимость сделать обязательными в Украине требования GMP и GDP путем внесения их в Лицензионные условия, создать инспекцию GLP с соответствующими полномочиями, сделать требования GCP и GLP обязательными при инспектировании и аттестации клинических и доклинических баз в Украине, ввести обязательное предрегистрационное инспектирование на соответствие GMP (для стран, не входящих в PIC/S), обеспечить вступление уполномоченного органа Украины в PIC/S.
|
|
 Николай Ляпунов, доктор фармацевтических наук, профессор (Государственный научный центр лекарственных средств), в своем докладе рассмотрел системный подход к стандартизации, который необходим для успешного внедрения GMP, GLP, GCP, GDP в Украине (читайте в следующем номере).
Николай Ляпунов, доктор фармацевтических наук, профессор (Государственный научный центр лекарственных средств), в своем докладе рассмотрел системный подход к стандартизации, который необходим для успешного внедрения GMP, GLP, GCP, GDP в Украине (читайте в следующем номере).
 Одним из аспектов качества в фармацевтической отрасли, безусловно, является проблема информационного насыщения и качества информации. Доклад на тему «Информационное обеспечение фармацевтической деятельности: желаемое и реалии» представил И. Крячок. Он подчеркнул, что нынешняя бизнес-модель фарминдустрии выстроена главным образом в горизонтальной плоскости, когда на пациента прямо направлено влияние лечебного учреждения, врача поликлиники, работника аптеки, системы здравоохранения в целом; в общем фармацевтическая отрасль очень влиятельна, воздействуя практически на всех, кто связан с миром медицины, включая врачей, пациентов, ученых, представителей средств массовой информации и даже регуляторных органов. Можно выделить целый ряд движущих и направляющих элементов (так называемых драйверов) развития индустрии здравоохранения. Во-первых, это динамика фармацевтического рынка, в частности генерическая конкуренция и «размывание» цен, засилие препаратов, не имеющих терапевтических преимуществ перед существующими («me-too»), слабеющая отдача от R&D. Во-вторых, это демографические тенденции, характеризующиеся увеличением ожидаемой продолжительности жизни приблизительно на 1 год за каждое десятилетие — предполагают, что к 2030 г. свыше трети европейцев будут в возрасте старше 60 лет. В-третьих, прогресс медицины с одной стороны (включая расшифровку генетического кода, использование в терапевтических технологиях методов клонирования и биологических разработок), и появление ранее не известных заболеваний — с другой. Наконец, необходимость сокращения сроков разработки препаратов («нужный препарат в нужное время») и значительный технический прогресс (нанотехнологии, имплантируемые микродатчики, высокоточное дозирование медикаментов и пр.). Фармацевтическая промышленность в течение нескольких десятилетий эволюционирует, продвигаясь от принципа «разрабатывай и продавай» к принципу «новаторствуй и выполняй обязательства» — и если еще в начале тысячелетия акцент ставили на продукте (лекарственном средстве), сегодня он сместился уже на заболевание, а к 2020 г.у прогнозируется фокусирование на целостном подходе к управлению здоровьем.
Одним из аспектов качества в фармацевтической отрасли, безусловно, является проблема информационного насыщения и качества информации. Доклад на тему «Информационное обеспечение фармацевтической деятельности: желаемое и реалии» представил И. Крячок. Он подчеркнул, что нынешняя бизнес-модель фарминдустрии выстроена главным образом в горизонтальной плоскости, когда на пациента прямо направлено влияние лечебного учреждения, врача поликлиники, работника аптеки, системы здравоохранения в целом; в общем фармацевтическая отрасль очень влиятельна, воздействуя практически на всех, кто связан с миром медицины, включая врачей, пациентов, ученых, представителей средств массовой информации и даже регуляторных органов. Можно выделить целый ряд движущих и направляющих элементов (так называемых драйверов) развития индустрии здравоохранения. Во-первых, это динамика фармацевтического рынка, в частности генерическая конкуренция и «размывание» цен, засилие препаратов, не имеющих терапевтических преимуществ перед существующими («me-too»), слабеющая отдача от R&D. Во-вторых, это демографические тенденции, характеризующиеся увеличением ожидаемой продолжительности жизни приблизительно на 1 год за каждое десятилетие — предполагают, что к 2030 г. свыше трети европейцев будут в возрасте старше 60 лет. В-третьих, прогресс медицины с одной стороны (включая расшифровку генетического кода, использование в терапевтических технологиях методов клонирования и биологических разработок), и появление ранее не известных заболеваний — с другой. Наконец, необходимость сокращения сроков разработки препаратов («нужный препарат в нужное время») и значительный технический прогресс (нанотехнологии, имплантируемые микродатчики, высокоточное дозирование медикаментов и пр.). Фармацевтическая промышленность в течение нескольких десятилетий эволюционирует, продвигаясь от принципа «разрабатывай и продавай» к принципу «новаторствуй и выполняй обязательства» — и если еще в начале тысячелетия акцент ставили на продукте (лекарственном средстве), сегодня он сместился уже на заболевание, а к 2020 г.у прогнозируется фокусирование на целостном подходе к управлению здоровьем.
|
Важными элементами управления здоровьем являются раннее выявление заболевания и идентификация рисков, целенаправленная и более эффективная медикаментозная терапия с меньшим количеством побочных эффектов, целевое распределение действующего вещества в организме пациента и синхронизация амбулаторного и госпитального лечения. Однако кроме названных «медицинских» составляющих не менее существенное значение имеют первоклассная информационная поддержка и консультирование по всем аспектам управления здоровьем. Источниками информации для профессионалов здравоохранения служат сообщения коллег на конференциях и других мероприятиях, публикации в специализированных журналах, газетах, справочниках и других изданиях, деятельность медицинских представителей, прямая реклама, размещаемая в медицинских изданиях, в том числе интернет-проектах, прямая рассылка сообщений специалистам. Докладчик представил статистику динамики значимости основных источников информации для фармацевтов и экспертов центров закупок за последние несколько лет, а также проанализировал эти данные (подробнее — «Еженедельник АПТЕКА», № 11 (632) от 17 марта 2008 г.). И. Крячок подчеркнул, что в будущем с переходом на целостный подход к управлению здоровьем роль фармацевта будет расти, так как именно он занимает особое место среди профессионалов системы здравоохранения. Так, он непосредственно контактирует с потребителем и влияет на принятие решения в безрецептурном сегменте, осуществляет генерическую замену в сегменте Rх и терапевтическую замену препаратов «me-too», находится на переднем краю профилактических, диагностических и терапевтических мероприятий по управлению здоровьем. Таким образом, очевидна необходимость в информационной опеке фармацевтов в Украине. Один из элементов такой опеки — обеспечение открытого доступа, который включает бесплатный доступ к публикациям и немедленное помещение информации по меньшей мере в один открытый электронный архив, а также совместные заявления о раскрытии информации о клинических исследованиях посредством регистров клинических исследований и баз данных. Важно и то, что со временем будет еще больше повышаться роль пациентов, поэтому полноценное информирование, обучение пациентов, разъяснение преимуществ профилактики и ранней диагностики перед лечением хронических заболеваний имеет большое значение. Партнерами правительства, провайдеров здравоохранения, организаций пациентов могут быть фармацевтические компании. Необходимо налаживание прозрачных, стабильных взаимоотношений в интересах пациентов на всех уровнях. В этом новом информационном поле именно фармацевт обязан стать для пациента надежным источником знаний по всем вопросам управления здоровьем.
На конференции прозвучало еще много интересных докладов, в том числе представленных Аллой Немченко, профессором, заведующей кафедрой организации и экономики фармации, Александром Тихоновым, профессором, заведующим кафедрой аптечной технологии лекарств НФаУ, Келесбеком Абдуллиным, деканом фармацевтического факультета Казахстанского медицинского университета.
На заключительном пленарном заседании были подведены итоги работы Всеукраинского конгресса «Настоящее и будущее фармации», выражена общая мысль, что в контексте быстротечных изменений, происходящих в фармацевтической отрасли Украины, проведение конгресса было своевременным, поставленная цель конгресса была достигнута, а его работа признана удовлетворительной. Научные наработки конгресса могут быть использованы при проведении научных исследований, усовершенствовании работы практической фармации и развитии законодательной базы.
Рассказывая о Всеукраинском конгрессе «Настоящее и будущее фармации», хотим отметить, что нам повезло стать свидетелями и участниками внедрения новых концепций во все сферы фармации: науку, образование, производство, маркетинг и т.д. Приметой времени является также и то, что происходящие изменения касаются всех работников отрасли, что открывает перед ними большие перспективы профессиональной реализации. n
Елена Руднева, фото Любови Столяр


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим