
Разумеется, не миновала эта тенденция и Украину, которая активно и достаточно успешно участвует в мировом фармакопейном процессе. В рамках сотрудничества экспертов США и Украины в последние дни ноября в Киеве состоялась конференция «Пути сотрудничества американской и украинской фармакопеи», которая собрала отечественных и зарубежных представителей фармакопейных органов. Среди них — генеральный директор Фармакопеи США (United States Pharmacopeia — USP), доктор медицины Роджер Уильямс (Roger L. Williams), заместитель начальника Государственной инспекции по контролю качества лекарственных средств (далее — Гослекинспекция) Константин Косяченко, директор ГП «Украинский фармакопейный центр качества лекарственных средств» (далее — Фармакопейный центр), доктор химических наук профессор Александр Гризодуб, доктор фармацевтических наук, профессор, заместитель председателя научно-методологического совета Гослекинспекции Юрий Подпружников и др.
Конференция начала свою работу с приветствия американских гостей украинской стороной — советником министра здравоохранения Украины Иваном Сорокой и заместителем начальника Гослекинспекции Андреем Захарашем. Они отметили, что высокие стандарты, заложенные в Государственной Фармакопее Украины (ГФУ), а также соблюдение норм надлежащей производственной практики (Good Manufacturing Practice — GMP) являются гарантией производства высококачественных лекарственных средств для украинских пациентов. «Приятно, что есть возможность общаться и обмениваться опытом с д-ром Р. Уильямсом, возглавляющим одну из старейших и авторитетнейших фармакопей — USP… Хочется, чтобы конференция стала прекрасной возможностью в налаживании сотрудничества Украины и США с целью построения плана общих действий и наибольших приобретений в ходе фармакопейного движения», — отметили выступающие.
 Профессор, член-корреспондент НАН Украины Виктор Георгиевский, стоявший у истоков первой ГФУ, остановился на истории отечественного фармакопейного процесса и той роли, которую в нем сыграли украинские ученые. «Создание украинской фармакопеи имеет глубокие корни, — отметил В. Георгиевский, — поскольку украинские химики и фармацевты, такие как Николай Красовский, Абрам Розенфельд, Николай Валяшко и другие, принимали участие в разработке российской фармакопеи еще в прошлом веке, затем продолжив работу и над Фармакопеей СССР».
Профессор, член-корреспондент НАН Украины Виктор Георгиевский, стоявший у истоков первой ГФУ, остановился на истории отечественного фармакопейного процесса и той роли, которую в нем сыграли украинские ученые. «Создание украинской фармакопеи имеет глубокие корни, — отметил В. Георгиевский, — поскольку украинские химики и фармацевты, такие как Николай Красовский, Абрам Розенфельд, Николай Валяшко и другие, принимали участие в разработке российской фармакопеи еще в прошлом веке, затем продолжив работу и над Фармакопеей СССР».
Украинскими учеными также были разработаны некоторые методы анализа, которые впоследствии вошли в мировые фармакопеи. Такими, например, являются биологический метод контроля качества сердечных гликозидов, который был разработан в 1920-х годах А.Д. Розенфельдом и его учениками; в 1937-х годах был создан метод тонкослойной хроматографии под руководством Н.А. Измайлова, а в 1959 г. вышло положение о кислотно-основном титровании в неводных средах.
«Я как первый руководитель проекта по созданию украинской фармакопеи, хочу отметить, что сотрудничество между фармакопеями США и Украины зародилось еще в 1990-х годах, когда я впервые в составе рабочей делегации посетил США, где проходили курс обучения в FDA. Я был впечатлен не только оснащением, но и теми задачами, которые стояли перед USP», — рассказал В. Георгиевский. После этого эстафету между двумя фармакопеями приняли ученики В. Георгиевского — профессоры А. Гризодуб, Ю. Подпружников. «Взаимодействие фармакопей на уровне государств содействует развитию и пониманию не только между наукой, но и между государствами», — отметил в заключение В. Георгиевский.
 Огромный интерес вызвал доклад «Структура и основные задачи американской фармакопеи» Роджера Уильямса, генерального директора USP. В начале своего доклада он остановился на истории американской фармакопеи. USP была создана в 1820 г. практикующими врачами, поставившими задачу создать такой документ, который помог бы создавать одинаково качественные лекарственные средства. Этими врачами была созвана так называемая конвенция, которая прошла в здании Капитолия.
Огромный интерес вызвал доклад «Структура и основные задачи американской фармакопеи» Роджера Уильямса, генерального директора USP. В начале своего доклада он остановился на истории американской фармакопеи. USP была создана в 1820 г. практикующими врачами, поставившими задачу создать такой документ, который помог бы создавать одинаково качественные лекарственные средства. Этими врачами была созвана так называемая конвенция, которая прошла в здании Капитолия.
В первом издании американской фармакопеи содержались статьи примерно на 200 препаратов, среди которых такие известные всем фармацевтам, как опиум, эхинацея, гинкго билоба и др. Многие из тех препаратов применяются в медицинской практике и по сей день. Однако в указанном издании американской фармакопеи содержались требования к составу лекарственных средств, но не было методик контроля их качества. И лишь спустя около 80 лет один из предшественником доктора Р. Уильямса изменил ее так, чтобы из книги, регламентирующей состав лекарственных средств, американская фармакопея стала изданием, что позволяет тестировать качество препаратов.

«В конечном итоге неважно, как осуществляется приобретение лекарственных средств: посредством уплаты налогов (в результате чего пациент получает доступ к бесплатному медицинскому обслуживанию), непосредственного приобретения препаратов через розничную аптечную сеть, либо же через приобретение страхового полиса на медицинское обслуживание, — мы все без исключения являемся потребителями лекарств. И именно поэтому важно, чтобы качество всех лекарственных средств было одинаково высоким», — подчеркнул Р. Уильямс.
У фармакопей разных стран есть нечто общее и есть то, чем они отличаются друг от друга. Любую фармакопею готовят эксперты, устанавливающие те или иные стандарты; отличие же состоит в том, как осуществляется руководство этими нормативными документами. Так, нормы, излагаемые в фармакопеях большинства стран, регламентируются правительствами и управляются фармакопейной комиссией, комитетом или подобным органом. Так, например, обстоит ситуация в Украине, где каждое издание ГФУ разрабатывается группой экспертов, после чего утверждается государственным органом — Государственной инспекцией по контролю качества лекарственных средств. Несколько иначе дело обстоит с USP. Несмотря на то что в названии организации, отвечающей за разработку и внедрение USP, — Американская фармакопейная конвенция (United States Pharmacopeial Convention) — звучит название страны, данная структура не имеет никакого отношения к правительству Соединенных Штатов. Американская фармакопейная конвенция является негосударственной организацией, устанавливающей стандарты, с которыми гармонизированы законодательные акты США. Такая ситуация сложилась исторически, отметил Р. Уильямс: USP появилась в 1820 г., до того, как государство стало пытаться регулировать качество лекарственных средств (первый законодательный акт — закона об импорте лекарственных средств (Drug Import Act) — появился в 1848 г.; государственный орган — FDA — лишь в 1906 г.).
Однако закон об импорте лекарственных средств никак не решил проблемы качества препаратов на внутреннем рынке США. Поэтому в 1906 г., а затем в 1938 г. Конгресс США заявил, что для торговых отношений между штатами должны использоваться стандарты USP, с помощью которых должен проводиться контроль качества лекарственных средств. Таким образом, USP стала официальным сборником стандартов, который стал регулировать все аспекты качества лекарств, и больше это положение не пересматривалось. Поэтому, тогда как в Украине каждое новое издание фармакопеи становится официальным после утверждения госорганами, любое новое издание американской фармакопеи априори является официальным законом.
В настоящее время USP защищает интересы всех заинтересованных сторон — фармацевтических компаний — производителей, общественных объединений практикующих специалистов и пациентов. Стандарты, устанавливаемые USP, доступны странам всего мира, и в их разработке по-прежнему принимают участие врачи и фармацевты, для того чтобы лекарственные средства были качественными, безопасными и эффективными. Вместе с тем в настоящее время внимание USP сфокусировано на качестве не только лекарственных средств, но и пищевых продуктов.
Далее Р. Уильямс остановился на структуре Американской фармакопейной конвенции, которая включает совет конвенции, консультативные группы, экспертный совет и комитеты, совет попечителей и его комитеты и пр. (рисунок). Важно отметить, что эксперты, работающие над созданием USP, являются волонтерами, то есть не получают материального вознаграждения за свою работу. Кроме того, в экспертных органах USP могут работать специалисты со всех стран мира, не обязательно граждане США. В настоящее время членами экспертных комитетов USP являются порядка 700 экспертов и около 20% из них — не граждане США. Так, например, в качестве наблюдателя в USP приглашен директор Фармакопейного центра, доктор химических наук, профессор А. Гризодуб.
Каждые 5 лет проходит съезд Американской фармакопейной конвенции; ближайший состоится 21–24 апреля 2010 г. и пройдет в Вашингтоне (столице США). Тогда же начнут свою работу новые экспертные комитеты.
Американская фармакопея состоит из основного издания (регламентирует качество субстанций и готовых лекарственных средств) и нескольких дополнительных, каждое из которых регламентирует отдельную сферу. Так, United States Pharmacopeia – National Formulary (USP-NF) является сборником стандартов по вспомогательным веществам; United States Pharmacopeia — Verified Dietary Supplements (USP-DS) — регламентирует качество диетических добавок; United States Pharmacopeia — Food Chemicals Codex (USP-FCC) — стандарты для пищевых продуктов, а United States Pharmacopeia — Pharmacists’ Pharmacopeia (USP-Р2) является так называемой фармацевтической фармакопеей, которая регламентирует стандарты для фармацевтов, занятых экстемпоральным производством лекарств. Над каждым из дополнительных изданий американской фармакопеи работает отдельный комитет.
Под конец своего выступления Р. Уильямс рассказал о работе USP в других странах мира. Так, кроме главного офиса, находящегося в городе Роквилл (штат Мериленд, США), на данный момент открыты отделения USP в Индии, Китае, Бразилии и Швейцарии, поскольку в первую очередь именно из этих стран в США поступают активные фармацевтические ингредиенты. С этой же ситуацией сталкивается и Украина. Р. Уильямс также остановился на путях сотрудничества между Американской фармакопейной конвенцией и регуляторными органами Украины, в частности относительно предоставления права украинской стороне использовать монографии USP в ГФУ.
По окончании конференции корреспондент «Еженедельник АПТЕКА» получил возможность познакомиться с Р. Уильямсом и взять у него короткое интервью, в котором тот отметил:
? Я представляю организацию, одна из главных задач которой ? поддержка на высоком уровне качества лекарственных средств во всех странах мира. Мой визит в Украину поддерживает как правление ? совет попечителей, так и непосредственно Американская фармакопейная конвенция.
Организация, которую я представляю, сотрудничает и с представителями частного сектора, фармацевтическими производителями, и с представителями государственных органов. Думаю, что для всех нас это взаимовыгодное сотрудничество: возможность делиться опытом, устанавливать высокие стандарты качества лекарств, а локальным производителям иметь доступ к стандартам, которые приняты в США.
— В чем выиграют украинские производители в результате визита делегации USP
? Как я и указывал во время своего выступления, с получением доступа к стандартам USP украинские производители получают доступ к одним из самых высоких и передовых стандартов качества. Это позволяет им использовать уже готовые стандарты, а не разрабатывать с нуля, а значит сэкономить огромные ресурсы (в том числе материальные), кроме того, позволяет получить доступ на рынки других стран.
 Константин Косяченко свой доклад посвятил вопросам развития системы государственного контроля качества лекарственных средств в Украине. Украина, считает он, вплотную приблизилась к европейским стандартам обеспечения качества лекарственных средств и отечественные фармацевтические производители в самые короткие сроки и при минимальных материальных затратах смогут работать по этим стандартам.
Константин Косяченко свой доклад посвятил вопросам развития системы государственного контроля качества лекарственных средств в Украине. Украина, считает он, вплотную приблизилась к европейским стандартам обеспечения качества лекарственных средств и отечественные фармацевтические производители в самые короткие сроки и при минимальных материальных затратах смогут работать по этим стандартам.
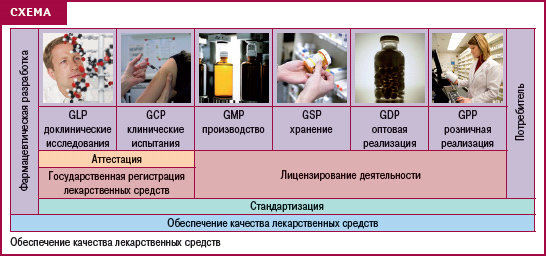
 О том, как в Украине обеспечивается качество лекарств (схема) и проходит внедрение стандартов GMP в сфере производства лекарственных средств, рассказал Юрий Подпружников. Докладчик остановился на истории внедрения требований GMP, которые впервые были утверждены в США на законодательном уровне в 1963 г., а уже спустя несколько лет, в 1969 г., были приняты ВОЗ как рекомендательные. В Украине требования GMP начали внедряться с 1997 г. По состоянию на начало 2009 г. в Украине на законодательном уровне утверждены, кроме GMP, такие стандарты, как GDP, GLP, GСP, которые полностью отвечают стандартам ЕС.
О том, как в Украине обеспечивается качество лекарств (схема) и проходит внедрение стандартов GMP в сфере производства лекарственных средств, рассказал Юрий Подпружников. Докладчик остановился на истории внедрения требований GMP, которые впервые были утверждены в США на законодательном уровне в 1963 г., а уже спустя несколько лет, в 1969 г., были приняты ВОЗ как рекомендательные. В Украине требования GMP начали внедряться с 1997 г. По состоянию на начало 2009 г. в Украине на законодательном уровне утверждены, кроме GMP, такие стандарты, как GDP, GLP, GСP, которые полностью отвечают стандартам ЕС.
С 2002 г. в Украине существует добровольная сертификация GMP. На сегодня в нашей стране сертифицировано 13 фармацевтических предприятий, на них — 35 производственных участков. За период с апреля по октябрь 2009 г. было проинспектировано 36 предприятий (60 производственных участков), из которых в результате проверки получили позитивные результаты 31 производственный участок, то есть примерно половина.
В марте 2009 г. были утверждены изменения, касающиеся Лицензионных условий ведения хозяйственной деятельности по производству лекарственных средств, оптовой, розничной торговли лекарственными средствами (см. «Еженедельник АПТЕКА» № 15 (686) от 13.04.2009 г.;). Наиболее принципиальное изменение, по словам Ю. Подпружникова, коснулось п. 1.4. этих условий. Были также гармонизированы процедуры инспектирования.
 Александр Гризодуб в докладе «Основные направления развития Государственной Фармакопеи Украины» остановился на истории создания ГП «Украинский фармакопейный центр качества лекарственных средств», его основных задачах, структуре и основных научных направлениях его работы (фармацевтические субстанции, лекарственное растительное сырье, готовые лекарственные средства, экстемпоральные и гомеопатические препараты, методы анализа и реактивы, биологические продукты, лекарственные формы и фармакотехнологические испытания, стандартные образцы, валидация, верификация и метрология, а также программы профессионального тестирования лабораторий по контролю качества лекарственных средств). Кроме того, А. Гризодуб рассказал об истории создания первой украинской фармакопеи, ее структуре, сложностях, с которыми приходится сталкиваться при разработке фармакопейных материалов, а также дальнейших планах.
Александр Гризодуб в докладе «Основные направления развития Государственной Фармакопеи Украины» остановился на истории создания ГП «Украинский фармакопейный центр качества лекарственных средств», его основных задачах, структуре и основных научных направлениях его работы (фармацевтические субстанции, лекарственное растительное сырье, готовые лекарственные средства, экстемпоральные и гомеопатические препараты, методы анализа и реактивы, биологические продукты, лекарственные формы и фармакотехнологические испытания, стандартные образцы, валидация, верификация и метрология, а также программы профессионального тестирования лабораторий по контролю качества лекарственных средств). Кроме того, А. Гризодуб рассказал об истории создания первой украинской фармакопеи, ее структуре, сложностях, с которыми приходится сталкиваться при разработке фармакопейных материалов, а также дальнейших планах.
Так, например, лекарственное растительное сырье, по словам А. Гризодуба, в большинстве своем является дикорастущим. Это затрудняет его стандартизацию, поэтому зачастую отечественное лекарственное растительное сырье не отвечает требованиям Европейской Фармакопеи. Это подталкивает Украину к необходимости разрабатывать собственные, национальные монографии, которые регламентировали бы качество такого сырья. В настоящее время Фармакопейным центром проводятся исследования, и на сегодня уже разработано около 40 монографий, а также несколько монографий на спиртовые настойки.
В Украине находят широкое применение гомеопатические препараты; в то же время их качество по известным причинам не может контролироваться теми же нормами, которыми оно контролируется у аллопатических лекарств. Это также вынуждает работать над созданием соответствующих положений ГФУ, которые бы стандартизировали качество таких лекарственных средств. На сегодня уже разработана общая статья на гомеопатические препараты, в которой дается определение этим средствам, выдвигаются требования к качеству сырья, методам потенцирования, качеству матричных настоек и т.п.
Наше издание не могло также не затронуть проблему экстемпоральных лекарственных средств, которые в настоящее время остались практически за бортом фармакопейного процесса. На эту темы мы отдельно пригласили побеседовать А. Гризодуба:
? К настоящему времени пока не создана единая концепция введения экстемпоральной рецептуры в ГФУ. Дело в том, что экстемпоральные препараты отражают реальный уровень аптечного производства лекарственных средств и национальную специфику. Уровень аптечного производства лекарственных средств существенно ниже промышленного. Это и стало причиной того, что экстемпоральная рецептура практически выпала из фармакопейного процесса. Вместе с тем, это мировая тенденция — практически во всех странах мира идет сокращение экстемпоральной рецептуры. Это связано как с тем, что качество в условиях промышленного производства все же выше, поскольку в них гораздо проще обеспечить соблюдение требований к чистоте, асептике и прочему, так и с тем, что в нашей стране стоимость экстемпоральных препаратов ниже в сравнении с их стоимостью в развитых странах.
— Проводится ли в настоящее время Фармакопейным центром какая-то работа в отношении экстемпоральных лекарств
? Сегодня своей главной задачей Фармакопейный центр видит возвращение экстемпоральной рецептуры в фармакопейный процесс. Впервые подобные шаги стали предприниматься в 2008 г., когда были подготовлены общие фармакопейные статьи на экстемпоральные лекарства. Сегодня в сотрудничестве с коллективом кафедры аптечной технологии лекарств Национального фармацевтического университета Украины (Харьков) нами ведется работа по подготовке ряда дополнительных статей, проводятся исследования по изучению фактического качества экстемпоральных лекарств, которые ранее вообще не проводились. В ходе работы над фармакопейными статьями на экстемпоральные лекарственные средства перед нами возник ряд важных вопросов, без решения которых дальнейшая работа над созданием подобных материалов теряем всяческий смысл. Так, например, какие параметры и методы должны содержаться в монографии на экстемпоральные лекарственные средства? Очевидно, что методы анализа в них не могут быть теми же, что и для контроля качества готовых препаратов, как это было в Фармакопее СССР. Могут ли существующие в аптеке условия обеспечить надлежащее качество экстемпоральных лекарственных средств, которое должно быть таким же, как и у готовых лекарств (при том, что условия и методы производства, а также оснащенность аптеки совсем другие, нежели в промышленности)? Отдельная проблема — сроки годности на экстемпоральные лекарственные средства, а также гарантия соответствия качества фармацевтических субстанций в условиях аптеки.
Надеюсь, что в скором времени нам удастся вернуть экстемпоральную рецептуру в фармакопейный процесс, а значит, сделать значительный и существенный шаг к возрождению качественного аптечного производства.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим