|
К биологическим (биофармацевтическим) ЛС относят те, которые в качестве активной субстанции содержат иммунологические продукты, производные крови, белки, полученные при помощи биотехнологий, моноклональные антитела и т.п. (EMEA, 2005). ЛС, действующими веществами которых являются белки, полученные при помощи генной инженерии (рекомбинантные), или моноклональные антитела, часто называют биотехнологическими (MHRA, 2005), хотя такой термин применяют и по отношению к биологическим ЛС («IMS Health», 2005).
Наряду с ЛС из растительного сырья белковые препараты были одними из первых продуктов, выпуск которых был освоен молодой фармацевтической отраслью во второй половине ХІХ в., прежде чем был внедрен химический синтез. Задолго до изобретения антибактериальных препаратов для использования в качестве средств пассивной вакцинации стали выпускать сыворотки, полученные от животных и людей, у которых сформировался иммунитет по отношению к возбудителям кори, дифтерии, столбняка, их токсинам и др. С 1921 г. начали извлекать инсулин из поджелудочной железы животных. Кроме инсулина, спустя некоторое время был освоен выпуск фолликулостимулирующего гормона, экстрагируемого из человеческой мочи, глюкагона — из поджелудочной железы свиней, гормона роста — из гипофиза человека. Однако производственные процессы были недостаточно эффективными и экономичными. Кроме того, натуральные белковые продукты обладали высокой иммунногенностью, нередко оказывались контаминированными возбудителями различных инфекционных заболеваний. Существовали проблемы и с вариабельностью серий препаратов и невозможностью произвести их в достаточном количестве из природных источников. Многие из них были решены с началом использования рекомбинантных ДНК (Rang H.P., 2006).
С момента выведения на мировой рынок в 1980 г. рекомбинантных инсулина и гормона роста появилось еще довольно много продуктов белкового синтеза, осуществляемого с помощью культур генетически модифицированных клеток (рис. 1). Многие из этих препаратов предназначены для лечения пациентов с тяжелыми, угрожающими жизни заболеваниями (табл. 1). Почти все они очень дороги, и их применение серьезно влияет на бюджет здравоохранения: при стоимости 1 г золота около 17 дол. США такое же количество рекомбинантного гормона роста стоит примерно 20 тыс. (van Rijkom E.A.J., 2002).
|
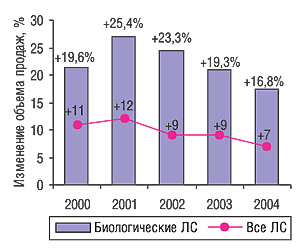
Динамика увеличения объема продаж биологических препаратов, как и всего фармрынка в целом, в течение последних 6 лет характеризуется постепенным замедлением, но показатели прироста по-прежнему остаются значительными (рис. 2) («IMS Health», 2005). По данным «IMS Health» в 2005 г. объем продаж биологических ЛС увеличился на 17% по сравнению с предыдущим годом и достиг 52,7 млрд дол. В абсолютных числах прирост объема этого сектора рынка, ведущими игроками в котором являются «Amgen», «Roche»/«Genentech» и «Johnson&Johnson», составил 7,6 млрд дол. («IMS Health», 2006). Около 60% мирового объема продаж биологических ЛС приходится на США, здесь же выдано наибольшее количество разрешений на маркетинг этих лекарственных средств. Во всем мире разные стадии клинических испытаний проходит 621 биологический препарат, из них в США — более половины (Krasnoff E., Martin J., 2004).
|
Таблица 1
Примеры получивших разрешение на маркетинг в США или Европе биотехнологических препаратов
| Действующее вещество | Торговое наименование | Дата одобрения |
| Факторы свертывания крови и активаторы плазминогена | ||
| Фактор свертывания VIII | Kogenate, Recombinate | 1992 |
| Фактор свертывания IX | Benefix | 1997 |
| Активатор тканевого плазминогена | Activase, Ecokinase | 1987 |
| Гемопоэтические факторы | ||
| Эритропоэтин | Epogen, Procrit | 1989 |
| Гранулоцитарно-макрофагальный колониестимулирующий фактор | Leukine | 1991 |
| Гормоны | ||
| Человеческий инсулин | Humulin, Novolin, Protropin | 1982 |
| Человеческий глюкагон | Glucagen | 1998 |
| Человеческий гормон роста | Humatrope, Nutropin | 1987 |
| Человеческий тиреостимулирующий гормон | Thyrogen | 1998 |
| Человеческий фолликулостимулирующий гормон | Gonal F, Follistim | 1995 |
| Интерфероны и интерлейкины | ||
| Человеческий интерферон-a | Intron A, Viraferon | 1986 |
| Человеческий интерферон-b | Betaferon | 1995 |
| Человеческий интерферон-g | Actimmune | 1990 |
| Модифицированный человеческий интерлейкин-2 | Proleukin | 1992 |
| Моноклональные антитела | ||
| Абциксимаб (против тромбоцитарного GPIIb/IIIa) | ReoPro | 1994 |
| Трастузумаб (против рецепторов раковых клеток) | Herceptin | 1998 |
| Инфликсимаб (против фактора некроза опухоли-a) | Remicade | 1998 |
| Ритуксимаб (против CD20 лимфоцитарных антигенов) | Rituxan | 1997 |
|
Судя по тому, какое количество биологических ЛС уже лишились патентной защиты или потеряют ее в недалеком будущем, как только «созреет» регуляторная база, на рынке тут же окажется масса препаратов-копий (табл. 2). Аналогичными биологическими ЛС называются новые продукты, фармацевтически или терапевтически аналогичные биологическим ЛС, уже получившим разрешение на маркетинг (Love J.M., 2006). По данным некоторых исследований к 2010 г. объем мирового рынка биогенериков составит 6,6 млрд дол., причем 61,5% будет приходиться на генерические версии препаратов, которые сегодня еще находятся под патентной защитой. К концу 2006 г. без патентной защиты останутся биологические ЛС, объем продаж которых сегодня составляет 10 млрд дол. (табл. 3) («IMS», 2005; Love J.M., 2006).
Таблица 2
Сроки окончания патентной защиты некоторых биотехнологических ЛС в ЕС и США (Schellekens H., 2004)
| ЛС | Компания-оригинатор | США | ЕС |
| Соматотропин | Genentech | Окончилась | Окончилась |
| Инсулин | Eli Lilly | Окончилась | Окончилась |
| Стрептокиназа | AstraZeneca | Окончилась | Окончилась |
| Интерферон-a 2 | Biogen/Roche | Окончилась | 2003–2007 |
| Соматотропин | Serono | Окончилась | – |
| Соматотропин | Eli Lilly | Окончилась | – |
| Эритропоэтин-a | Amgen | 2013 | Окончилась |
| Эритропоэтин-a | Roche | – | 2006 |
| Интерферон-g | InterMune | 2006, 2012 | Окончилась |
| Активатор тканевого плазминогена | Genentech | 2005–2010 | Окончилась |
| Интерлейкин-2 | Chiron | 2006–2012 | Окончилась |
| Гранулоцитарный колониестимулирующий фактор | Amgen | 2015 | 2006 |
Таблица 3
Биотехнологические ЛС-блокбастеры, срок патентной защиты которых истекает в 2005–2009 гг. («IMS Health», 2005)
| Брэнд | Активная субстанция | Производитель | Объем продаж, млн дол. (2004 г.) |
Прогнозируемое уменьшение объема продаж, % (2005–2009 гг.) |
| Erypo/Procrit/Epogen | Эритропоэтин-b | J&J/Amgen | 7304 | 13 |
| Avonex/Rebif | Интерферон-b 1A | Biogen Idec/Serono | 2245 | 90 |
| Genotropin/Humatrope/Norditropin | Соматотропин | Pfizer/Eli Lilly/Novo Nordisk | 1785 | 76 |
| Neupogen | Филграстим | Amgen | 1565 | 35 |
| Recormon | Эритропоэтин-b | Roche | 1410 | 96 |
| Ins. Protaphane HM/Novolin N/Actraphane HM/Humulin NPH | Инсулин человеческий изофан | Novo Nordisk/Eli Lilly | 1948 | 100 |
| Betaferon | Интерферон-b 1B | Schering AG | 844 | 92 |
ЕВРОПА ОПЕРЕДИЛА США
О том, что Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) выдало разрешение на маркетинг первого аналогичного биологического ЛС (последующей версии, follow-on version), мы узнали только на днях. Предшествовал этому довольно долгий период неопределенности.
В апреле 2006 г. федеральный суд США предписал FDA принять решение по поводу заявки на получение разрешения на маркетинг аналогичного биологического препарата Omnitrope. Компания «Sandoz» обратилась в FDA по поводу этого препарата еще в 2003 г., тогда как референтный препарат Genotropin компании «Pfizer» получил разрешение на маркетинг в 1995 г. В августе 2004 г. FDA сообщило «Sandoz», что не может принять решения относительно Omnitrope в связи с наличием неразрешенных научных и правовых проблем. В сентябре 2004 г. компания подала иск в американский окружной суд округа Колумбия, указав, что по законодательству США при получении заявки FDA обязано действовать. Суд решил, что агентство не сообщило ни о каких «непреодолимых факторах», которые могли бы оправдать промедление с принятием решения по Omnitrope («Scrip», 2006). Наконец, 31 мая 2006 г. компания «Sandoz» получила разрешение на маркетинг в США препарата Omnitrope. C ноября 2005 г. он находится на рынке Австралии, уже выведен на рынок Германии. На период до конца года планируется лонч препарата в других европейских странах ().
30 октября 2005 г. в ЕС введено в действие руководство, в котором описан механизм получения разрешения на маркетинг аналогичных биологических ЛС (Guideline On Similar Biological Medicinal Products). Кроме него, принят еще ряд руководств и созданы проекты других. В январе–феврале 2006 г. Европейским агентством по оценке лекарственных средств (European Medicines Evaluation Agency — ЕМЕА) были приняты первые позитивные заключения относительно аналогичных биологических ЛС. Признано, что препарат Omnitrope («Sandoz GmbH»), содержащий рекомбинантный гормон роста, согласно результатам сравнительных исследований качества, эффективности и безопасности является аналогичным референтному препарату Genotropin. Аналогичное решение принято и относительно другого препарата гормона роста — Valtropin («BioPartners GmbH»).
Для доказательства того, что продукт является аналогичным биологическому ЛС, уже получившему разрешение на маркетинг в ЕС, требуется проведение сравнительных исследований, подтверждающих, что качество, безопасность и эффективность исследуемого продукта аналогичны таковым референтного ЛС. Препарат сравнения обязательно должен быть зарегистрирован в ЕС, иначе результаты сравнительных клинических испытаний могут иметь только вспомогательное значение. Руководство по аналогичным биологическим лекарственным средствам (СНМР/437/04) описывает подход «аналогичное биологическое ЛС». Возможность его применения зависит от наличия соответствующих аналитических процедур, валидированности производственных процессов, клинического и регуляторного опыта. Подчеркивается, что биологические ЛС труднее охарактеризовать, чем продукт химического синтеза, и к ним не применимы обычные способы определения биоэквивалентности. Различным типам продуктов (рекомбинантным протеинам, производным крови и плазмы крови, препаратам для генной и клеточной терапии) присущи характерные особенности.
Качество аналогичных биологических ЛС, указывается в руководстве, должно соответствовать требованиям модуля 3 приложения I Директивы 2001/83/ЕС, а также всем техническим требованиям Европейской Фармакопеи и дополнительным — в соответствии с руководствами Консультативного научного комитета (Committee for Medicinal Products for Human Use — CHMP) и Международной конференции по гармонизации технических требований к регистрации лекарственных средств для человека (International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use — ICH). Требования к безопасности и эффективности аналогичных биологических ЛС должны соответствовать таковым приложения I Директивы 2001/83/ЕС. Требования, специфичные для отдельных классов ЛС, устанавливаются соответствующими руководствами ЕМЕА/СНМР. Если таковое отсутствует, заявителю рекомендуется обращаться за поддержкой в европейские регуляторные органы. Дополнительные руководства, посвященные качеству, неклиническим и клиническим аспектам разработки аналогичных биологических ЛС, доступны на сайте www.emea.eu.int
Следует отметить, и это подчеркивается в руководстве, что аналогичные биологические ЛС не являются генерическими, поэтому следует иметь ввиду: между ЛС различных производителей могут существовать небольшие отличия, которые могут быть неизвестны, пока не появится соответствующий опыт. Поэтому особое внимание уделяется необходимости фармаконадзора за биологическими продуктами.
ПРОБЛЕМЫ ПРОИЗВОДСТВА
Принципиальное отличие ЛС биологического происхождения и продуктов химического синтеза обусловлено особенностями процессов производства. Если в случае с последними поэтапное выполнение производственных операций приводит к совершенно предсказуемым результатам, то при изготовлении биологических ЛС в качестве «минилабораторий» используют живые клетки. Каждый производственный цикл приводит к созданию уникального продукта, а минимальные различия в способах производства могут серьезно сказываться на свойствах продукта. Поэтому даже если физические, химические и биологические свойства продукта тщательно изучены и описаны, это не гарантирует терапевтической эквивалентности двух биологических препаратов, изготовленных в различных условиях.
В отличие от ЛС, полученных путем химического синтеза, имеющих сравнительно простую структуру действующего вещества с молекулярной массой около 300 Да, биологические ЛС обычно представляют собой белковые молекулы (4500–27000 Да) с определенной третичной структурой. Производство биологических ЛС намного сложнее изготовления синтетических продуктов и включает многочисленные этапы экстракции, очищения и концентрирования, во время которых могут происходить денатурация и ренатурация протеина, меняться биологические свойства белка. То есть свойства биологического ЛС в значительной степени зависят от производственного процесса, и, как говорят многие исследователи, «процесс производства — это продукт» (Schellekens H., 2004).
Проблема сохранения свойств биологических препаратов приобретает особую важность при внесении изменений в производственный процесс, поскольку при различных методах производства два препарата считаются эквивалентными только при сопоставимости их безопасности, эффективности и качества. Существует ряд примеров, которые показывают, что незначительные изменения могут привести к значимым последствиям. ЕМЕА созданы специальные руководства (Guideline on comparability of Medicinal Products Containing the Biotechnology-derived proteins as Active Substance: Nonclinical and Clinical Issues. ЕМЕА, 2000), в которых описано, каким образом те или иные изменения производственного процесса влияют на характеристики продукта и в каких случаях может понадобиться клиническая оценка изменений.
Производитель аналогичного биологического ЛС не может в точности продублировать процесс производства оригинального продукта. Такой производитель не имеет доступа к информации производителя оригинального препарата относительно процесса производства, включая стандартные операционные процедуры и требования, предъявляемые к исходным материалам на различных стадиях процесса. Поэтому для получения разрешения на маркетинг аналогичный биологический препарат следует рассматривать как совершенно новый продукт, который необходимо сопровождать документальным подтверждением качества, безопасности и эффективности, указывается в европейском руководстве.
ИММУНОГЕННОСТЬ
Практически все белковые препараты индуцируют выработку антител у людей, хотя частота их продукции варьирует в зависимости от препарата. Большинство препаратов, содержащих белок, — гомологи протеинов человека. Примеси и побочные соединения являются основными факторами, нарушающими толерантность. На выработку антител могут влиять также ряд других факторов (табл. 4). Важно учитывать иммуногенные свойства белковых препаратов, которые могут возникать во время хранения или транспортировки. Известным примером этого является окисление лиофилизированного интерферона-a 2А во время хранения при комнатной температуре, что приводит к образованию соединений с высокой иммуногенностью.
Наиболее серьезные осложнения возникают вследствие продукции антител к эндогенным белкам при введении чужеродных веществ. Такая перекрестная реакция послужила механизмом возникновения истинной эритроцитарной аплазии у больных с заболеваниями почек в результате изменения формы выпуска и применения подкожного введения препарата эритропоэтина-a. Истинная эритроцитарная аплазия была обусловлена высокими титрами нейтрализующих антител, продукцию которых индуцировал эритропоэтин-a (Schellekens H., 2004).
Таблица 4
Факторы, влияющие на иммуногенность терапевтических протеинов
| Характеристики протеинов | Степень гликозиляции; механизм действия (иммуномодулирование) |
| Характеристики продукта | Недостаточная очистка в процессе изготовления (например, протеины организма-носителя, ДНК «хозяина»; примеси, связанные с продуктом (например, окисленные молекулы, денатурированный протеин)); форма выпуска |
| Характеристики пациента | Патология; генетические особенности; пол и возраст; прием других ЛС |
| Метод применения | Путь введения; продолжительность применения |
| Другие факторы | Хранение и транспортировка продукта |
Как и в случае с биологическим действием препаратов биологического происхождения, иммуногенность не может быть спрогнозирована, исходя только из физико-химических характеристик продукта, анализа эпитопов или исследований на животных. Тестирование человеческих белков у животных не может служить прогнозирующим фактором их иммуногенных свойств у людей, так как эти гомологи являются чужеродными для животных и, таким образом, по определению будут индуцировать антителообразование. Тем не менее некоторые модели животных могут применяться для исследования иммуногенности биологических препаратов (трансгенные мыши). Но эту модель не следует использовать для прогнозирования частоты и выраженности иммуногенности у людей, в частности белков с низкой иммуногенностью, таких как эритропоэтин и инсулин.
Иммуногенность белковых препаратов может привести к серьезным осложнениям или снижению эффективности лекарственных средств, которые зачастую являются единственным выбором в лечении тяжелых заболеваний. В свою очередь, клинические исследования являются единственным приемлемым способом оценки иммуногенности биологических препаратов и для их проведения необходимы стандартизированные аналитические процедуры (Schellekens H., 2004).
КОМПАНИИ-ПЕРВОПРОХОДЦЫ
Однако несмотря на ряд трудностей, возникающих на пути аналогичных биологических ЛС, многие производители стремятся участвовать в рождении нового направления. «Datamonitor» называет компании «Sandoz» («Novartis AG»), «Teva», «BioPartners», «Biogenerics» (ratiopharm) и «Bioceuticals» («Stada Arzneimittel») пятью ключевыми игроками в сфере создания аналогичных биологических ЛС. Основным преимуществом таких препаратов является потенциально более низкая по сравнению с оригинальными препаратами стоимость благодаря сокращению необходимого для разработки времени и вложенных в этот процесс материальных средств. Разработка аналогичных биологических ЛС может существенно повлиять на жизненный цикл препаратов и увеличить конкуренцию, что также может привести к снижению стоимости лечения. Тим Ольдхем (Tim Oldham), председатель комитета биотехнологий и биологических генерических препаратов Европейской ассоциации производителей генерических препаратов (European Generics Association’s (EGA) biotechnology and biosimilars committee), утверждает, что выведение на рынок первых 6 биогенериков позволит снизить затраты европейской системы здравоохранения на 2 млрд евро, что в свою очередь предоставит возможность дополнительно 500 000 пациентам с почечной недостаточностью получить терапию эритропоэтинами (). Ожидается, что в 2006 г. в EMEA будет подано еще 8 заявок на получение разрешений на маркетинг аналогичных биологических ЛС. n
Татьяна Власюк, Дарья Полякова

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим