|
|
Доклад Виктора Чумака, директора ГФЦ МЗ Украины, был посвящен проблеме доказательства и обеспечения взаимозаменяемости ЛС.
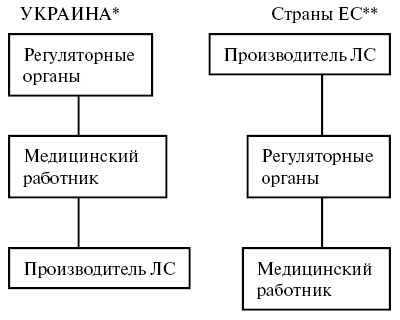
Проводя экспертизу регистрационных документов, мы должны четко понимать, что зависит, и что не зависит от производителя, — отметил В. Чумак. После поступления препарата в организм происходит высвобождение действующего вещества с последующим растворением последнего. Факторы, влияющие на два этих процесса — и есть сфера ответственности компании. После перехода лекарственного средства в растворенное состояние и начала всасывания все зависит от природы действующего вещества и особенностей больного. Таким образом, мы разделяем вклад производителя, от которого зависят процессы, происходящие с лекарственным средством до его поступления в кровь (рисунок), и дальнейшее взаимодействие препарата с организмом (модификация этого взаимодействия — это задача, связанная с открытием (discovery, в отличие от development — разработки) лекарственного средства — прим. ред.).
Завершая свое выступление, В. Чумак подчеркнул особую роль постмаркетинговых испытаний ЛС, которые выполняют особую роль, связанную с тем, что перенос результатов экспериментальных исследований на клинику не всегда корректен, клинические испытания проводят на ограниченной популяции людей, соответствующих определенным критериям включения/исключения. Таким образом, только постмаркетинговые исследования позволяют оценить соотношение польза/риск в реальных условиях, с учетом полиморбидности, полипрагмазии и генетических особенностей пациентов.
Рассказ о регуляторных требованиях к исследованиям и регистрации ЛС мы продолжим в следующих выпусках, а сейчас остановимся на освещении одного из главных заседаний, посвященного фармаконадзору и особенно роли производителей в осуществлении контроля за безопасностью ЛС. Ведь ни для кого не секрет, что отечественные производители долгое время не занимались отслеживанием эффективности и безопасности ЛС после выведения их на рынок. Только некоторые из них внедряют систему фармаконадзора на своих предприятиях, и далеко не все представительства иностранных компаний надлежащим образом осуществляют фармаконадзор в Украине, тогда как в США и странах Европы именно производители играют основную роль в мониторинге эффективности и побочных явлений при применении ЛС. По данным Центра по оценке и исследованию лекарственных средств (Center for Drug Evaluation and Research) Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration), сообщения от производителей составляют 93,8% всех сообщений о ПР ЛС. У производителей ЛС, представляющих свои продукты на фармацевтическом рынке не одно десятилетие, требования корпоративной политики в отношении безопасности своей продукции достаточно высоки, что в конечном итоге и определяет имидж компании.
Как совершенно справедливо заметили ведущие украинские эксперты по фармаконадзору, в отдел фармаконадзора ГФЦ МЗ Украины поступает информация о ПР из разных стран (Германии, Греции, Африки и Азии и пр.), где зарегистрировано то или иное ЛС. Предоставляются данные о том, насколько тот или иной препарат эффективен и безопасен у французов, американцев, индийцев или голландцев. И лишь в Украине существует практически полный информационный вакуум, как будто бы такого явления, как ПР, с точки зрения производителя ЛС, в нашей стране вовсе нет. Вместе с тем, необходима информация об эффективности и безопасности ЛС при их медицинском применении именно у граждан Украины — ведь не секрет, что в условиях реального здравоохранения и фармакологический эффект, и ПР зависят, в том числе, и от популяционных и этнических особенностей, на которые влияют различные факторы (медико-биологические, социальные, экологические и др.).
|
Выступивший на семинаре начальник отдела фармаконадзора, доктор медицинских наук, профессор Алексей Викторов рассказал в своем докладе о роли производителя в осуществлении контроля за безопасностью ЛС при их медицинском применении в Украине.
Соотношение польза/риск, отметил А. Викторов, становится краеугольным камнем современной рациональной фармакотерапии и призвано служить главным образом обеспечению неукоснительного соблюдения прав человека, потому что все, касающееся человеческого здоровья, находится в жестком правовом поле. Украина гармонизирует свое законодательство с международным в области организации фармаконадзора, и на данном этапе развития фармацевтической отрасли Украины оно является вполне удовлетворительным. Главное — четко выполнять все требования.
|
Фармаконадзор представляет собой научную область и практическую деятельность, которая связана с выявлением, оценкой, пониманием и профилактикой неблагоприятных негативных последствий или какой-либо другой проблемы, имеющей отношение к ЛС (ВОЗ, 2004) |
Говоря словами И.П. Павлова, подчеркнул А. Викторов, истинное представление о «физиономии лекарства» (в его медицинском понимании), о его эффективности и безопасности может быть получено, как правило, после 10 и более лет медицинского применения у больных различных категорий (дети, беременные, пожилого возраста, больные с поражением функций почек, печени и т.д.). Именно поэтому такое большое внимание специалисты ГФЦ уделяют не только дорегистрационным, но и постмаркетинговым исследованиям, проводящимся после того, как препарат уже выведен на рынок и широко применяется в клинической практике.
А. Викторов также призвал присутствующих избегать в материалах, касающихся свойств ЛС, — будь то реклама, информация для специалистов или статьи в масс-медиа для широкой аудитории, — лукавства в описании безопасности препаратов. «Никогда не было и не будет абсолютно безопасных ЛС», — отметил он.
|
ПР — любая реакция на ЛС, вредная и нежелательная для организма, которая возникает при назначении препарата в обычной дозе для лечения, диагностики, профилактики заболеваний или модификации функций организма (ВОЗ, 2004) |
Говоря об источниках информации о ПР, начальник отдела фармаконадзора более подробно остановился на анализе спонтанных сообщений, которые должны поступать не только от врача или провизора, но и от самого производителя. «В развитых странах мира производитель является непосредственным и основным участником информирования о ПР ЛС в системе фармаконадзора, в то время как в Украине основным источником информирования о ПР ЛС продолжает оставаться врач. Производители лучше кого бы то ни было знают свои препараты, они заинтересованы в их качестве и отвечают не только за их эффективность, но и за безопасность. Поэтому именно производитель в большинстве стран мира организовывает и проводит различные пострегистрационные исследования, которые позволяют после выведения ЛС на рынок уточнить данные о ЛС, полученные в ходе клинических испытаний, дополнить их новыми сведениями об эффективности и безопасности, а также изучить другие аспекты применения препарата», — подчеркнул А. Викторов.
|
Минимум необходимой информации о ПР (первичное сообщение): • данные о лице, сообщающем о ПР (ФИО, адрес, квалификация); • данные о пациенте (ФИО или идентификационный номер, пол, дата рождения, возраст или возрастная группа); • описание ПР (дата появления, симптомы, продолжительность); • подозреваемое ЛС. |
Основной целью осуществления фармаконадзора производителем ЛС является определение возможных рисков при применении ЛС и принятие соответствующих мер. Основными задачами мониторинга безопасности препаратов являются сбор информации о ПР и их оценка, репортирование о ПР в контролирующие органы, генерация PSUR (периодически обновляемых отчетов по безопасности ЛС — Periodic Safety Update Reports), внесение изменений в инструкцию по медицинскому применению ЛС с последующим информированием медицинских работников, провизоров, производителей, пациентов, а также разрешение различных экстренных ситуаций, связанных с применением и безопасностью препаратов. Такой мониторинг позволяет оценить преимущества данного ЛС перед уже существующими. Согласно нормативным документам (приказ МЗ Украины от 27.12.2006 г. № 898 «Об утверждении Порядка осуществления надзора за побочными реакциями лекарственных средств, разрешенных к медицинскому применению») производитель ЛС обязан информировать регуляторный орган:
– обо всех подозреваемых ПР ЛС (ожидаемых и неожидаемых);
– о случаях отсутствия терапевтического эффекта ЛС, которые возникли при:
• опасных для жизни ситуациях, связанных с применением ЛС,
• неотложных состояниях;
• о случаях, когда отсутствие эффекта у ЛС может угрожать жизни пациента.
|
Право пациента — получать высококачественную лекарственную помощь. |
А. Викторов жестко, но справедливо оценил отечественную ситуацию с мониторингом производителями безопасности применения их ЛС при их медицинском применении: «Большинство производителей в Украине не считают своим долгом и гуманитарной миссией исследовать безопасность препаратов в нашей стране, в реальных условиях. Поэтому очень часто в досье о ПР можно встретить сообщения об исследованиях, проведенных в Соединенных Штатах, Зимбабве или Голландии. Однако нас интересует эффективность и безопасность применения этих препаратов у населения Украины!». По словам докладчика, отдел фармаконадзора подготовил 52 публикации о ПР ЛС различных фармакотерапевтических групп в Украине, тогда как сами производители в отношении информирования общественности о безопасности своих ЛС заняли весьма индифферентную позицию.
|
«Мы видим, что производители препаратов очень неохотно идут на то, чтобы выполнять международные требования по определению рисков, связанных с применением ЛС, хотя Украина своевременно начала процесс гармонизации своего законодательства с международным и приложила максимум усилий для того, чтобы сделать прозрачным и понятным тот путь, который проделывает ЛС от выдачи регуляторными органами лицензии и до поступления в аптеки», — отметил А. Викторов.
|
Куда сообщать о ПР? Вся информация направляется в ГФЦ МЗ Украины по почте, телефону, электронной почте, телеграфом: • Отдел фармаконадзора ГФЦ МЗ Украины, ул. Чигорина, 18, Киев-42, 01042 • тел./факс: (044) 286-75-05 • e-mail: |
Вместе с тем все сотрудники компании-производителя несут ответственность за незамедлительное информирование обо всех подозреваемых ПР ЛС регионального представителя по фармаконадзору, который в свою очередь должен проинформировать регуляторные органы (рисунок).
Вместе с тем, действия при получении информации о ПР совершенно не сложны и по силам каждому сотруднику компании — необходимо просто записать минимум информации и на ее основании заполнить форму-сообщение (приложение 5 к приказу МЗ Украины от 27.12.2006 г. № 898) или форму Совета международных научно-медицинских организаций (Council for International Organizations of Medical Sciences — CIOMS, ), после чего направить ее специалисту компании по фармаконадзору, который в свою очередь должен проинформировать регуляторный орган.
|
Все сотрудники компании-производителя несут ответственность за незамедлительное сообщение обо всех подозреваемых ПР ЛС. |
Отсутствие оперативной информацией о ПР ЛС, отметил в заключение выступления А. Викторов, не дает возможности производителю иметь четкое представление о ситуации относительно безопасности применения препаратов собственного производства и своевременно реагировать на разные, в том числе неблагоприятные ситуации.
|
О ПР необходимо сообщить производителю или непосредственно в ГФЦ по телефону, факсу или электронной почте.
|
Елена Матвеева, заместитель начальника отдела фармаконадзора, кандидат медицинских наук, подробно остановилась на составлении PSUR как одной из составных частей осуществления фармаконадзора производителем ЛС.
«Обеспечение функционирования надлежащей системы сбора, оценки и предоставления в ГФЦ МЗ Украины достоверной информации о ПР, а также любых других данных, необходимых для оценки риска и пользы при медицинском применении ЛС, является обязательным условием обращения препаратов на фармацевтическом рынке Украины, и нормальное функционирование этой системы обязан обеспечить производитель ЛС», — отметила в начале своего выступления Е. Матвеева.
Украинское законодательство выдвигает четкие требования к фармаконадзору со стороны производителя ЛС. Это — создание, контроль и поддержка функционирования системы по сбору и анализу данных о ПР, информирование регуляторных органов о случаях серьезных ПР, подготовка и предоставление регуляторным органам PSUR, а также предоставление по требованию регуляторных органов дополнительной информации, необходимой для сравнительной оценки соотношения риск/польза при применении ЛС.
PSUR являются одним из важнейших инструментов фармаконадзора. Его цель — установить, отвечают ли сведения, полученные в течение отчетного периода, имеющимся данным по безопасности медицинского применения ЛС во всех странах, где оно зарегистрировано.
Далее докладчик более подробно остановилась на составлении PSUR.
Существует несколько источников информации, с помощью которых производитель может составить PSUR. Это и спонтанные сообщения от медицинских работников, медицинских представителей, провизоров и фармацевтов, данные литературы и полученные при проведении пострегистрационных исследований и т.д.
Также в Украине законодательно установлена периодичность предоставления PSUR в ГФЦ МЗ Украины, которая зависит от длительности пребывания препарата на фармацевтическом рынке. После регистрации в Украине как первой стране мира или с момента международной «даты рождения» ЛС PSUR подается:
— 1 раз в полгода в течение первых 2 лет после получения регистрационного свидетельства;
— 1 раз в год — в течение следующих 3 лет;
— затем — 1 раз в 5 лет, если препарат все еще находится на рынке Украины. Вместе с тем производитель обязан предоставить PSUR немедленно на запрос ГФЦ.
|
|
Контроль безопасности ЛС позволяет сохранить доброе имя производителя и избежать финансовых потерь, предупредить угрозу для жизни и здоровья пациента, вовремя скорректировать дозировку ЛС, обновить информацию о нем. |
Периодичность предоставления PSUR может быть также изменена в том случае, если у ЛС появились новые показания к применению или для него разработаны новые лекарственные формы (которые отличаются от уже зарегистрированных), предусматривающие новые пути введения. Периодичность подачи PSUR изменяется также и при выдаче новой лицензии на ЛС, имеющее тот же качественный и количественный состав действующих и вспомогательных веществ, а также лекарственную форму и путь введения, что и зарегистрированные ранее, а также в том случае, если производитель или владелец регистрационного свидетельства желает подавать PSUR чаще, чем это предусмотрено.
Во время семинара Е. Матвеева провела тренинг, на котором все присутствующие имели возможность попробовать составить такой отчет собственными силами, а если возникали сложности — задать вопросы.
Заканчивая семинар, Е. Матвеева выделила важнейшие положительные моменты PSUR. Такой отчет позволяет:
|
Составление периодически обновляемого отчета о безопасности ЛС (PSUR) позволяет: 1) обобщить все новые данные о безопасности ЛС, полученные из разных источников; 2) подготовить обновленную информацию для пациента; 3) обобщить опыт применения ЛС в разных странах; 4) внести изменения в тактику применения ЛС. |
— обобщить все новые данные по безопасности ЛС, полученные из разных источников;
— подготовить обновленную информацию для пациента;
— обобщить опыт применения препарата в разных странах, а в случае необходимости внести изменения в инструкцию по медицинскому применению ЛС.
Также Е. Матвеева отметила, что контроль за безопасностью ЛС при их медицинском применении со стороны не только производителя, но и всех остальных участников процесса — врачей, провизоров и самих пациентов, — является нормальной европейской и общемировой практикой и позволяет обеспечить право любого гражданина на получение адекватной медицинской помощи, оптимально влияющей на качество жизни пациента. n
Валерий Юдин,
фото Елены Степаненко
|





Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим