Клинические исследования — длительная и дорогостоящая часть процесса разработки новых лекарственных средств, необходимая для подтверждения их эффективности и профиля безопасности. Так, на долю клинических исследований приходится около 2/3 всех расходов по разработке новых лекарственных средств.
Стандартный процесс создания лекарственного средства состоит из 4 этапов, спонсором которых, как правило, является фармацевтическая компания. После удачного завершения доклинического этапа разработки кандидата в препараты стартуют клинические исследования, проводимые согласно требованиям надлежащей клинической практики (Good Clinical Practice — GCP).
Клинические исследования включают 4 фазы:
- I фаза: первоначальное изучение профиля безопасности лекарственных средств, фармакокинетических показателей, выявление побочных реакций и влияния на пищеварительную систему. На этом этапе, как правило, задействовано небольшое количество здоровых добровольцев (в среднем 50–100);
- II фаза: более детальное изучение профиля безопасности и характеристик препарата в зависимости от дозы. На этом этапе также проводятся первые сравнительные исследования, например, результаты применения исследуемого препарата по сравнению со стандартным лечением и плацебо. Пациенты распределяются на группы методом рандомизации. Механизм действия препарата и его профиль безопасности изучаются в рамках небольшой группы (300–600 пациентов);
- III фаза: самая длительная и дорогостоящая часть клинических исследований, в ходе которой получают окончательные данные об эффективности препарата. Выборка пациентов и дизайн исследования аналогичны II фазе, однако обычно количество пациентов, задействованных в исследовании, намного больше — оно может варьировать от нескольких сотен до нескольких тысяч человек. Успешное завершение III фазы клинических исследований позволяет подавать заявку на регистрацию лекарственного средства;
- IIIB/IV фаза: представляет собой дополнительные исследования, которые проводятся уже после лонча препарата с целью подтверждения его эффективности при дополнительных показаниях, а также для доказательства достоверности ранее полученных данных, подтверждения эффективности препарата в долгосрочной перспективе.
В клиническом исследовании задействовано несколько ключевых сторон: спонсор, контрактно-исследовательская организация (КИО), исследователи, лечебно-профилактические учреждения (ЛПУ) и пациенты.
В большинстве случаев спонсорами клинических исследований выступают фармацевтические компании. Однако некоторые проекты финансируются за счет академических учреждений (институтов) и исследовательских центров. В первом случае клинические исследования либо выполняются фармкомпаниями самостоятельно, или передаются на аутсорсинг независимым КИО. КИО в отличие от интегрированных фармкомпаний специализируются исключительно на организации клинических исследований. Доля КИО в структуре мирового рынка клинических исследований в денежном выражении составляет около 25%, а этот показатель для стран Центральной и Восточной Европы (ЦВЕ) и СНГ оценивается на уровне 50–60%. Для проведения исследования КИО и фармкомпании заключают договор с мониторами клинических исследований (clinical research associate) — квалифицированным персоналом, ответственным за мониторинг процесса и сотрудничество с исследователями.
С миру по нитке
Мировой рынок клинических исследований, согласно данным аналитической компании «PricewaterhouseCoopers», оценивается на уровне 50–80 млрд дол. США.
Несмотря на неопределенность прогнозов касательно изменения расходов на R&D, согласно данным отчета «PricewaterhouseCoopers» ожидается, что изменение объема рынка клинических исследований и в дальнейшем сохранит положительную динамику. При этом пока остается неясно, за счет каких стран будет обеспечена такая динамика. Это во многом зависит от того, какие государства сумеют привлечь большее количество клинических исследований и воспользоваться результатами этого роста.
Согласно информации, опубликованной на интерактивном сервисе ClinicalTrials.gov, созданном Национальным институтом здоровья США (National Institutes of Health — NIH) при сотрудничестве с Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) во исполнение «FDA Modernization Act», по итогам 2011 г. во всем мире зарегистрировано более 18 тыс. клинических исследований. В региональном разрезе наибольшее количество клинических исследований проводится в Северной Америке, 2-ю позицию удерживает Европа, а тройку лидеров замыкает Восточная Азия (рис. 1). Ключевыми рынками последней стали Китай (677 проектов) и Южная Корея (774 проекта).
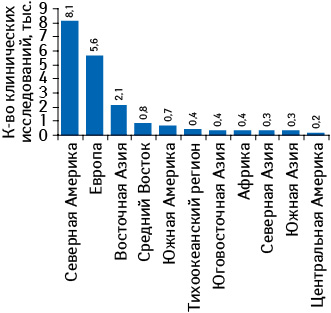
Среди стран ЕС наибольшие инвестиции в сфере клинических исследований по итогам 2011 г. были привлечены в Великобритании. В этой стране отмечается наибольшее среди государств — членов ЕС количество персонала, задействованного в клинических исследованиях (рис. 2). При этом, по данным, указанным на интерактивном сервисе ClinicalTrials.gov, наибольшее количество клинических исследований по итогам прошедшего года было зарегистрировано в Германии (рис. 3). Следует отметить, что в топ-10 стран с наибольшим количеством клинических исследований, зарегистрированных в 2011 г., в отличие от топ-10 государств по объему инвестиций в эту сферу, вошла Польша, что может косвенно свидетельствовать об относительно низкой стоимости проведения клинических исследований в этой стране. Проведение клинических исследований в странах ЦВЕ и СНГ способствует притоку зарубежных инвестиций, поскольку часто спонсорами выступают крупные мультинациональные фармкомпании.
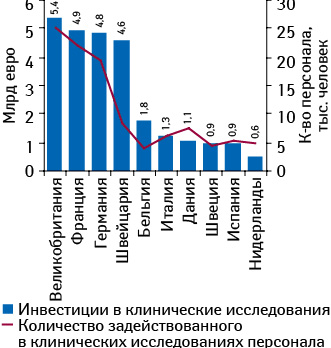
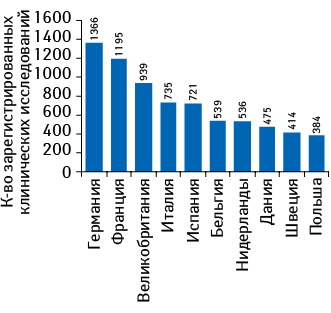
Многие мультинациональные фармацевтические компании широко представлены на рынке клинических исследований стран ЦВЕ и СНГ в разрезе количества центров, с которыми они сотрудничают. К таким компаниям относятся «AstraZeneca», «Bristol-Meyers Squibb», «GlaxoSmithKline», «Johnson&Johnson», «Pfizer», «Sanofi» и др.
Ближайшие соседи: Польша
Польша является крупнейшим рынком клинических исследований в странах ЦВЕ и СНГ.
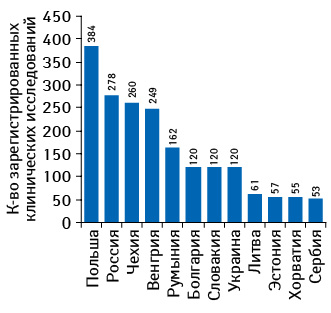
По данным интерактивного сервиса ClinicalTrials.gov, по итогам 2011 г. Польша является лидером по количеству зарегистрированных клинических исследований не только среди стран ЦВЕ, но и среди стран СНГ (рис. 4). Согласно данным, представленным в докладе ВОЗ «Clinical Trials Registry Platform data», последние несколько лет Польша удерживает максимальную долю по количеству проводимых клинических исследований среди стран ЦВЕ, Юго-Восточной Европы (ЮВЕ), СНГ, что главным образом обусловлено большим абсолютным размером рынка. Она аккумулирует около 20% всех проектов по клиническим исследованиям в Восточной Европе. При этом страны ЦВЕ с меньшим количеством населения, например Чехия и Венгрия, проводят больше клинических исследований из расчета на душу населения. Кроме того, Польша является лидером по количеству пациентов из расчета на одно клиническое исследование. Важно отметить, что более чем у половины фармацевтических компаний, представленных на польском рынке, для 80% новых препаратов проводили клинические исследования в Польше.
Прирост рынка клинических исследований Польши, по данным аналитической компании «PMR», в 2009 и 2010 г. находился на уровне 1–2% по сравнению с предыдущим годом, что было связано с последствиями экономического кризиса, который привел к сокращению расходов на R&D-проекты, в том числе и на клинические исследования. В 2011 г. объем рынка клинических исследований увеличился на 7% по сравнению с предыдущим годом и достиг 756 млн польских злотых (184 млн евро). Ожидается, что к 2014 г. его объем достигнет 860 млн злотых (200 млн евро). При этом среднегодовой прирост в 2012–2014 гг. будет на уровне 5%. Прогнозируется, что в 2014 г. атмосфера на рынке клинических исследований Польши значительно улучшится и это будет связано с ожидаемым принятием закона о клинических исследованиях, который урегулирует договорные отношения на рынке и создаст благоприятные условия для дальнейшего его развития. Согласно опросу, проведенному «PMR», ключевыми факторами, которые могут позитивно повлиять на развитие рынка клинических исследований в Польше, являются урегулирование законодательной базы и упрощение процедуры регистрации клинического исследования. Кроме того, гораздо больше респондентов по сравнению с опросами, проведенными в предыдущие несколько лет, считают, что необходимо уточнить вопросы, связанные с договорными отношениями. В частности, этот вопрос может быть решен посредством урегулирования механизма заключения договоров между спонсором, исследователями и медицинскими учреждениями. МЗ Польши планирует внедрить эти изменения в ходе принятия закона о клинических исследованиях.
Следует отметить, что количество потенциальных участников клинических исследований и широкий выбор различных медицинских учреждений, в которых возможно их проведение, свидетельствуют о перспективе дальнейшего роста рынка клинических исследований Польши. Так, основными драйверами польского рынка клинических исследований являются численность населения, быстрота набора пациентов и высокое качество выполнения работы, а также членство в ЕС и гармонизированное законодательство.
Структура Европейского рынка клинических исследований
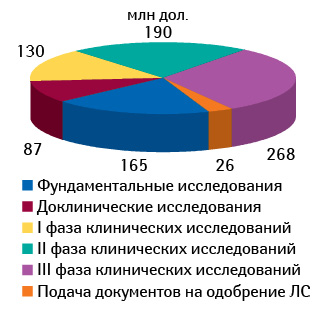
Клинические исследования аккумулируют львиную долю расходов на разработку инновационного препарата (рис. 5). Так, их доля составляет 68% всех расходов. При этом в разрезе фаз клинического исследования наиболее затратной является III фаза — 31% расходов на разработку нового препарата.
Большинство проводящихся в Европе клинических исследований согласно данным, опубликованным в докладе «Clinical trials in Central Europe 2012. Development forecasts for 2012–2014» компании «PMR», относятся к III фазе — это около 58% из 2460 проектов (по состоянию на март 2012 г.) (рис. 6). При этом разброс данного показателя в различных странах Центральной Европы относительно небольшой — от 53% в Польше до 67% в Словакии. Количество проводимых клинических исследований во II фазе варьирует в диапазоне 14–24% (в среднем 23%). На долю I и IV фазы клинических исследований приходится наименьшее число проектов, осуществляющихся в Центральной Европе, — 3 и 8% соответственно.
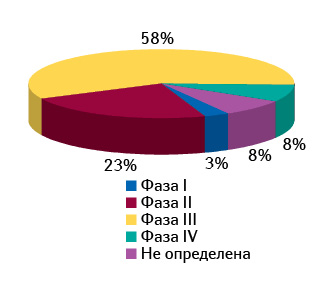
Несмотря на то что в странах ЦВЕ, ЮВЕ, СНГ преобладают клинические исследования III фазы, в среднесрочной перспективе прогнозируется некоторое увеличение доли исследований II фазы. Кроме того, ожидается, что в долгосрочной перспективе исследования IV фазы будут перемещаться из стран Западной Европы и США в государства ЦВЕ.
Следует отметить, что, например, в Польше исследования I и II фазы не получили широкого распространения в основном в связи с бюрократическими задержками. При этом клинические исследования I и II фаз являются самым быстрорастущим сегментом польского рынка клинических исследований.
В разрезе терапевтических направлений наиболее распространенными клиническими исследованиями в странах Центральной Европы являются проекты по изучению противоопухолевых препаратов и иммуномодуляторов (рис. 7). Их удельный вес по состоянию на март 2012 г. составляет 34% проводимых клинических исследований. Максимальный показатель среди стран Центральной Европы зафиксирован в Польше (37%), а минимальный — в Болгарии — 29%.
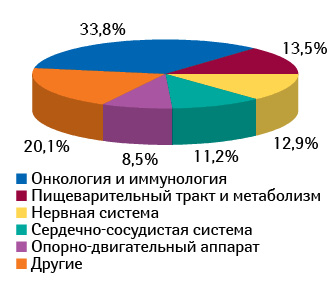
Наиболее популярным направлением на рынке клинических исследований Польши является онкология, доля которой превышает аналогичный показатель в странах Западной Европы. Согласно данным «PricewaterhouseCoopers» удельный вес таких терапевтических направлений, как онкология, кардиология, ревматология и иммунология в Польше составляет почти 60% клинических исследований. Популярность онкологического направления в Польше связана с большим количеством пациентов на поздних стадиях развития заболевания.
Ожидается, что количество новых клинических исследований в странах Центральной Европы в 2012–2014 гг. будет ежегодно увеличиваться на 6–7%. При этом основным драйвером роста будут клинические исследования III фазы в области онкологии.
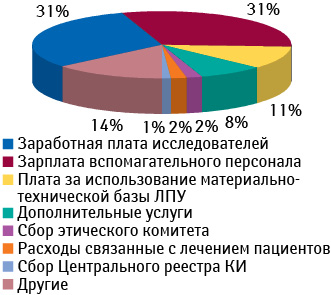
Что же касается структуры расходов на проведение определенного клинического исследования, то на примере Польши в общем виде его можно представить следующим образом (рис. 8). Следует отметить, что наибольшая доля расходов приходится на выплату заработной платы исследователям и вспомогательному персоналу. Также больших затрат требует использование материально-технической базы ЛПУ — около 11%.
Клинические исследования в странах СНГ
Согласно отчету PMR «Clinical trials in CIS countries 2012 — Russia, Ukraine, Belarus and Georgia. Development forecasts for 2012–2014», общий рынок клинических исследований стран СНГ в 2011 г. составил 429 млн евро, что на 19% больше по сравнению с предыдущим годом. Львиная доля рынка клинических исследований стран СНГ принадлежит России — 63%. Удельный вес Украины оценивается на уровне 33%. Согласно прогнозам PMR на 2012–2014 гг. ожидается, что средний прирост рынка клинических исследований СНГ будет на уровне 14% в денежном выражении, а в 2014 г. этот рынок достигнет 712 млн евро.
Ключевыми рынками клинических исследований среди стран — членов СНГ являются Украина и Россия, чьи показатели прироста одни из самых высоких. По мнению представителей компании «PricewaterhouseCoopers», это обусловлено сравнительной низкой стоимостью проведения клинических исследований в этих странах.
Украина является вторым по величине рынком в СНГ после России. При этом в соответствии с «European Business Association data» Украина использует только 10–15% своего потенциала в сфере клинических исследований. Сравнительно небольшой объем рынка клинических исследований Украины и его огромный потенциал являются основными причинами, по которым прогнозируемые «PMR» темпы прироста оцениваются на уровне по крайней мере 10–20% в течение ближайших 3 лет.
Экономический эффект от проведения клинических исследований
Экономический эффект проведения клинических исследований отмечается в отношении различных групп заинтересованных сторон. Условно воздействие, которое оказывает на рынок проведение клинических исследований, можно разделить на материальное и нематериальное. Среди материальных эффектов можно выделить:
- сборы и налоги в государственный бюджет;
- альтернативный путь экономии средств плательщиков в сфере здравоохранения;
- обеспечение и улучшение инфраструктуры мест проведения клинических исследований;
- обеспечение занятости или других экономических стимулов для компаний, оказывающих услуги в рамках организации и проведения клинических исследований.
К нематериальным эффектам, возникающим вследствие проведения клинических исследований, можно отнести:
- получение пациентами доступа к золотым стандартам лечения;
- обмен опытом, передача знаний об инновационных подходах;
- возможность профессионального развития и получения опыта для исследователей и врачей.
Согласно результатам опроса, проведенного «PricewaterhouseCoopers» среди топ-менеджмента фармацевтического бизнеса в Польше, большинство респондентов считают, что ключевыми преимуществами проведения клинических исследований являются их вклад в развитие экономики и предоставление пациентам доступа к передовым методам лечения.
Вклад в государственный бюджет
Проведение в стране клинических исследований способствует увеличению поступлений в государственный бюджет. Например, в Польше, по данным «PricewaterhouseCoopers», около 25% доходов, полученных от проведения клинических исследований, поступает в государственный бюджет. В денежном выражении они оцениваются на уровне 220 млн злотых в год. Эта сумма содержит налоги, выплачиваемые непосредственно спонсорами и КИО, в том числе корпоративный подоходный налог, подоходный налог с физических лиц, НДС и пр. Кроме того, в государственный бюджет поступают средства, полученные в качестве сборов административными органами. Например, в Польше размер сборов, собранный Центральным реестром клинических исследований и этическим комитетом, оценивается на уровне 20 млн злотых в год. Кроме того, в государственный бюджет поступают налоги, уплачиваемые другими заинтересованными группами, например соисследователями (подоходный налог), НДС (через приобретение товаров, необходимых для организации и проведения клинических исследований) и др.
Альтернативный путь экономии средств
За счет проведения клинических исследований появляется возможность сократить государственные (или других плательщиков) расходы на здравоохранение благодаря финансированию этих проектов спонсорами. Спонсор часто полностью оплачивает лечение участника исследования — включая рутинную его часть, вспомогательные процедуры. Это избавляет государство от необходимости оплачивать медицинскую помощь, оказываемую пациенту, — участнику клинических исследований.
Кроме того, как правило, в ходе клинических исследований обеспечиваются более высокие стандарты предоставления медицинской помощи и применяются современные стандарты терапии.
Масштабы такой альтернативной экономии средств для плательщиков в сфере здравоохранения могут различаться в зависимости от специфики конкретного клинического исследования, базы, на которой оно проводится, и прочих факторов. На этом фоне наиболее ярким примером экономии средств плательщиков в сфере здравоохранения является проведение клинических исследований в таких терапевтических направлениях, как онкология и кардиология.
В качестве примера также можно привести объемы экономии, которые отмечают благодаря проведению клинических исследований по онкологии в Польше. Так, в этой стране около 4% пациентов с онкологическими заболеваниями когда-либо принимали участие в клинических исследованиях. Таким образом, их лечение в значительной степени финансируется спонсорами. По оценкам «PricewaterhouseCoopers», в Польше около 20% прямых затрат на лечение пациентов с онкологической патологией оплачивается за счет спонсоров. Необходимо обратить внимание и на большую распространенность клинических исследований по онкологии в Польше.
Следует отметить, что если стоимость кандидатов в препараты, использующихся в ходе клинических исследований, является скорее виртуальной, то влияние клинических исследований на расходы на здравоохранение достаточно реально. Так, по оценкам «PricewaterhouseCoopers», использование только рутинного лечения могло бы привести к увеличению объема фармацевтического рынка примерно на 50–60%.
Тенденции: экономим и передислоцируемся
Процесс разработки новых препаратов развивается, и в ближайшем будущем его ждут значительные изменения. При этом спонсоры нацелены на разработку подходов, позволяющих значительно повысить эффективность и снизить стоимость первичных исследований, отдавая их на аутсорсинг КИО и предпочитая альтернативные регионы для их проведения, например, страны ЦВЕ.
Основным мировым трендом в сфере разработки лекарственных средств, по мнению представителей компании «PricewaterhouseCoopers», является стремление фармацевтических компаний ускорить процесс создания нового лекарственного средства путем ведения более целенаправленной работы, делая упор на доклинические стадии разработки. Кроме того, ожидается, что спонсоры будут вынуждены сократить расходы на проведение клинических исследований, особенно III фазы, в течение следующих 4–5 лет. Наряду с экономией финансовых ресурсов отмечается тенденция к повышению требований спонсоров к эффективности процесса. Они стремятся повысить продуктивность и экономическую эффективность исследований в первую очередь за счет передачи клинических исследований на аутсорсинг КИО, а также путем перенесения исследовательского процесса в другие регионы.
Например, спонсоры перемещают проведение клинических исследований в развивающиеся страны (Южной Америки или Азии), где их стоимость ниже, а набор пациентов проходит быстрее. Однако существуют и определенные недостатки такой локализации клинических исследований – невысокое качество проведения клинических исследований, непредсказуемость законодательных изменений. Потому большая часть исследовательских проектов по-прежнему проводится в развитых странах. Кроме того, на локализацию процесса клинических исследований также влияют некоторые аспекты маркетингового продвижения продукции. В частности, развитые страны являются крупнейшими рынками для реализации инновационных препаратов, что позволяет им в значительной степени влиять на место проведения клинических исследований.
Северная Америка (США и Канада) — традиционно наиболее крупные рынки клинических исследований. Однако в последние 20 лет все большее внимание спонсоров привлекают страны Центральной и Южной Америки, Ближнего Востока, ЦВЕ, ЮВЕ и СНГ. Их основными преимуществами являются низкая стоимость проведения клинических исследований, а также более быстрый процесс набора пациентов.
По мнению представителей «PricewaterhouseCoopers», страны ЦВЕ являются более привлекательными для спонсоров клинических исследований по сравнению с государствами — членами СНГ, поскольку объем фармацевтических рынков стран ЦВЕ значительно больше, а законодательные изменения более предсказуемы и согласовываются с законодательством ЕС. Спонсоры клинических исследований в большей степени склонны отдавать предпочтение площадкам, которые позволяют снизить расходы на проведение клинических исследований и могут предоставить большое количество пациентов для них с определенным заболеванием, — странам с относительно большой численностью населения.
Ожидается, что в ближайшем будущем возрастет популярность Китая, Индии и стран Ближнего Востока, Латинской Америки в сфере проведения клинических исследований. Однако выбор вышеприведенных площадок несет и некоторые риски, например, сомнения спонсоров вызывает качество патентной системы в Китае и др. В Бразилии, Аргентине и ряде стран Ближнего Востока отмечается увеличение количества проводимых клинических исследований, чему способствуют такие факторы, как большая численность населения и быстрота набора пациентов.
Повышение внимания к продуктивности и экономической эффективности R&D-разработок в целом и клинических исследований в частности привело к активизации процессов аутсорсинга в этой сфере. Аутсорсинг при организации и проведении клинических исследований стали широко использовать во всем мире в течение последних десятилетий, особенно это характерно для тех рынков, на которых фармацевтические компании (спонсоры клинических исследований) присутствуют в меньшей мере или дизайн клинического исследования достаточно сложный. Использование аутсорсинга и сотрудничество с другими компаниями позволяют более эффективно управлять расходами на проведение клинических исследований, что особенно важно в свете того что многие крупные фармкомпании сокращают свои расходы на R&D.
Однако такое развитие событий может быть выгодно для КИО, стоимость организованных которыми клинических исследований ниже по сравнению с развитыми странами (например локализованных в ЦВЕ). Это может повысить их конкурентные характеристики в сфере организации клинических исследований в рамках аутсорсинга.
В ЦВЕ в отличие от мировых тенденций КИО принадлежит большая доля рынка по сравнению с проведением клинических исследований при участии непосредственно спонсора. Например, в Польше большинство клинических исследований организовываются КИО, поскольку присутствие многих фармацевтических компаний на данном рынке несколько ограничено. При этом, согласно результатам, представленным в докладе «PricewaterhouseCoopers», для Польши характерна тенденция к увеличению количества клинических исследований, проводимых при участии КИО.
Кроме того, некоторые компании используют такой подход в организации клинических исследований, как инсорсинг, приглашая персонал КИО на временной основе на работу в компании (на ее материальной базе) в рамках определенного проекта.
Также на рынке разработки инновационных лекарственных средств отмечается активизация процесса консолидации — небольшие R&D-ориентированные компании поглощаются крупными игроками. Таким образом, стремление к повышению эффективности разработок и развитие сотрудничества в этой сфере могут сократить расходы на R&D.
Ожидается, что в долгосрочной перспективе процесс разработки лекарственных средств будет дешевле и короче. При этом повысится роль научно-исследовательских лабораторий, которые разрабатывают действующие вещества. Прогнозируется, что в будущем препарат сначала будет изучаться в ходе высокоспециализированных клинических исследований с участием небольшого количества пациентов, а затем, после получения предварительного одобрения от регуляторных органов, препараты будут допускаться на рынок для ограниченного использования среди узкой группы пациентов. В долгосрочной перспективе этот процесс может привести к полной интеграции клинических исследований в медицинскую практику, что уже начинает происходить в отношении терапии злокачественных новообразований. Таким образом, представители «PricewaterhouseCoopers» прогнозируют, что в будущем клинические исследования станут частью рутинного лечения.
Такому развитию событий будет способствовать растущая поддержка R&D-разработок инновационных лекарственных средств со стороны властей разных стран, обусловленная увеличивающимися потребностями общественности, связанными со здоровьем. При этом значительное внимание будет уделяться соблюдению необходимых мер безопасности при внедрении инновационных методов лечения. Например, в ЕС уже действует подход, предусматривающий предварительную регистрацию инновационных лекарственных средств, что привело к значительному повышению требований, предъявляемых к доклиническому этапу исследований кандидата в препараты.
Таким образом, развитие рынка клинических исследований несет большое количество преимуществ для пациентов, системы здравоохранения и государства в целом. Украина обладает большим потенциалам в этой сфере и мировые тенденции, как ожидается, будут способствовать дальнейшему развитию отечественного рынка клинических исследований.
по материалам www.pwc.com, www.pmrpublications.com, www.clinicaltrials.gov, www.ricerca-clinica.agenziafarmaco.it

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим