Средства современной медицины направлены в основном на уменьшение выраженности симптомов, а не профилактику заболеваний. Вмешиваться в течение патологии с помощью современных фармакотерапевтических средств удается, как правило, только после развития необратимых изменений в организме. При отсутствии достаточного количества информации об особенностях конкретных пациентов и лекарственных препаратов врач лечит среднестатистического больного со среднестатистическим течением заболевания. В действительности же медицина имеет дело с индивидами, имеющими различные генетические особенности, большинство из которых неизвестно врачу. На фоне господства такого «усредненного» подхода хорошо заметны такие тенденции (Lesko J., 2005):
- дефекты современной модели разработки лекарственных средств: замедление и снижение продуктивности инновационного процесса, уменьшение прибыльности фармацевтического бизнеса;
- ведение фармацевтическими компаниями активного поиска новых возможностей благодаря открытиям молекулярной биологии и патофизиологии;
- изменения регуляторной политики: акцент на индивидуальном балансе польза/риск в построфекоксибную эру.
В последние годы разработка новых лекарственных средств становится все более сложной, дорогостоящей и все менее эффективной. В результате количество новых активных фармацевтических ингредиентов (АФИ), выведенных на рынок с 1996–1997 по 2004 г. снизилось на 45%, и вероятность такого развития событий для отдельно взятого нового АФИ теперь на 50% меньше. Лоренс Леско, директор отдела клинической фармакологии и биофармации Управления по контролю за лекарственными препаратами и продуктами питания (Food and Drug Administration — FDA) США отметил, в частности, что затраты на разработку окупаются прибылью от продаж только для 30% препаратов. Проведение клинических испытаний требует все большего вложения средств, а доля препаратов, результаты исследований ІІІ фазы которых были признаны неудовлетворительными, увеличилась с 20% в 1995 г. до 50% в 2004 г. (Lesko L., 2005).
Сегодня выдача разрешения на маркетинг производится на основе изучения эффективности препарата у представителей целой популяции без оценки индивидуальных пользы и риска. Рандомизированные контролируемые испытания, целью которых является отклонение нулевой гипотезы о неэффективности лекарственного средства, не дают возможности выделить и изучить группы ответивших (responders) и неответивших (non-responders) на прием препарата (рис. 1) (Lesko L., 2005).
ГЕНЕТИКА И ФАРМАКОТЕРАПИЯ
Накопление новых знаний о генетической предрасположенности и механизмах развития заболеваний позволило заложить основы нового научного направления, которое сегодня называют целенаправленной, индивидуализированной, точной, умной медициной или фармакогеномикой* (Scientific American, 2004). Вне зависимости от названия новый подход позволяет осуществлять более эффективное лечение благодаря стратификации заболеваний на отдельные подвиды и пациентов в зависимости от индивидуальной предрасположенности, характера патологического процесса и ответа на лекарственную терапию. При этом принимают во внимание так называемые биомаркеры: экспрессируемые белки, гены, полиморфизм единичных нуклеотидов (single—nucleotide polymorphism — SNP, произносится «снипс») и метаболиты. Информация о генетических, фенотипических особенностях пациентов и результатах клинических исследований интегрируется в специальные базы (например, благодаря сотрудничеству IBM и Mayo Clinic собраны данные исследований миллионов пациентов) (Svinte M., 2004). Предполагается, что в результате станет возможным применение только необходимых препаратов у определенных пациентов в нужное время» (Batchelder K.F., 2005).
Установление весной 2003 г. порядка расположения около 3 млрд нуклеотидов, составляющих ДНК 24 человеческих хромосом, стало наиболее сложной завершающей частью проекта «Геном человека». Колоссальное значение этой работы для биологии и медицины многие сравнивают с открытием периодической системы химических элементов. Однако многие вопросы еще остались невыясненными, в том числе: точное количество генов (приблизительно насчитываеся 20—25 тыс), их локализация, функции и регуляция; структура хромосом; координация экспрессии генов, корреляция SNPs с различными видами патологии, вовлеченность генов в детерминацию полигенных заболеваний (www.doegenomics.org).
ГЕНОМИКА В ОПРЕДЕЛЕНИИ ТОЧЕК ПРИЛОЖЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
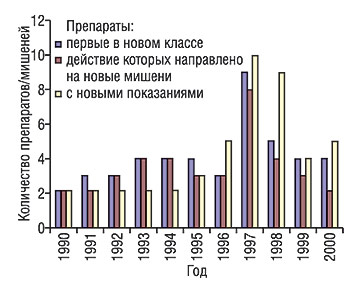
Среди приблизительно 26 тыс. препаратов, имевших разрешение на маркетинг в США к концу 2005 г., 1783 лекарственных средства представляют собой новые активные фармацевтические ингредиенты — АФИ (1415 низкомолекулярных соединений, 180 продуктов биологического происхождения и 18 антител). Общее количество молекулярных мишеней, на которые действуют эти лекарственные средства, составляет 301, 230 из которых находятся в организме человека (ядерные рецепторы, Na+/нейротрансмиттерные симпортеры, семейство G-белков и др.), а остальные — в клетках патогенных микроорганизмов (www.inpharmatica.co.uk). Прогресс в появлении оригинальных препаратов с новыми свойствами показан на рисунке (рис. 2). Сколько и каких потенциальных точек приложения действия лекарственных средств существует в человеческом геноме? Ответ именно на этот вопрос является определяющим в деятельности любой биофармацевтической компании («Human Genome Sciences», «Incyte Genomics», «Celera Genomics» (США) и др.). Появился даже специальный термин «лекарственно-ориентированный геном» (druggable genome). Результаты работ, выполненных исследовательскими подразделениями компаний «Hoffmann-La Roche» и «CuraGen» позволили предположить, что количество таких потенциальных мишеней составляет 3–10 тыс. или более 8 тыс. соответственно (Davies K., 2002). Эти и другие компании подали десятки тысяч заявок на получение патентов на изобретения, связанные с применением генных технологий, и многие из них получили сотни патентов (Wilson A., 2002, www.curagen.com, www.hgsi.com).
По-видимому, как отметил в своем докладе Эндрю Хопкинс, один из руководителей исследовательского подразделения компании «Pfizer», критериев, разработанных Кристофером Липинским для оценки потенциальных лечебных эффектов низкомолекулярных соединений (правило пяти), в случае с веществами других классов явно недостаточно**. Современные биоинформационные технологии позволили Э. Хопкинсу с коллегами определить, что количество потенциальных точек приложения в человеческом геноме составляет приблизительно 10–14% всех генов, то есть равно примерно 3 тыс. Однако клинически значимыми будут эффекты, связанные не с каждой из них, поэтому интересной с медицинской точки зрения станет только доля, исчисляемая единичными процентами (Hopkins A.L., Groom C.R., 2002; Hopkins A., 2004).

Ученые много говорят об ограниченности, фрагментарности накопленных на сегодня знаний о генетической основе фармакотерапии. Действительно, за исключением информации о нескольких ферментах, участвующих в метаболизме лекарственных средств, роль генетического полиморфизма в межиндивидуальных отличиях эффективности и переносимости лекарственных средств не ясна. Более того, большинство исследований фокусируются на последствиях полиморфизма единственного гена. При таком подходе не принимается во внимание тот факт, что ответ больного на прием препарата, как и фенотип большинства заболеваний, является комплексным полигенным феноменом, детерминируемым также негенетическими факторами. К примеру, развитие сахарного диабета II типа связывают примерно с 20 генами (Ausiello D., 2004).
Предполагается, что каталог с описанием полиморфизма SNPs будет создан в недалеком будущем. К настоящему времени в результате совместных усилий представителям науки и фармации удалось идентифицировать 1,8 млн SNPs. Их общее количество, включая некодирующие участки, составляет 10 млн (www.ornl.gov). Информацию об этих вариациях можно будет использовать для прогнозирования фармакологического действия препарата у конкретного пациента. С этой целью необходимо провести исследование ДНК пациента (типирование, секвенцирование***) для выявления наличия той или иной разновидности SNPs. Традиционно применяют микрочипы (микроматрицы, microarray), каждый из которых содержит свыше 100 тыс. различных фрагментов генов (от 500 до 5000 базовых точек каждый). Связывание специфического гена в исследуемом образце вызывает появление определенного сигнала. Относительно применения информации, получаемой в ходе фармакогенетического тестирования, также существуют некоторые ошибочные представления. Даже если тот или иной ген оказывает большое влияние на фармакокинетику или фармакодинамику препарата, наличие SNPs этого гена может означать только некоторую вероятность нарушенного ответа пациента на препарат. При этом обязательно следует учитывать межлекарственные взаимодействия и прочие негенетические факторы (Eichelbaum M., 2005).
ПОЧЕМУ НЕЛЬЗЯ РАССЧИТЫВАТЬ НА ОДИНАКОВЫЙ ЭФФЕКТ У РАЗНЫХ ПАЦИЕНТОВ?
Метаболизм лекарственных средств имеет существенные межиндивидуальные отличия. Они в основном обусловлены полиморфизмом ферментов семейства цитохромов Р450. Множественный аллелизм или повышенная экспрессия генов могут приводить к повышению скорости элиминации лекарственных средств (ультраметаболизм — причина снижения эффективности и необходимости повышения дозы). Наоборот, наличие дефектных аллелей может приводить к замедлению метаболизма (повышается вероятность развития побочных реакций и межлекарственных взаимодействий) (Ingelman-Sundberg M., 2005).
Согласно результатам исследования, 59% препаратов, которые фигурировали в исследованиях побочных реакций, метаболизируются при помощи хотя бы одного энзима 1-й фазы (цитохром Р450). В 38% случаев метаболизм этих лекарственных средств связан с СYP2D6 (Phillips K.A. et al., 2001). Этот изоэнзим осуществляет биотрансформацию примерно 25% всех рецептурных лекарственных средств (Wolf C.R., Smith G., 1999). Замедление метаболизма (poor metabolizers) вследствие недостаточности фермента, кодируемого СYP2D6, наблюдается у 5–10% кавказцев, 2–19% африканцев, 0,5% японцев, 0,7% китайцев; CYP2C19 — у 25% людей родом из Восточной Азии. Пациентов с тремя или более активными аллелями СYP2D6 (свыше 29% людей из Северной Африки и Среднего Востока) называют ультрабыстрыми метаболизаторами. Фенотип, связанный с СYP2D6, особенно важен, если пациенту назначают ингибиторы протонного насоса, трициклические антидепрессанты (ТЦА), типичные антипсихотические средства и рисперидон; CYP2C19 — ТЦА и, возможно, циталопрам и сертралин. Субстратами для СYP2D6 являются амфетамин, дексфенфлюрамин, антиаритмические (мексиллетин, флеканидин, лидокаин), антипсихотические (перфеназин, галоперидол, рисперидон, минаприн и др.), блокаторы бета-адренорецепторов (пропафенон, метопролол, пропранолол, тимолол, карведиол и др.), антидепрессантные (флюоксетин, флювоксамин, пароксетин, амитриптиллин, имипрамин и др.), анальгетические (декстраметорфан, кодеин, трамадол) средства (Leon J. et al., 2006).
Описанные выше категории пациентов в Европе составляют около 10% всех лиц, принимающих лекарственные средства. Так, у 20–30 млн людей фермент СYP2D6 отсутствует (сниженный метаболизм), что ведет к:
- замедленному метаболизму лекарственных средств;
- высоким концентрациям препарата в крови при приеме его в обычных дозах;
- высокому риску развития побочных реакций;
- отсутствию ответа на некоторые пролекарства (например кодеин).
Однако у 15–20 млн европейцев можно предположить удвоение гена СYP2D6 (ультраметаболизм), следствием чего являются:
- слишком быстрый метаболизм;
- отсутствие действия лекарственного средства при приеме его в обычных дозах.
В январе 2005 г. FDA выдало разрешение на маркетинг первого фармакогенетического теста AmpliChip CYP450 (ДНК-микрочип) для генотипирования двух генов ферментной системы цитохрома Р450 СYP2D6 и СYP2D6. Вместе с тем существуют данные о недостаточной целесообразности определения генов CYP2D6 CYP2C19 в отношении развития побочных реакций и отсутствия ответа, ведущего к прекращению лечения: ультрабыстрый генотип ответственен только за 20–30% ультрабыстрого фенотипа (Zineh I., 2005).
ДИАГНОСТИЧЕСКИЕ ТЕСТЫ
Положительный эффект разработки и внедрения диагностических тестов, позволяющих произвести отбор пациентов для лечения тем или иным препаратом, можно проследить на примере препарата Herceptin (трастузумаб). В клиническом испытании препарата участвовали 470 пациентов, которые прошли предварительный отбор по результатам теста. Без его проведения количество пациентов пришлось бы увеличить примерно в пять раз. Доля больных, у которых препарат был эффективен, составила 50%, тогда как без тестирования она была бы равна 10%. Наконец, применение теста позволило уменьшить время проведения испытаний с предполагаемых 10 до 1,6 года. Как подчеркнул генеральный директор компании «Genentech» Артур Левинсон, в результате на проведении клинических исследований было сэкономлено 35 млн дол. Но эта сумма все-таки не очень значительна по сравнению с пользой ускоренного на 8 лет выведения препарата на рынок, что позволило включить препарат в схему лечения сотен тысяч пациентов с раком молочной железы (Press M., Seelig S.A., 2004). Поскольку Herceptin эффективен только у пациентов с наличием в клетках опухоли рецепторов HER-2, которые составляют 20–30% общего количества больных, необходимость их отбора перед началом лечения обоснованна. FDA одобрило 3 диагностических теста, выполнение каждого из которых стоит менее 100 дол. При этом цена дозы препарата (440 мг) составила 1382 дол. (Chauhan D., 2005). Данные фармакоэкономических исследований свидетельствуют о благоприятном соотношении стоимость/эффективность при применении этих диагностических тестов (Zika E., 2004).
У женщин с раком молочной железы, у которых выявлен HER-2, заболевание, как правило, протекает более агрессивно, при этом отмечается повышенный риск рецидивирования и ухудшаются показатели выживаемости (Murray S., 2006). Результаты недавно опубликованного международного исследования с участием HER-2 позитивных пациенток с ранним инвазивным раком молочной железы, завершивших 4 и более курсов химиотерапии, свидетельствуют о том, что спустя год после начала применения трастузумаба (каждые три недели в течение 1 года) среди 1694 женщин, принимавших препарат, по сравнению с получавшими плацебо, частота рецидивов, смертельных исходов и новых случаев рака была вполовину меньше. Результаты исследования свидетельствуют в пользу применения транстузумаба у HER-2 позитивных женщин с раком молочной железы, хотя пока его ограничивает такой фактор, как невыясненность оптимальных доз, кратности и продолжительности терапии. Также добавляет беспокойства формирование резистентности к препарату. Польза трастузумаба должна оцениваться с обязательным учетом кардиотоксических эффектов. Дальнейшие исследования необходимы для определения риска развития такой патологии через несколько лет после окончания терапии препаратом (Murray S., 2006). В любом случае, трастузумаб является перспективным, но очень дорогим лекарственным средством. В условиях экономного расходования средств на нужды здравоохранения необходимо определять экономические последствия применения препарата до того, пока трастузумаб получит широкое распространение (Neyt M., 2005).
Iressa (гефтиниб) и Terceva (эрлотиниб) относятся к лекарственным средствам из группы ингибиторов эпидермального фактора роста тирозинкиназы (EGFR) в форме для перорального приема. Разработан генетический тест для выявления этой мутации (стоимость от 500 до 2000 дол.), выявляемой у 10% пациентов с немелкоклеточным раком легких в США и около 25% — в Японии (McKerell A., 2004). В мае 2003 г. FDA выдало разрешение на маркетинг препарата Iressa, в ноябре 2004 г. — препарата Terceva для лечения пациентов с немелкоклеточным раком легкого. Применение описываемых препаратов у пациентов с повышенной экспрессией гена EGFR позволит более чем в 2 раза снизить показатель стоимость/эффективность (Chauhan D., 2005).
Варфарин является наиболее часто применяемым антикоагулянтом (2 млн назначений в год в США). Количество назначений за последние 6 лет увеличилось на 45% (Lesco L. 2005). С 1954 г. пересмотр инструкции препарата осуществлялся более 20 раз. Последний в сентябре 2005 г. в связи с появлением взаимодействия препарата с клюквенным соком и ингибиторами протонного насоса. Учет таких факторов, как вариабельность генов, кодирующих ферменты витамин К эпоксидредуктаза и CYP2C9, а также возраст и масса тела, может объяснить 61% вариабельности ответа на варфарин (Wadelius M., 2005). 14 ноября 2005 г. подкомитет по клинической фармакологии рекомендовал FDA дополнить инструкцию препаратов варфарина информацией о CYP2C9 и VKORC1 (Lesko L., 2005).
Предотвратить развитие побочных реакций в связи с гепатотоксическим эффектом парацетамола поможет идентификация людей с недостаточностью UDP-glucuronosyltransferase (UGT), приводящей к нарушению глюкуронизации этого лекарственного средства.
КОНЕЦ ЭРЫ БЛОКБАСТЕРОВ?
В одном из исследований сравнивали эффективность антипсихотических средств второго (атипических — оланзапина, кватиапина, рисперидона, ципразидона) и первого поколения (перфеназина) у 1493 пациентов с шизофренией. Количество больных, прекративших лечение каждым из препаратов, их эффективность и переносимость были примерно одинаковыми. То есть препараты обеих групп существенно не отличались. «Конец эры блокбастеров » — вопрос, который задают многие специалисты. Возможно, ведь действительно некоторые лекарственные средства действуют намного лучше у одних и хуже — у других пациентов. Генетические особенности могут позволить предсказать эффективность и вероятность развития побочных реакций, а также приемлемую дозу для конкретных пациентов. В то же время сейчас ничего не предпринято для изучения таких вариантов относительно большинства препаратов, выведенных на рынок (Goldstein D., 2005).
Замечательный клинический успех первых рекомбинантных протеинов способствовал притоку крупных инвестиций и стал причиной повышенных ожиданий, связываемых с этим направлением в отрасли. Аналитики предполагали, что новым препаратам потребуется сравнительно немного времени для завоевания 20—25% мирового фармацевтического рынка. С применением биотехнологий в фармации и сейчас связывают большие надежды. С другой стороны, итоги рассмотрения заявок на получение разрешения на маркетинг биотехнологических препаратов регуляторными органами были весьма благоприятными для компаний в 80-х гг.прошлого века, с чем отчасти связана последовавшая в 90-х «биотехнологическая лихорадка». В настоящее же время успешность попыток выведения на рынок описываемых лекарственных средств такая же, как и у остальных препаратов (van Rijkom E.A.J., 2002). Нерешенными проблемами остаются недостаточные количество (необходимы дальнейшие исследования) и систематизированность информации, сложность регуляторных подходов, неполная осведомленность специалистов здравоохранения. Вероятно, прошедшие 50 лет (первые труды по фармакогенетике появились в конце 50-х — начале 60-х гг. ХХ в.) стали периодом становления нового направления в науке о жизни, и в последующем оно будет становиться все более продуктивным. К тому, как персонализированная медицина занимает свое место в деятельности фармацевтических компаний, регуляторных органов и в жизни общества, мы обратимся в одном из следующих номеров. n
*Четких отличий в значениях терминов фармакогенетика и фармакогеномика нет, и они могут употребляться как взаимозаменяемые. Нередко им придают такой смысл: фармакогеномика изучает все генетические признаки, с которыми связаны метаболизм и действие лекарственных средств, а фармакогенетика — только наследственные особенности (вариации) этих процессов (National Center for biotechnology Information — NCBI, 2004). Последние связаны с различиями на рецепторном уровне (фармакодинамика) и характером процессов всасывания, распределения, связывания, биотрансформации и выведения лекарственных средств (фармакокинетика).
**Вещество с большей вероятностью будет проявлять активность при приеме внутрь, если оно соответствует следующим критериям:
-
в молекуле не более 5 доноров водородных связей (ОН- и NH-групп);
-
в молекуле не более 10 акцепторов водородных связей;
-
молекулярная масса менее 500;
-
LogP менее 5 (показатель, характеризующий различную растворимость в двух растворителях) (www.bioscreening.com).
***Определение последовательности нуклеотидов в молекуле ДНК.
Дарья Полякова

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим