|
В настоящее время выбор инструментов для проведения биомедицинских исследований беспрецедентно большой: это и биомаркеры, и компьютерные модели, и геномика, и многое другое. В то же время для фармацевтических производителей основными проблемами являются нехватка новых перспективных препаратов, снижение прибыли и общественное недовольство в связи с проблемами безопасности лекарственных средств. Компании придают очень большое значение защите интеллектуальной собственности, однако разработка биомаркеров и геномных тестов каждым производителем в отдельности из-за дороговизны может оказаться непосильной задачей (Wechsler J., 2006). В марте 2004 г. Управление по контролю за лекарственными препаратами и продуктами питания (Food and Drug Administration — FDA) с пафосом объявило о новой инициативе под названием «критический путь разработки новых препаратов». Появление списка новых исследовательских приоритетов было обещано через несколько месяцев, но он не появился и через год. До недавнего времени, как отмечают аналитики, казалось, что проект умер, едва успев родиться. Только несколько месяцев тому назад FDA назвало реализацию инициативы одним из своих важнейших приоритетов. Долгое молчание, как было отмечено, было связано не с бездействием, а проведением консультаций, в основном по поводу совместного использования информации и защиты интеллектуальной собственности. И долгожданный список вскоре должен быть оглашен (Clinton P., Wechsler J., 2006).
Дело в том, что хотя затраты фармацевтической отрасли и Национального института здоровья (National Institute of Health) США на разработку новых лекарственных средств с 1993 г. удвоились, количество выданных разрешений на маркетинг не увеличилось. Расходы повысились, но вероятность выведения на рынок препарата, вступившего в I фазу проведения клинических испытаний, по сравнению с 1985 г. снизилась с 14 до 8%. И подобная ситуация характерна не только для рынка США. Как отметила Мариса Амати, заместитель директора сектора эффективности лекарственных средств Европейского агентства по оценке лекарственных средств (European Medicines Evaluation Agency — EMEA), в настоящее время более 80% препаратов, клинические испытания которых уже начали проводиться, не выводятся на рынок в связи с токсичностью или недостаточной эффективностью (при этом 50% «сходят с дистанции» в III фазе). При подаче в EMEA заявки на получение разрешения на маркетинг по централизованной процедуре 30% препаратов его не получают. Среди выведенных на рынок препаратов два и больше в год (с 1991 по 2004 г.) отзываются в связи с серьезными побочными реакциями (Amati M. P., 2005), которые в США, например, служат причиной 2,2 млн госпитализаций и 100 тыс. смертей в год (Lazarou J. et al., 1998) и связаны с расходами в объеме 180 млрд дол. США в год (Ernst F.R., Grizzle A.J., 2001).
В сложившейся ситуации персонализированная медицина, по меткому выражению Роднея Зиммеля, ведущего специалиста «McKinsey & Company» — одной из крупнейших в мире консалтинговых компаний, — предлагает три потенциально значимых преимущества: сокращение затрат на неэффективные препараты, уход от практики «проб и ошибок» при разработке лекарственных средств, когда в стремлении не допустить плохой переносимости не исключена возможность отклонения и потенциально значимого препарата. Наконец, пациенты с высоким риском развития тех или иных заболеваний будут получать терапию на ранних стадиях, в связи с чем уменьшатся затраты на госпитализацию и хирургические вмешательства.
Между тем, только небольшое количество идей, над которыми ученые работали в течение последних 50 лет (табл. 1), преимущественно в области онкологии, вышло за пределы лабораторий и внедрено в медицинскую практику. В этом процессе есть, по меньшей мере, два критических момента: интеграция разработок в области фармакогеномики в регуляторный процесс (выдача разрешений на маркетинг) и готовность специалистов и пациентов их принять. FDA уже включает информацию об аспектах эффективности и безопасности, связанную с фармакогеномикой, в инструкции к применению препаратов. В настоящее время такие сведения содержат 610 инструкций, но большинство из них носит только описательный характер, что тормозит их применение на практике. В марте 2005 г. был утвержден порядок добровольного представления данных по фармакогеномике, с тем, чтобы побудить компании информировать FDA вне процесса рассмотрения заявок на получение разрешения на маркетинг (табл. 2).
?Таблица 1
Важнейшие события и открытия в области фармакогеномики (по Frueh F.W., Gurwitz D., 2004)
| Год | Событие |
| 1955 | Описана связь между концентрацией в моче противотуберкулезного средства изониазида и эффективностью его применения (Bonicke R., Orlowski E.H., 1955) |
| 1957 | Выдвинуто предположение, что «идиосинкразия по отношению к лекарственным средствам может быть вызвана генетическими особенностями и дефицитом ферментов, ничем другим себя не проявляющими» (Motulsky A.G., 1957) |
| 1959 | Введен термин «фармакогенетика», означающий «изучение клинически значимых наследственных особенностей» (Vogel F., 1959) |
| 1962 | Опубликована книга «Фармакогенетика — наследственность и ответ на лекарственные средства» (Kalow W., 1962) |
| 1963 | Описаны фенобарбитал-индуцированные изменения функционирования эндоплазматической сети в клетках печени и связанные с ними изменения активности ферментов, участвующих в метаболизме лекарственных средств (Remmer H., Merker H.J., 1963) |
| 1964 | Описан дефицит фермента глюкозо-6-фосфат-дегидрогеназы (Motulsky A.G. et al., 1964) |
| 1988 | Охарактеризован широко распространенный дефект гена СYP2D6 системы цитохрома Р450 |
| 2000 | Национальный институт здоровья (National Institute of Health — NIH) (США) объявил о создании исследовательской сети по фармакогеномике (Pharmacogenetics Research Network) |
| 2003 | Завершение проекта «Геном человека» |
| 2003 | FDA издало проект «Руководство для отрасли: подача данных по фармакогеномике» |
| 2005 | Совет международных организаций по научной медицине (Council for International Organizations of Medical Sciences — CIOMS) (создан ВОЗ и ЮНЕСКО в 1949 г.) издал руководство «Фармакогенетика: предстоящее улучшение применения лекарственных средств» (февраль 2005 г.) |
| 2005 | Вышеназванное руководство для отрасли утверждено FDA (март 2005 г.) |
Таблица 2
Примеры использования фармакогеномики в новых лечебно-диагностических подходах ? (по Frueh F.W., Gurwitz D., 2004; Gurwitz D., 2005; Warrington J.A., 2005)
Изменения в инструкциях к применению (FDA)ПрепаратБиомаркерИнструкцияТрастузумабРецепторы HER-2Трастузумаб должен применяться только у пациентов с повышенной экспрессией HER-2ТиогуанинФермент тиопурин-метилтрансфераза (thiopurine methyltransferase — TPMT)У лиц с наследственным дефицитом этого фермента может наблюдаться повышенная выраженность супрессивного действия сульфонилмочевины на костный мозг. Эффект может усиливаться при одновременном применении этого препарата с сульфазалазином и мезалазиномПропафенонГен GYP2D6При одновременном применении пропафенона с препаратами, ингибирующими GYP2D6, CYP1A2 и CYP3A4, необходимо тщательное наблюдение за пациентами и подбор дозВарфаринГены CYP2C9 и витамин К эпоксиредуктазаОпределенные аллели указанных генов могут быть связаны с развитием побочных реакций при использовании препарата (кровотечение)Диагностические тесты, получившие разрешение на маркетинг в СШАНазваниеНаправленностьПредназначениеAmpliChip P450Гены CYP2D6 и CYP2C19Первый тест на основе ДНК-микрочипа, получивший разрешение на маркетинг в США. Применяется для генотипирования двух генов ферментной системы цитохрома Р450, с которыми связан метаболизм более 25% рецептурных лекарственных средств (Wolf C.R., Smith G., 1999)UGT1A1 тестГен UGT1A1Для выявления определенной разновидности полиморфизма гена UGT1A1, у пациентов с которым в случае применения цитостатического препарата иринотекана развивается тяжелая нейтропенияБиомаркеры, определение которых с помощью тестов в будущем может улучшить профиль эффективности и безопасности лекарственных средств БиомаркерыГруппы препаратовДругие гены семейства Р450: CYP2C9, CYP3А5, CYP3А4, CYP2В6Антиаритмические, антипсихотические средства, антидепрессанты, блокаторы бета-адренорецепторов, анальгетические средства, ингибиторы протонного насосаГен множественной лекарственной резистентности (MDR-1)ДигоксинРецепторы I типа к ангиотензину IIЛосартанАнгиотензинпревращающий ферментИнгибиторы ангиотензинпревращающего ферментаБелок — переносчик эфиров холестеринаИнгибиторы ГМГ КоА-редуктазы ?
БИОМАРКЕРЫ И ДИАГНОСТИКА
В клинических лабораториях некоторые подходы целенаправленной (targeted) медицины используются уже более 40 лет, с началом применения бактериологического анализа биологических жидкостей с целью выбора антибактериального средства. К концу 1990-х гг. стало возможным проводить генотипирование вирусов гепатита и иммунодефицита человека (ВИЧ) с последующим решением вопроса о необходимой терапии. В настоящее время, хотя расходы на лабораторную диагностику в развитых странах составляют примерно 3% затрат на здравоохранение, результаты применения этой группы методов обусловливают 70% решений, принимаемых в клинической практике. В XXI веке инновации в области целенаправленной медицины позволили существенно расширить ее возможности (Schwartz J., 2004) (табл. 2).
НОВЫЙ ДИЗАЙН КЛИНИЧЕСКИХ ИСПЫТАНИЙ
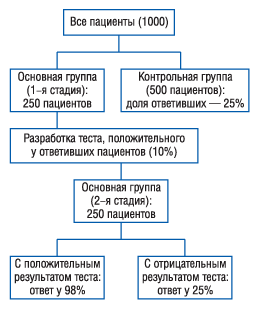
Возможность определения маркеров, позволяющих связать между собой генетические особенности пациента и эффект лекарственного средства, открывает перспективы повышения эффективности и безопасности лекарственных средств путем применения их у определенных пациентов в нужной дозе. На рисунке 1 приведена схема проведения рандомизированного контролируемого исследования, перед началом которого не был известен признак, свидетельствующий о чувствительности пациента к препарату (см. рис. 1). Описанный дизайн исследования, называемый адаптивным, имеет такие особенности:
|
- если доля пациентов, отвечающих на прием нового препарата, мала, он позволяет существенно снизить риск «выбраковки» препарата, который потенциально может быть очень эффективным у ограниченной категории пациентов;
- столь же эффективен, как и традиционный дизайн, в определении пользы для пациентов, предварительный отбор которых не проводили (Freidlin B., Simon R., 2005).
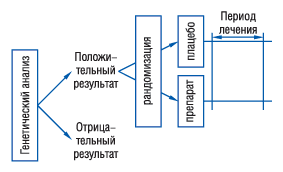
Если характер генетических признаков, от которых зависят эффективность и переносимость, известен до начала исследования, может применяться обогащающий дизайн, при котором рандомизации предшествует отбор с помощью генетического тестирования. Если при этом из исследования исключают пациентов с отрицательными результатами генетического тестирования, может быть упущена возможность обнаружить и у них положительный эффект лечения (Uyama Y., 2005) (рис. 2).
|
Иллюстрируя значимость фармакогенетического тестирования, приведем пример неудачного дебюта препарата на рынке. Centoxin (небакумаб), выведенный на европейский рынок в 1991 г., предназначался для лечения пациентов с сепсисом, вызванным грамотрицательными бактериями. Однако только третья часть случаев сепсиса обусловлена этой причиной, а для выявления этиологического фактора заболевания необходимо выполнять бактериологическое исследование крови (на это требуется около 2 суток). FDA отказало компании «Centocor» в выдаче разрешения на маркетинг на основании результатов того же исследования, что было представлено ею в европейский регуляторный орган (Ziegler E. J. et al., 1991). Для удовлетворения требований FDA «Centocor» начала другое исследование, которое было прекращено после выполнения промежуточного анализа, когда оказалось, что смертность среди пациентов, принимавших небакумаб, превышала таковую у больных, получавших плацебо (McCloskey R.V. et al., 1994). Данные, свидетельствующие о низкой эффективности небакумаба у пациентов с сепсисом, вызванным не грамотрицательными бактериями, были получены и в исследовании Е. Ziegler и соавт., но тогда им не придали большого значения. Вскоре компания отозвала препарат с рынков всего мира. Проблема низкой эффективности этого препарата не могла быть решена до разработки метода быстрого выявления этиологии заболевания. Небакумаб, одна доза которого стоила свыше 3 тыс. дол. США, являлся одним из наиболее дорогих препаратов в мире (van Rijkom E.A.J., 2002). Вероятно, соотношение стоимость/эффективность препарата могло бы расцениваться как приемлемое при условии создания соответствующего диагностического теста. Об этом свидетельствуют данные одного из исследований (Schulman K. A. et al., 1991).
ПРОГНОЗ
В настоящее время большинство аналитиков делают весьма осторожные прогнозы относительно темпов, с которыми фармакогеномика будет завоевывать свое место на рынке лекарственных препаратов. Некоторые предсказывают скорый «закат» эры блокбастеров из-за повышения избирательности фармакотерапии, но следуя данным, приведенным Р. Зиммелем, «блокбастерная модель далека от гибели» (табл. 3). По его оценкам, на ближайшее будущее прогнозируется увеличение объема продаж таких биотехнологических препаратов, как эпоэтин альфа и инфликсимаб. Наряду с ними многообещающими лекарственными средствами являются трастузумаб и цетаксимаб (табл. 4). Для некоторых других препаратов, таких как клопидогрел, бевацизумаб и гефтиниб, уменьшение количества потенциальных пациентов может обернуться потерями в объемах продаж, измеряемыми миллиардами. Появление специфических тестов для быстрого выявления пациентов, у которых тот или иной препарат с большой степенью вероятности окажется эффективным, станет причиной того, что средства охотнее будут выделяться для закупок препаратов для персонализированного лечения, поскольку это может способствовать уменьшению затрат, связанных с неэффективностью и побочными реакциями. Как отметил представитель одной из страховых компаний, клиенты очень заинтересованы в более «точной» медицине, и это не жадность, а просто нежелание платить за расточительное здравоохранение. По мнению другого участника научного форума, представляющего «IBM Buisiness Consulting Services», поскольку многие препараты эффективны только у 40–60% пациентов, компании, которые не сориентируются вовремя и не возьмут на вооружение новые методы, «лет через 5–6 окажутся некими динозаврами» среди более расторопных собратьев по цеху. Так что накал страстей вокруг фармакогеномики большой, и ничто не предвещает его спада в ближайшем будущем. n
Таблица 3
Объемы продаж блокбастеров на мировом фармацевтическом рынке (2000–2004 гг.) (IMS, 2005)
| ? | 2000 | 2001 | 2002 | 2003 | 2004 |
| Объем продаж мирового фармрынка (млрд дол. США) | 358 | 386 | 421 | 490 | 545 |
| Доля блокбастеров в объеме продаж (%) | 23 | 24 | 30 | 29 | 31 |
| Количество блокбастеров | 46 | 51 | 58 | 70 | 87 |
Таблица 4
Прогнозируемые объемы продаж некоторых препаратов для персонализированного лечения (McKinsey analysis, 2005)
| Продукт | Диагностический тест | Продажи в мире в 2004 г. | Прогноз на 2009 г. | Сравнительный ежегодный рост (%) |
| Герцептин | Herceptest Pathway PathVysion |
1,155 | 3,694 | 26 |
| Erbitax | EGFR pharmDx test | 357 | 1,852 | 39 |
| Gleevec/Glivec | VentanaDx c-Kit |
1,634 | 3,216 | 14 |
Дарья Полякова
*Продолжение, начало в № 2 (523) от 16 января 2006 г.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим