 Державний експертний центр МОЗ України (ДЕЦ) повідомляє, що лікарський засіб фармацевтичної компанії «Амакса Фарма» отримав позитивний висновок ДЕЦ щодо реєстрації за новою спрощеною процедурою, згідно з наказом МОЗ України від 17.11.2016 р. № 1245 (далі — Наказ), відповідно до якої реєстрація ліків в Україні, які вже зареєстровані у США, Канаді, Австралії, Швейцарії, Японії, а також ЄС (Європейською агенцією з лікарських засобів (European Medicines Agency — ЕМА), проходить за 17 днів.
Державний експертний центр МОЗ України (ДЕЦ) повідомляє, що лікарський засіб фармацевтичної компанії «Амакса Фарма» отримав позитивний висновок ДЕЦ щодо реєстрації за новою спрощеною процедурою, згідно з наказом МОЗ України від 17.11.2016 р. № 1245 (далі — Наказ), відповідно до якої реєстрація ліків в Україні, які вже зареєстровані у США, Канаді, Австралії, Швейцарії, Японії, а також ЄС (Європейською агенцією з лікарських засобів (European Medicines Agency — ЕМА), проходить за 17 днів.
ДЕЦ зазначає, що на сьогодні це єдиний лікарський засіб, що буде зареєстрований за спрощеною процедурою рішенням Міністерства охорони здоров’я на основі позитивного висновку ДЕЦ. Окрім цієї заявки на реєстрацію, за час дії процедури з 17 листопада 2016 р. ДЕЦ отримав на розгляд та відхилив заявки від ще 2 виробників.
Тетяна Думенко, директор ДЕЦ, зауважує: «Для нас важливо, щоб українські пацієнти мали доступ саме до якісних, ефективних та безпечних ліків якомога швидше. Тому ми розуміємо прагнення пацієнтських організацій до розробки процедур, які дадуть можливість прискорити процес реєстрації ліків. Але наявна процедура спрощеної реєстрації інноваційних ліків із країн з суворою регуляторною системою, на жаль, не є досконалою і має низку недоліків, які змушують сьогодні експертів ДЕЦ відмовляти виробникам лікарських засобів у проходженні спрощеної реєстрації. Більшість відмов пов’язана з тим, що заявник не може надавати додаткову інформацію стосовно реєстраційних матеріалів чи отримувати рекомендації щодо доопрацювання документів. Згідно з нормами Наказу ми маємо просто відхиляти такі заявки. У разі доопрацювання процедури реєстрації ці питання знімуться, і ми дійсно зможемо гарантувати забезпечення українців інноваційними ліками з країн із суворою регуляторною системою за 17 днів».
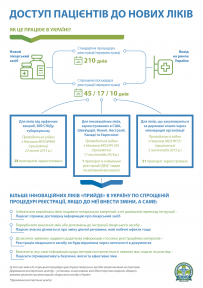
ДЕЦ разом з представниками громадськості та бізнесу ініціював низку змін до Наказу, який регулює процедуру спрощеної реєстрації лікарських засобів. Зміни стосуються тих питань, які за стандартною процедурою реєстрації (упродовж 210 днів) вирішуються у процесі перевірки інструкції для медичного застосування лікарського засобу. Щоб забезпечити якість, доступність та ефективність зареєстрованих ліків, експерти ДЕЦ пропонують, зокрема, зобов’язати заявника подавати нотаріально завірений, а не довільний переклад інструкції для застосування лікарського засобу.
В Україні на сьогодні реєстрація лікарських засобів здійснюється за загальною процедурою протягом 210 днів, за скороченою — протягом 45, 17 або 10 днів, залежно від категорії реєстрованих ліків.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим