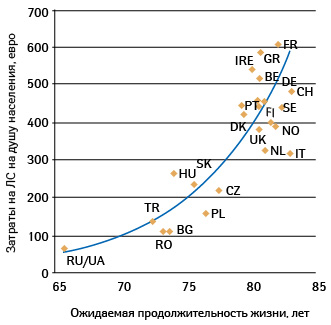
Став членом ВТО, Украина взяла на себя обязательства имплементировать в национальное законодательство положения заключенных в этой связи договоров и соглашений. Часть из них, в частности относительно защиты прав интеллектуальной собственности, призваны влиять на деятельность фармотрасли. В договорах с развитыми странами Украина частично приняла их стандарты регулирования общественных правоотношений. Но по силам ли нам, а главное — на пользу ли, брать на себя такие обязательства? Хорошо ли мы помним, что Украина — бедная страна, с очень низкой (по любым меркам) продолжительностью жизни, с мизерным финансированием здравоохранения? Как человек, которому нечего есть, который не может покупать себе дорогие лекарства, так и Украина тратит на нужды здравоохранения около 3% ВВП («Медико-демографічна ситуація та організація медичної допомоги населенню», МОЗ, 2010), тогда как США — 16%, а большинство стран —членов ЕС — 7–11% (данные за 2007 г. из «OECD health data 2009», ). На рисунке 1 хорошо видно, что и по затратам на ЛС, и по продолжительности жизни Украина и Россия не просто отличаются, а находятся на противоположном полюсе по отношению к другим странам Европы.
Защита прав интеллектуальной собственности сегодня осуществляется не только на уровне отдельных стран или межгосударственных взаимоотношений, но в глобальном масштабе (Потєхіна В., 2008). При этом начало нового этапа было положено Соглашением по торговым аспектам прав на интеллектуальную собственность (Agreement on Trade-Related Aspects of Intellectual Property Rights — TRIPS)1. Это наиболее подробное соглашение, которое когда-либо заключалось в данной сфере, содержит минимальные стандарты охраны различных объектов интеллектуальной собственности. На необходимости принятия Соглашения TRIPS в рамках ВТО (вступило в силу в 1995 г., вместе с учреждением самой организации) в первую очередь настаивали США, ЕС и Япония, тогда как развивающиеся страны посчитали, что не смогут воспользоваться выгодами таких стандартов и они будут тормозить их развитие (здесь и далее до конца абзаца — Ананд Гровер, 20092). Однако в качестве компромисса Соглашение TRIPS было принято, хотя до конечной цели развитых стран — универсальной гармонизации прав интеллектуальной собственности с их стандартами, пока далеко. Стремясь к ней, развитые государства продолжают распространять свои правила и нормы с помощью различных соглашений о свободной и многосторонней торговле.

Наша задача в переговорном процессе укладывается в две основные плоскости:
- возможно более полное использование так называемых гибких положений TRIPS;
- избегание более строгих, чем предусмотрено самим соглашением, положений TRIPS-плюс.
Участники семинара с украинской стороны (первый заместитель директора ГФЦ МЗ Украины Ольга Баула, заместители директоров двух департаментов Минэкономики, начальник отдела организации защиты прав Государственного департамента интеллектуальной собственности Минобразования и науки Инна Шатова, завсектором авторского права НИИ Интеллектуальной собственности Национальной академии правовых наук Украины Анастасия Миндрул, представители Всеукраинской сети людей, живущих с ВИЧ и фонда «Возрождение») определили 3 «реальных» направления переговоров:
- отмена системы полезных моделей применительно к ЛС;
- эксклюзивность данных;
- продление сроков патентной охраны;
- вопросы исчерпания прав/параллельного импорта.
Итак, в само Соглашение TRIPS заложены гибкие возможности его осуществления странами — членами ВТО. Главный принцип соглашения (ст. 1) — государства-члены свободны в определении методов его выполнения. По сути для того, чтобы напомнить о возможности гибкого подхода к его исполнению была принята Декларация Доха по вопросам согласования требований соглашения по торговым аспектам прав на интеллектуальную собственность с потребностями общественного здравоохранения (Doha Declaration on the TRIPS Agreement and Public Health). Она была единогласно одобрена в 2001 г. всеми членами ВТО в г. Доха (Катар) на IV Министерской конференции ВТО. Декларация явилась ответом на стремление развивающихся стран противодействовать давлению развитых государств, навязывающих свои способы защиты интеллектуальной собственности.
Страны в разной степени пользуются предусматриваемыми Соглашением TRIPS гибкими возможностями, отмечает специальный докладчик ООН (Гровер А., 2009). Это связано как с недостаточной осведомленностью, так и слабостью технического потенциала для их использования, а также давлением со стороны развитых государств. Основные «гибкие» возможности осуществления Соглашения TRIPS следующие:
- в полной мере использовать переходные периоды;
- определять критерии патентоспособности;
- выдавать принудительные лицензии и предусматривать государственное использование;
- применять принцип международного исчерпания для облегчения параллельного импорта;
- вводить ограниченные исключения в патентные права;
- разрешать процедуры возражений и отмены патентов.
А теперь — о каждом из этих положений.
ПЕРЕХОДНЫЕ ПЕРИОДЫ
Что касается переходных периодов, то тут Украина безнадежно и бесповоротно упустила свой шанс. Так, страны с развивающейся экономикой, к которым Международный валютный фонд относит Украину (IMF Emerging and Developing Economies List. World Economic Outlook Database, October 2009, ), должны были принять меры по осуществлению соглашения TRIPS до 2000 г. Тем из них, которые не обеспечили охрану патентов на продукты в некоторых областях (Индия, Египет, Бразилия), было предоставлено дополнительно 5 лет.
В Индии ситуация с патентами развивалась таким образом: в начале 1970-х гг. были аннулированы патенты на ЛС, за исключением касающихся способов производства. Поскольку ни действующие вещества, ни составы, ни способы применения ЛС не были защищены, местная промышленность усиленно работала над разработкой новых способов производства ЛС, защищенных патентами на Западе. В результате страна из крупнейшего импортера фармацевтической продукции превратилась в ведущего экспортера. К примеру, Бразилия ничего такого не сделала и даже не до конца воспользовалась переходным периодом, закончившимся для нее в 2005 г., введя защиту патентов на ЛС несколькими годами раньше. Только для наименее развитых стран (Least Developed Country, ООН), таких как Афганистан, Гаити или Ангола, переходный период заканчивается в 2016 г.
В Украине согласно законам «Об охране прав на изобретения и полезные модели» от 15.12.1993 г. № 3687-ХП и «О лекарственных средствах» от 04.04.1996 г. № 123/96-ВР правовая защита предоставляется изобретению (в том числе ЛС), которое не противоречит общественным интересам, принципам гуманности и морали и отвечает условиям патентоспособности. А что если бы наши государственные мужи проявили ответственность и дальновидность и наследовали опыт Индии? Еще целых 10 лет можно было бы наращивать конкурентоспособность отечественной фармотрасли, дав ей преимущества перед Западом. И ведь при вступлении в ВТО у страны с сильной экономикой больше аргументов для вступления на более выгодных условиях. Так, Китай целых 15 лет участвовал в переговорном процессе, обеспечив себе немалые преимущества. А отвечают ли государственным интересам определение объектов патентования и условий патентоспособности, принятое в нашей стране?
УСЛОВИЯ ПАТЕНТОСПОСОБНОСТИ
Согласно TRIPS патент может быть выдан при соблюдении следующих критериев:
- новизна;
- изобретательский уровень (неочевидность для специалиста);
- промышленная применимость.
Однако в Соглашении TRIPS не описаны ни их сущность, ни применение. Поэтому страны — члены ВТО могут сами для себя решать, насколько строгим должно быть соблюдение этих условий1. В публикации ВОЗ приводят пример США, где требования к патентоспособности нестрогие ( ). Так, общепринято, что новизна теряется при опубликовании и применении (считается, что если изобретение стали использовать, оно стало известным обществу). Однако по законам США новизна не нарушается при использовании изобретения вне США. Поэтому-то в Штатах удалось запатентовать многие технологии и материалы, столетиями применявшиеся до этого в других странах. Понимание американским законодателем изобретательного уровня также не создает особых препятствий желающим получить патент. Поэтому в стране выдано множество патентов на так называемые бизнес-системы, которые ничего особенного собой не представляют. Так, запатентован, а потому не может быть использован без разрешения владельца патента способ заказа товаров через интернет посредством «одного клика».
На рисунке показан пример изобретения, которое в настоящее время защищено патентом США (рис. 2). Ограничения для хозяйственной деятельности, которые он за собой влечет, естественно, незначительны. Куда более серьезны они и далеко не ограничиваются экономическими последствиями в случае с ЛС, к патентоспособности которых законодательство также относится весьма либерально.
Так, в 2009 г. в США получили разрешение на маркетинг только 25 новых химических соединений (New chemical entity), из которых 6 одобрены как биологические ЛС (). Согласно докладу Еврокомиссии в период 2000—2007 гг. удвоилось количество заявок на фармацевтичекие патенты, при этом 87% из них являются вторичными, то есть не на само действующее вещество, а на метод его производства, лекарственную форму и состав соответствующих препаратов и т.д. Это создает серьезные трудности при создании генерических версий.
Читая о коммерческой тактике транснациональных фармацевтических компаний, стремящихся к тому, чтобы их брэнды были «вечнозелеными» (evergreen), мы воспринимаем это с долей иронии, как явление, не имеющее к нам непосредственного отношения. Да, резонансных «околопатентных баталий» мы у себя не наблюдаем — основные события происходят на западных рынках, мы же просто пожинаем плоды. Будь отечественные фармкомпании игроками мирового уровня, все было бы иначе, но… Считанного числа зарегистрированных на развитых рынках украинских препаратов явно недостаточно для того, чтобы осмелиться «спорить с грозной птицей». Поэтому западный производитель снимает сливки как в своих странах, которым это выгодно, так и в Украине, не научившейся защищать свои интересы. В специализированной базе данных «Изобретения (полезные модели) в Украине» — огромное количество патентов как на ЛС (действующие вещества), в том числе их полиморфные формы, так и на способы их производства, фармацевтические композиции, способы применения (для диагностики, лечения и профилактики заболеваний ()).
В Украине согласно закону № 3687-12 «Об охране прав на изобретения и полезные модели» понятие «изобретение» (последняя редакция от 07.07.2009 г.; далее — Закон) определяется так же, как и «полезная модель» — результат интеллектуальной деятельности человека в какой-либо сфере технологии. Объектом как первого, так и второго могут быть:
- продукт (устройство, вещество, штамм микроорганизма, культура клеток растения, животного и т.п.);
- процесс (способ), а также новое использование известного продукта или процесса.
Если объекты изобретения и полезной модели — одинаковы, то что же отличается? Условия и способы патентования. Изобретение соответствует условиям патентоспособности, если оно является новым, имеет изобретательский уровень и является промышленно пригодным, а полезная модель — если является новой и промышленно пригодной. Патент на полезную модель выдается на основании формальной, а не квалификационной экспертизы заявки, то есть фактически под ответственность заявителя, без проведения квалифицированной экспертизы, отмечает А. Миндрул3. «Это может привести к значительным злоупотреблениям со стороны недобросовестного заявителя, тем самым предоставляя монополию на объекты, не соответствующие критериям патентоспособности. В таком случае предоставление патентной охраны приводит к ограничению свободного использования известных процессов или продуктов в сфере здравоохранения» (там же). Очевидно, что обеспечение высокого уровня проверки патентных заявок до выдачи патента и уже выданных патентов может служить эффективным средством ограничения воздействия патентов на лекарства (Гровер А., 2009).
Получается, что к полезной модели предъявляют существенно более низкие требования, чем к изобретению. А поскольку заявку на выдачу патента на изобретение можно в любой момент превратить в заявку относительно выдачи патента на полезную модель (ст. 18), заявитель может попробовать воспользоваться вариантом с более высокими требованиями, и в случае прогнозируемой неудачи переключиться на вариант с более низким уровнем. При этом он потеряет только в сроке действия охранного документа. Так, сроки их действия с момента подачи заявки следующие:
- патент на изобретение — 20 лет;
- патент на полезную модель — 10 лет.
«В качестве полезных моделей патентуют много того, что не должно получать патентной охраны», — полагает И. Шатова. Больше того, эта система позволяет поддерживать «вечнозеленость» ЛС, поскольку при отсутствии в законодательстве требований к изобретательскому уровню полезных моделей добавление любого признака обеспечивает его новизну и, следовательно, получение новых и новых патентов. По этой же причине полезную модель практически невозможно аннулировать. Но в существовании этой нормы (она появилась сразу же после приобретения Украиной независимости) заинтересованы представители органов власти — поэтому добиться ее отмены будет сложно, считают отечественные эксперты.
Таким образом, во-первых, необходимо исключение из объектов охраны в качестве полезных моделей биологических материалов, химических или фармацевтических продуктов и процессов. К. Корреа (К. Correa), директор Центра междисциплинарных исследований по промышленной собственности и экономическому праву Университета Буэнос-Айреса, отвечая на вопрос автора статьи, отметил, что такая мера доступна странам с любым уровнем дохода и ее нельзя игнорировать. Во-вторых, следует воспользоваться предусмотренной Соглашением TRIPS возможностью исключения из числа патентуемых некоторых объектов, а именно методов диагностики, терапевтического и хирургического лечения. Последний вопрос, как отметили отечественные эксперты, почти решен, так как такое нововведение предусмотрено проектом закона о внесении изменений в соответствующие законодательные акты. Кстати, Европейское патентное бюро руководствуется принципом: «Методы лечения организма человека или животного путем хирургических или терапевтических и диагностических методов не считаются изобретениями, позволяющими промышленную пригодность».
Надо отметить, что и на уровне Объединенной Европы вопрос о применимости системы полезной модели по отношению к лекарственным средствам пока не решен. Так, законодательство ряда стран (Великобритания, Люксембург, Швеция) вообще не предусматривает подобной модели, а в других подходы в принципе те же, что и в Украине, то есть полезная модель характеризуется тремя основными особенностями:
- невысокий (по сравнению с тем, который требуется для выдачи патента) изобретательный уровень (в Украине его вообще не требуют);
- отсутствие экспертизы заявки на предмет соблюдения условий защиты;
- срок защиты не более 10 лет.
Инициатива европейского законодателя (проект Директивы COM (1999) 309 final /2), призванная гармонизировать и частично изменить законодательства стран-членов пока не привела к ощутимому результату. Проект, в частности, предусматривает исключение из объектов полезной модели фармацевтических, химических продуктов и процессов, а также биологических материалов. Кроме того, предлагается включить в число условий патентоспособности изобретательный уровень, который может быть ниже, чем требуемый для выдачи патента. Последние сведения об обсуждении проекта на тематической страничке сайта датированы 2002 г.
Иоганна фон Браун (Johanna von Braun), научный сотрудник отдела исследований в области права и политики интеллектуальной собственности Кейптаунского университета (ЮАР), в целях сохранения общественного здравоохранения предлагает еще более глубокие изменения:
- строгое определение новизны;
- установление высоких стандартов патентоспособности и исключение из числа патентоспособных новых способов использования, форм, составов или комбинаций известных ЛС;
- более точное определение промышленной пригодности, позволяющее предупредить монополию на инструменты исследований и фундаментальные исследования.
Патентоспособность «нового использования известного продукта или процесса» предусмотрена законом (см. выше). Такая норма — положение TRIPS-плюс.
Примеры.
Соглашение о свободной торговле (ССТ) все чаще предусматривает охрану нового использования. Так, согласно ССТ между США и Оманом: «Каждая сторона подтверждает, что будет выдавать патенты на новые использования известного продукта или на новые методы его применения, в частности, новые методы лечения…» (Саид М., презентация на семинаре).
Индия и Филиппины исключают из числа патентоспособных новые формы известных веществ, если только они не являются значительно более эффективными и не предполагают новые виды использования, а также комбинации известных веществ. Это может «ограничить воздействие патентов на доступ к ЛС и способствовать скорейшему выходу на рынок конкурирующих генериков» (Гровер А., 2009).
Ограничения прав патентообладателя
В соответствии со ст. 30 Соглашения TRIPS члены могут предусмотреть некоторые исключения из эксклюзивных прав, предоставляемых патентами, не допуская при этом необоснованного ограничения прав владельцев патентов и третьих лиц. На основании этой статьи возникло, в частности, положение (или исключение) Болар, дающее возможность завершения выполнения регистрационных требований к генерическому ЛС до окончания действия патента на инновационное. В целях получения разрешения на маркетинг генерика компания может импортировать, производить и использовать запатентованное ЛС. Отечественное законодательство также предусматривает аналогичное исключение. Так, в соответствии с абзацем 4 ч. 2 ст. 31 Закона не признается нарушением прав, вытекающих из патента, использование запатентованного изобретения (полезной модели) с научной целью или в порядке эксперимента. Однако данное положение не детализировано в законодательстве Украины и, как отмечает А. Миндрул, не было предметом разъяснения органами судебной власти. Поэтому она предлагает внести соответствующие дополнения в абзац 4 ч. 2 ст. 31 Закона, предусмотрев положения, аналогичные положению Болар, или как минимум отразить сущность данного положения на уровне разъяснений высших органов судебной власти (Миндрул А.В., 2010).
В ЕС согласно Директиве 2004/27/ЕС период эксклюзивности данных равен 8 годам (+ 2 года рыночной эксклюзивности, когда можно разрабатывать и подавать в регуляторные органы регистрационные материалы — положение Болар), тогда как в США — 5 лет + 3 года в случае одобрения нового показания (на последний 3-летний период распространяется положение Болар) (см. «Еженедельник АПТЕКА» № 47 (568) от 04.12.2006 г.).
Есть еще несколько видов исключений из прав патентовладельца, способствующих расширению доступа к ЛС: право преждепользования и положения, касающиеся исчерпания прав.
Так, в соответствии с ч. 1 ст. 31 Закона любое лицо, которое до даты подачи в учреждение заявки или, если заявлен приоритет, до даты ее приоритета в интересах своей деятельности с коммерческой целью добросовестно использовало в Украине технологическое (техническое) решение, тождественное заявленному изобретению (полезной модели), или осуществило значительную и серьезную подготовку к такому использованию, сохраняет право на безвозмездное продолжение такого использования или использование изобретения (полезной модели), как это предполагалось указанной подготовкой (право преждепользования). Таким образом, если третье лицо добросовестно использовало изобретение (полезную модель), объектом которого является ЛС или способ, использующийся для его производства, до даты подачи соответствующей заявки на такое изобретение (полезную модель), при соблюдении условий, определенных законодательством, данное лицо может продолжить такое использование, не нарушая при этом прав патентовладельца.
Возражения и процедура признания патента недействительным
Процедурные аспекты патентной экспертизы соглашением TRIPS полностью оставлены на попечение государств-членов, которые могут создавать механизмы строгой проверки заявок. Как пишет А. Гровер, страны могут разрешать любым лицам высказывать возражения относительно заявок как до, так и после выдачи патента (Гровер А., 2009). Такая практика может помочь более тщательной проверке заявок и уже выданных патентов, особенно если патентное ведомство перегружено и не может уделять много внимания по всем вопросам. В последнее время, продолжает он, круг сторон, наделенных правом предоставлять возражения, ограничивавшийся раньше правительствами и конкурентами, расширился и теперь включает организации гражданского общества и пациентов. И. фон Браун считает, что возражения и признание патентов недействительными:
- важное гибкое положение TRIPS;
- позволяет избегать длительных, дорогих и политически резонансных дел по оспариванию патентов;
- обеспечивает высокое качество патентов/патентных фондов.
Возможность признания недействительности патента только в судебном порядке — положение TRIPS-плюс. А. Миндрул отмечает, что в Украине не публикуются сведения о заявках на полезные модели. Кроме того, Законом не предусмотрена подача возражений третьими лицами против выдачи патента на изобретение. И после его выдачи третьи лица не могут обратиться с возражениями в Апелляционную палату (определение см. ст. 1 Закона) (Миндрул А.В., 2010). «Иными словами, — отмечает автор, — Закон не предполагает двух досудебных этапов разрешения споров, связанных с выдачей патента на изобретение (полезную модель). Отсутствие такой возможности может приводить к длительным задержкам использования соответствующего объекта различными лицами, учитывая то, что пока патент не признан недействительным, патентовладелец обладает всеми исключительными правами, включая право запрещать его использование третьим лицам. Таким образом, использование соответствующего объекта третьими лицами является неправомерным до принятия решения об аннулировании прав на изобретение (полезную модель). А как свидетельствует практика, подобные судебные процессы могут длиться годами и требовать значительных финансовых затрат».
Кроме того, возможность удовлетворения исков о признании патентов недействительными, поданных общественными организациями, объединениями пациентов или отдельными потребителями, низкая, поскольку влияние патентной охраны на субъективные интересы этой категории лиц является опосредованным.
Примеры (фон Браун И., презентация на семинаре):
Таиланд:
Заявки на патенты могут быть оспорены любым лицом на протяжении 90 дней после публикации.
2001 г. — группы пациентов успешно опротестовали заявку на патент относительно диданозина в комбинации с антацидным средством (последнее необходимо для предотвращения разрушения этого антиретровирусного средства в кислой среде желудка), поданный «Bristol-Myers Squibb». Суд признал, что комбинированный препарат не несет существенного изобретательского уровня или новизны. В результате стало возможным национальное производство препарата.
2006 г. — фонд здравоохранения и развития опротестовал патент, выданный компании «GlaxoSmithKline», на фиксированную комбинацию зидовудина/ламивудина вследствие отсутствия новизны. В результате цена на препарат была установлена на уровне не 2436 дол. США/год лечения, а 276 дол.
Индия:
Может быть оспорена как заявка, так и сам патент в течение года после его выдачи.
Организации по защите пациентов и индийские фармкомпании оспорили в патентом ведомстве страны немало заявок таких фармгигантов, как «GlaxoSmithKline», «Eli Lilly&Co.», «AstraZeneca» (). Однако такой заметный протест, как в отношении действующего патента на пегинтерферон компании «Roche», .
Бразилия в 2001 г. ввела в законодательство положение, согласно которому патент на фармацевтическое изделие/процесс требует согласования с регуляторным органом (Ag?ncia Nacional de Vigil?ncia Sanit?ria — ANVISA). «Roche» подала федеральный иск, утверждая, что ANVISA не может вмешиваться в рассмотрение заявок. Решение по делу еще не принято.
Принудительное лицензирование
Возможность выдачи принудительной лицензии, то есть использование запатентованного изобретения без согласия правообладателя, регулируется положениями ст. 31 Соглашения TRIPS. Применительно к ЛС принудительное лицензирование понимают как разрешение на маркетинг без согласия патентообладателя (ВОЗ). Декларация Доха подтверждает право стран определять основания выдачи принудительных лицензий. Чрезвычайная ситуация не является обязательным для этого условием. Детально импорт, производство и экспорт согласно принудительной лицензии предусмотрены «механизмом 30 августа» (ВТО).
В украинском законодательстве сохранен этот важный элемент гибкости TRIPS, хотя некоторые элементы представляют собой TRIPS-плюс. Так, Соглашение TRIPS не ограничивает основания для предоставления принудительной лицензии, но поскольку упомянутые в Законе «другие интересы общества» можно трактовать широко, лицензию можно выдавать на многих основаниях. TRIPS не требует «безосновательного отказа» в добровольной выдаче лицензии владельцем патента, нужен лишь негативный результат усилий ее получить в приемлемый период времени. Важнее то, что TRIPS требует выплаты патентообладателю вознаграждения, а не компенсации. Вознаграждение означает платеж за экономическую ценность, а компенсация подразумевает возмещение убытка или неполучения прибыли.
Детализация условий, при соблюдении которых Кабмином может быть выдана принудительная лицензия, была введена в ч. 3 ст. 30 Закона в процессе приведения законодательства Украины в соответствие с требованиями ВТО (Миндрул А.В., 2010). Эти условия имеют только несколько отличий от пунктов а) — j) ст. 31 Соглашения TRIPS. Так, в украинском законодательстве использование запатентованного изобретения (полезной модели) в случае чрезвычайных обстоятельств (эпидемия, стихийное бедствие, катастрофа и т.п.) не требует получения принудительной лицензии, а отнесено к исключениям из прав патентообладателя. Такой подход проще, так как не требует получения лицензии, а потому более желателен в ситуации с ЛС.
Для стран, обладающих низким производственным потенциалом, важно именно импортировать ЛС, произведенные по принудительной лицензии. Между тем пункт f) ст. 31 Соглашения TRIPS требует, чтобы товары, производимые по принудительной лицензии, использовались в первую очередь для обеспечения потребностей внутреннего рынка. Наличие этой трудности было признано в Декларации Доха, в соответствии с которой Генеральный совет ВТО заложил основу для урегулирования этой проблемы посредством решения от 30 августа 2003 г. Это решение содержится в протоколе, который в случае подписания 2/3 членов ВТО станет содержащим соответствующие изменения дополнением к Соглашению TRIPS:
- страны-экспортеры освобождаются от обязательств в соответствии с пунктом f) статьи — любое государство-член может экспортировать генерики, произведенные по принудительной лицензии для обеспечения потребностей стран-импортеров;
- обязательства стран-импортеров по выплате вознаграждения патентовладельцу по принудительной лицензии исключается для того, чтобы избежать двойных выплат. Выплата вознаграждения возлагается только на экспортирующую сторону;
- ограничения на экспорт исключаются для развивающихся и наименее развитых стран с тем, чтобы они могли осуществлять экспорт в рамках региональных торговых соглашений, когда по меньшей мере половина членов таких соглашений подпадают под категорию наименее развитых стран на момент принятия решения. Таким образом, развивающиеся страны смогут воспользоваться экономией за счет расширения производства.
Канада, Европейский Союз и еще 28 стран, включая США, подписали данное соглашение (ст. 31 bis) к концу мая 2010 г. Украинские фармпроизводители не всегда имеют возможность производить новейшие ЛС. Поэтому, по мнению участников семинара, для Украины полезно присоединиться к странам, давшим согласие на использование рассмотренного выше механизма принудительного лицензирования по крайней мере для использования системы для импорта в целях национальных чрезвычайных ситуаций или иных обстоятельствах крайней необходимости. Порядок предоставления КМУ разрешения на использование запатентованного изобретения (полезной модели) утвержден постановлением КМУ от 14.01.2004 г. № 8.
Механизм, предусмотренный решением от 30 августа, еще очень сложный и дорогостоящий, отметили зарубежные эксперты. Для того чтобы можно было экспортировать ЛС по этому механизму, надо выполнить несколько условий (ст. 31 b, Корреа К., Афива Т., доклады на семинаре):
- страна-экспортер должна предоставить информацию об объемах и странах назначения поставок (объем производства по лицензии ограничивается этим количеством, что неудобно, поскольку за год–два подготовки к поставке потребности могут измениться);
- выдаче принудительной лицензии должны предшествовать безуспешные переговоры о добровольном лицензировании;
- страна-импортер должна подтвердить отсутствие или недостаточную мощность производственных возможностей (для производителя по принудительной лицензии это минус, так как одновременно означает, как правило, и маленький рынок сбыта);
- страна-импортер должна зарегистрировать в установленном порядке импортируемые по лицензии ЛС;
- правительство страны-импортера должно урегулировать спор с патентообладателем еще до того, как им будет подан иск в суд, в противном случае судебный процесс приведет к неопределенно долгому затягиванию ситуации;
- производитель должен провести фармразработку, выполнить массу требований национальных законов относительно экспорта/импорта ЛС и защиты данных (возможность использование данных исследований патентообладателя остается под вопросом).
Главная опасность для производителя, считает К. Корреа, — опасность и интервенция со стороны патентообладатея, который, к примеру, может в какой-то момент согласиться добровольно предоставить лицензию на производство, но не той компании, которая готовится осуществить импорт по принудительной лицензии. Тогда все усилия последней пропадут даром. Непростым является также вопрос об определении суммы компенсации.
В обзоре ВОЗ отмечено, что редкость выдачи принудительных лицензий нередко используют как аргумент против их узаконивания4. Однако, сообщается там же, это верно для такой страны, как Великобритания, но США, к примеру, довольно активно используют принудительное лицензирование. Вообще, подчеркивается в обзоре ВОЗ, несмотря на частоту применения этой меры, ее принципиальное существование актуально для дисциплинирования патентовладельцев. Благодаря ей он должен будет следить за наличием своего продукта на рынке и поступаться своей монополией при необходимости, так как в противном случае третьей стороне позволят пользоваться его изобретением (полезной моделью).
Как отметил Тену Афива:
- до сих пор единственным за 6,5 года случаем использования механизма 30 августа стал эпизод между Руандой и Канадой;
- процесс получения ЛС очень медленный;
- решение станет постоянно действующим, если его ратифицирют 2/3 членов ВТО (102 страны);
- в 2010 г. Совет TRIPS собирается провести семинар по определению эффективности этого решения.
Пример:
Таиланд: по данным государственных агентств, принудительное лицензирование в отношение ЛС обеспечит в период 2007–2012 гг. .
Продолжение следует…
2Поощрение и защита всех прав человека — гражданских, политических, экономических, социальных и культурных, включая право на развитие. Доклад специального докладчика — Ананда Гровера, по вопросу о праве каждого человека на наивысший достижимый уровень физического и психического здоровья. Генеральная ассамблея ООН.?
3Вплив правової охорони інтелектуальної власності на доступ до лікарських засобів (після вступу України до СОТ). Аналітична доповідь. Міндрул А.В., завідуюча сектором авторського права НДІ інтелектуальної власності АПрН України. Київ, 2010
4

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим