|
Після ліквідації Державного комітету України з медичної та мікробіологічної промисловості, вже протягом останніх 10 років в Україні втрачена система стратегічного планування розвитку фармацевтичної галузі. Фармацевтичні асоціації головним чином переймаються дрібними проблемами сьогодення, які самі ж і створюють. Це — основна причина концептуальної невизначеності щодо основних напрямків розвитку. Тобто незрозуміло, яким шляхом крокує вітчизняна фармація — європейським? чи радянським. Невизначеність виникає внаслідок недостатнього об’єктивного аналізу ситуації, що складається на фармацевтичному ринку.
Фармацевтичний ринок України досить динамічно розвивався. Темпи його росту значно прискорилися у 2005 р., коли збільшилися соціальні виплати. Практичний досвід свідчить про те, що приріст ринку відбувається не за рахунок збільшення захворюваності, а завдяки підвищенню платоспроможності населення. З метою вивчення проблем фармацевтичної галузі майже щорічно створювалися урядові комісії, котрі робили свої висновки.
Так, у спільному звіті експертів Міністерства охорони здоров’я, Мінекономіки України, Світового банку, Європейської комісії, Шведського агентства з міжнародного розвитку «Основні шляхи подальшого розвитку системи охорони здоров’я України: спільний звіт» (2005 р.) немає зауважень відносно якості ліків, представлених на ринку України. Натомість визначено ряд проблем щодо обігу лікарських засобів:
- недосконалість чинної нормативно-правової бази та її неповна відповідність міжнародним вимогам у сфері забезпечення ліками та виробами медичного призначення;
- відсутність раціональної фармацевтичної політики на макро- та мікрорівнях;
- нераціональне використання ліків та наявного асортименту виробів медичного призначення;
- поліпрагмазія (призначення зайвої кількості лікарських засобів), порушення етапності раціональної фармакотерапії;
- обмежений вплив лікаря на використання ліків; реальний вплив на лікарські призначення фармацевтичних компаній, що здійснюють агресивну маркетингову політику.
Урядова комісія, створена за дорученням Кабінету Міністрів України від 03.07.2007 р. № 29029/1/1-07, щодо аналізу стану системи контролю за якістю ліків на чолі з головами Контрольно-ревізійного управління, за участю Антимонопольного комітету, Академії медичних наук України, Мінекономіки та Міністерства фінансів у висновку зазначила, що діяльність фармації спрямована переважно на отримання прибутків. При цьому основне завдання, що має виконуватись державою в системі охорони здоров’я, — зниження смертності та рівня захворюваності громадян при застосуванні лікарських засобів, залишено поза увагою. Не контролюється, які саме ліки приймають хворі, який ефект від лікування, чи існує позитивний їх вплив на стан здоров’я тощо.
Минулого року згідно з Указом Президента України від 24.04.2008 р. № 396 була створена міжвідомча робоча група з питань ціноутворення на лікарські засоби і вироби медичного призначення, державних закупівель та реєстрації медичної продукції. Крім того, була організована спільна місія з оцінки Європейського регіонального бюро ВООЗ, представництва Європейської комісії в Україні та агенції США з міжнародного розвитку у 2008 р.
Мені не відомо, як було враховано висновки комісій у діяльності фармацевтичної галузі, можу лише сказати, що у зазначених комісій не викликала сумнівів якість лікарських засобів в Україні, тому я не можу пояснити, чому реформування галузі почалося саме з системи контролю якості. Були проблеми дублювання функцій Державної служби лікарських засобів і виробів медичного призначення (Держслужби) та Державної інспекції з контролю якості лікарських засобів МОЗ України, рейдерські захоплення повноважень між ними.
Навколо питань якості фармацевтичної продукції протягом останніх декількох років виникає багато спекуляцій. Рік тому на сторінках видання вже висвітлювалася ця тематика (див.?«Щотижневик АПТЕКА» № 29 (650) від 28.07.2008 р.), але вона залишається актуальною і сьогодні. Як приклад можна розглянути процедуру сертифікації щодо відповідності стандартам GMP. Як свідчить відповідне положення Ліцензійних умов, провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами, GMP — належна виробнича практика — це сукупність організаційно-технічних вимог і правил, яка є частиною системи забезпечення якості і гарантує, що продукція постійно виробляється і контролюється за стандартами якості, які відповідають її призначенню, та згідно з вимогами реєстраційного досьє. Таким чином, коли виробник налагоджує виробництво лікарського засобу, то він гарантує щоденне відтворення технологічного процесу. Але коли відбувається сертифікація GMP без реєстраційного досьє, то виникають сумніви щодо гарантій.
Слід зазначити, що в європейських країнах філософія щодо ліків протилежна тій, про яку нам було відомо за часів Радянського Союзу. Суть її полягає в утриманні якомога більшої кількості споживачів за рахунок якісної продукції. З позицій довгострокового планування завдяки якісній фармацевтичній продукції пацієнти живуть довше та споживають більше ліків, адже основний споживач — це пенсіонери. При цьому виробники змагаються за технологіями, які спрямовані на зниження собівартості продукції. Технології — це їх інтелектуальна власність, і ніхто не має права втручатися в неї, а тим більше погоджувати. Держава контролює виключно якість продукції, яку пропонує виробник, та не може контролювати технологічний процес.
В Україні ж сертифікація GMP має комерційний відтінок. Нагадаємо, що після набуття чинності постановою КМУ від 14.09.2005 р. № 902 «Про затвердження порядку здійснення державного контролю за якістю лікарських засобів, що ввозяться в Україну» Державна служба лікарських засобів надала сертифікати GMP і тим самим звільнила компанію-виробника як від посерійного контролю, так і вибіркового. Де таке є у світі?
В 2007 р. Держслужба майже поглинула всі установи державного регулювання обігу фармацевтичної продукції, навіть Державну інспекцію з контролю якості лікарських засобів МОЗ України. Даний проект не реалізувався лише тому, що не вдалося визначити кандидатуру, котра мала б очолити оновлену Держслужбу. Однак сьогодні спостерігаються намагання перетягнути всі повноваження на Державну інспекцію з контролю якості лікарських засобів (Держлікінспекцію). Таким чином, внаслідок концептуальної невизначеності та відсутності певної ідеології відбувається хаотичний розвиток регуляторної політики у вітчизняній фармацевтичній галузі.
Як свідчать матеріали розширеної колегії Держлікінспекції за I півріччя 2009 р., під час здійснення державного контролю ввезених на територію України лікарських засобів з проаналізованих 46 633 було встановлено факти невідповідності 141 серії вимогам аналітично-нормативної документації до відповідних реєстраційних посвідчень. Тобто неякісної продукції на ринку України виявлено 0,3%. Згідно з даними Державної інспекції з контролю якості лікарських засобів МОЗ України щороку виявляли близько 0,04% неякісної фармацевтичної продукції на вітчизняному ринку. Таким чином, у 2009 р. Держлікінспекція покращила показники роботи у 10 разів. Але подібні коливання знаходяться в межах похибки. По суті оновлена Держлікінспекція лише підтвердила дані попередніх комісій, які свідчать, що в Україні немає проблеми якості ліків і для проведення сьогоднішніх реформ не було ніяких підстав. Дай Бог кожній галузі працювати так, щоб на 33 тис. упаковок було 100 неякісних, із яких 90 — через претензію до вторинної упаковки, які після переговорів з компанією повертаються у реалізацію.
У системі МОЗ України процедуру державної реєстрації проходять шість основних видів медичної продукції: лікарські засоби, медичні імунобіологічні препарати, біологічно активні добавки, вироби медичного призначення, медична техніка та дезінфікуючі речовини. Висновки міжвідомчої робочої групи з питань ціноутворення на лікарські засоби і вироби медичного призначення, державних закупівель та реєстрації лікарських засобів, створеної згідно з Указом Президента від 24.04.2008 р. № 396 свідчать, що найбільш розвиненою є нормативна база, яка регламентує державну реєстрацію лікарських засобів. Вона визнана кращою серед країн СНД. Так, досить чітко регламентовані процедури прийняття та розгляду реєстраційних матеріалів, підстав для призначання додаткових доклінічних і клінічних випробувань та механізмів їх проведення, передреєстраційного контролю якості, дотримання прав інтелектуальної власності, забезпечення конфіденційності матеріалів.
Система державної реєстрації решти видів медичної продукції, навпаки, відрізняється недосконалістю нормативної бази, яка створює численні передумови до корупційних проявів.
Сьогодні Держлікінспекція активно піднімає питання реформування реєстрації саме лікарських засобів під гаслом боротьби з корупцією. Але із врахуванням висновків комісії це гасло також не витримує логіки.
Болюче те, що цими реформами фактично заблокована програма діяльності Кабінету Міністрів. Нагадаю, Програма діяльності Кабінету Міністрів України «Український прорив: для людей, а не політиків» передбачає, що пріоритетами у діяльності органів виконавчої влади на всіх рівнях мають стати забезпечення високоякісної і доступної медичної допомоги. Уряд бере на себе зобов’язання щодо:
- проведення раціональної фармацевтичної політики;
- розроблення Концепції управління якістю медичної допомоги, що надається населенню, на 2008–2012 роки.
Саме на цих напрямках сконцентрована робота системи реєстрації, метою якої є не тільки дозвіл до застосування ліків, але і відстеження наслідків їх застосування. Це фармаконагляд, формулярна система, моніторинг за виконанням інструкції із застосування лікарських засобів тощо.
Усім відомо, що фармація — наукоємна галузь. Тому реєстрація лікарських засобів вимагає залучення спеціалістів з високим рівнем кваліфікації. Сьогодні держава не має коштів на розвиток нової системи реєстрації лікарських засобів, а МОЗ — відповідних кадрів та ресурсів. Останні зосереджені в Державному фармакологічному центрі, який ефективно функціонує протягом багатьох років та є аналогом державних установ, які функціонують в європейських країнах. Наприклад, в Чехії — Державний інститут контролю, в Польщі — Інститут лікарських засобів, в Німеччині — Компетентний федеральний орган, у Фінляндії — Національне бюро лікарських засобів. Всі ці установи займаються реєстрацією лікарських засобів та мають відповідний науковий та матеріальний потенціал.
Ресурси Державного фармцентру — це ресурси МОЗ, а тому за наказом міністра охорони здоров’я за власні ресурси розпочато реалізацію програми щодо створення системи стандартизації медичних послуг, зокрема раціональної фармакотерапії, без якої не може бути ні якості лікування, ні системи страхової медицини.
Основою економічної доступності медичної допомоги є раціональне використання лікарських засобів, що сприяє ефективному використанню наявних матеріальних ресурсів та запобіганню негативних явищ, таких як підвищення вартості лікування (фармакотерапії) — зменшення доступності лікування; незадовільне сприйняття фармакотерапії, зокрема ріст резистентності до протимікробних засобів, переривання лікування, порушення етапності; невиправдано велике призначення ліків (поліпрагмазія), яке призводить до збільшення випадків розвитку побічної дії лікарських засобів; відсутність позитивних результатів лікування та збільшення кількості пацієнтів з хронічними захворюваннями. Система раціонального використання ліків базується на:
а) стандартних схемах лікування, протоколах та формулярах;
б) покращенні менеджменту лікарських засобів у закладах охорони здоров’я (введення посади клінічного провізора);
в) створенні системи доведення інформації про лікарські засоби до медичного працівника, фармацевта та пацієнта, яка є важливим фактором лікарської допомоги, зокрема втілення елементарних знань про лікарські засоби серед населення та протистояння агресивній рекламі та ринковим механізмам просування лікарських засобів та виробів медичного призначення.
З метою стандартизації медичних послуг Державний фармакологічний центр вперше видав Державний формуляр лікарських засобів (Формуляр). Цей документ містить стандартні схеми лікування певних захворювань, перелік лікарських засобів, які є в обігу, міжнародні назви препаратів. Текст Формуляру погоджено з лікарями відповідного профілю і головними фахівцями. В поточному році вже реалізовано 17 тис. примірників. Першими цей документ в електронному варіанті разом з дипломами отримали випускники медичних навчальних закладів. У подальшому Формуляром мають бути забезпечені всі лікарні безоплатно, тобто за кошти Державного фармцентру. В основу вітчизняного видання покладено британський формуляр, котрий є найстарішим у світі. Однак і ця, поза сумнівом, позитивна акція потягла низку проблем. За 18 років незалежності в Україні втрачено систему доведення інформації до лікаря, а саме — які ліки використовуються і за якими схемами при тих чи інших захворюваннях. Як наслідок — спостерігається невідповідність лікарських засобів, що закуповуються державними закладами охорони здоров’я та використовуються у лікуванні пацієнтів, схемам, що передбачені Формуляром. Сьогодні чиниться тиск на Міністерство охорони здоров’я, який може викликати зворотний рух, незважаючи на те що перехід на формулярну систему дозволить скоротити витрати на ліки мінімум на 25%.
У Державному фармцентрі сьогодні працює 320 штатних працівників та 240 — позаштатних. У складі Центру задіяно 5 випробувальних лабораторій:
- фармацевтичного аналізу;
- фармако-кінетичних випробувань (біоеквівалентності in vivo) — 2;
- випробування еквівалентності методом in vitro;
- випробування активності антибіотиків.
Фармацевтична компанія, котра реєструє препарат в Україні, надає в Державний фармакологічний центр реєстраційні документи та оплачує експертизу. Ці кошти спрямовуються на утримання 5 лабораторій, які фармцентр побудував за власний рахунок. Крім того, розпочато проект інформаційного забезпечення охорони здоров’я.
Тобто за наказом міністра та відповідно до Програми дій Уряду Державний фармакологічний центр намагається вирішити одну з найактуальніших проблем галузі охорони здоров’я, оскільки лікар сьогодні не має достатньої інформації про ліки. Також за рахунок коштів, отриманих за експертизу, утримується та розвивається післяреєстраційний нагляд, перш за все фармаконагляд. Зараз його результати відповідають нормам Всесвітньої організації охорони здоров’я (ВООЗ). Фармцентр — єдина установа серед інших регуляторів фармацевтичної галузі, сертифікована ВООЗ, лабораторії якої мають європейський сертифікат GLP. Таким чином, створена ефективна система реєстрації лікарських засобів, і її потрібно розвивати.
В економіці, зокрема на ринку лікарських засобів, правила працюють так само, як закони Ньютона у механіці. Приміром, 80:20. Що це означає? При високоасортиментному ринку, яким є ринок ліків, важко простежити, який препарат дає справжній прибуток, а який — збиток. 80% ліків є майже збитковими, і лише 20% — надприбутковими. Але якщо аптека буде реалізовувати лише вигідні препарати, то пацієнт ніколи до неї не завітає. Тому необхідно якомога швидше вводити порядок відстеження наявності в аптечній мережі дешевих лікарських засобів. На час кризи слід ввести порядок виписування рецептів за міжнародними назвами, щоб пацієнт мав змогу обирати препарат з великої кількості аналогів. Це соціальна вимога. Українські аптеки мають поступово перейти на отримання прибутків не від торговельної націнки, а від обігу.
Що ж сьогодні відбувається на ринку, і що чекає нас восени?
За даними системи дослідження ринку «Фармстандарт», ринок у грошовому вираженні зростає, а в упаковках падає, формально це означає що підвищуються ціни (рис. 1).
|
||||||
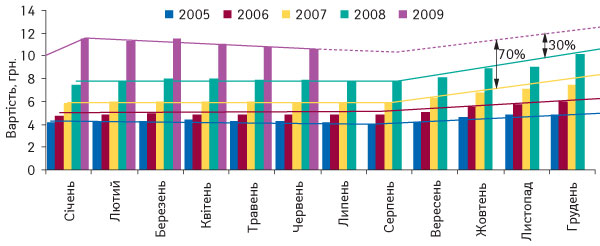
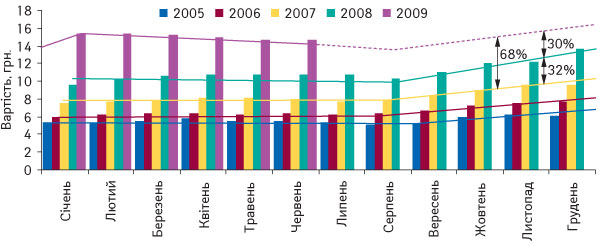
Вартість аптечного кошика щороку зростає, при цьому темпи приросту цін з кожним роком збільшуються. Підвищення вартості фармацевтичної продукції традиційно відбувається восени (рис. 2). І тільки в цьому році воно продовжувалося в І кв. Те ж відбувається і з лікарськими засобами (рис. 3).
|
||||||
|
||||||
Слід зазначити, що у нинішньому році немає підстав для зміни цих тенденцій, а тому можна прогнозувати підвищення вартості восени як лікарських засобів, так і аптечного кошика.
За оптимістичним сценарієм, якщо утримається курс гривні відносно основних видів валют, ціни на всі категорії товарів аптечного кошика підвищаться на 30% порівняно з такими минулої осені. Якщо порівнювати з відповідним періодом 2007 р., то ціни зростуть майже в 2 рази.
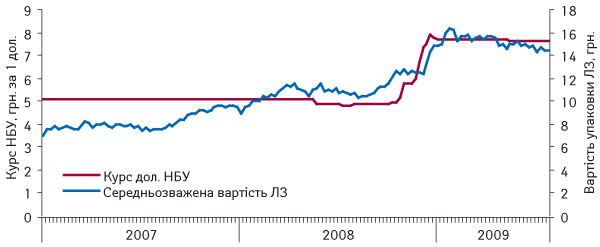
Враховуючи, що коефіцієнт кореляції між курсом долара і середньозваженою вартістю становить 0,94 (рис. 4), то можна стверджувати, що у разі девальвації гривні вартість ліків підвищиться більше, ніж було прогнозовано вище (див. рис. 2, 3).
|
||||||
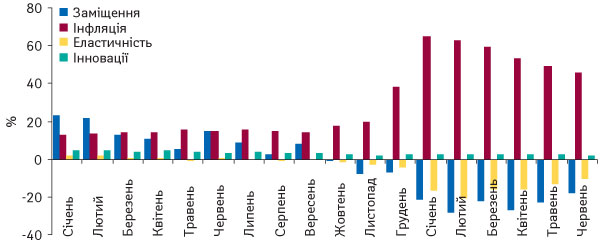
Викликає особливе занепокоєння аналіз факторів, за рахунок яких змінюється структура споживання ліків (рис. 5).
|
||||||
Інфляційний фактор фактично віддображає темпи росту цін на ліки.
Що стосується фактора заміщення, то у 2008 р., коли ще не галопувала інфляція в Україні, відмічався певний рівень заміщення дешевих ліків на більш високовартісні. Поступово ціни почали зростати, платоспроможність населення знизилася, і вже у 2009 р. цей фактор «пішов у мінуси», тобто частина споживачів почала переходити на більш дешеві ліки, тобто незважаючи на «страшилки» про якість, почалося зворотне заміщення дорогих ліків більш дешевими.
З кінця минулого року серед показників, котрі характеризують вітчизняний фармацевтичний ринок, з’явився та почав демонструвати зниження показник еластичності. Фактор еластичності свідчить про те, що існує певна кількість ліків, які пацієнти завжди купували, а зараз припинили робити це через їх економічну недоступність. Тобто сьогодні вже є частина населення, яка ходить в аптеку лише на екскурсію. Мабуть, слід очікувати, що восени відбудеться загострення всіх вищезазначених проблем, тобто через 2 міс в українській фармацевтичній галузі виникне чергова дуже суттєва криза.
У минулому році ми попереджали (див.?«Щотижневик АПТЕКА» № 29 (650) від 28.07.2008 р.), що через розкрутку міфу «не дай Боже, полізете у ціноутворення» можуть виникнути проблеми – не повірили, полізли, отримали кризу, до якої ще приєдналася і фінансова.
До речі хочу нагадати, що, крім міфів про якість ліків, є не менш популярні оповідки про безпеку, яку безбожно плутають ратники керівництва Держлікінспекції. А саме — інспекція має відстежувати фармацевтичну безпеку лікарських засобів, тобто стерильність, пірогенність тощо. А вони попрямували у фармакологічну — це вже і не смішно, коли в Україні постійно плутають фармацію з фармакологією.
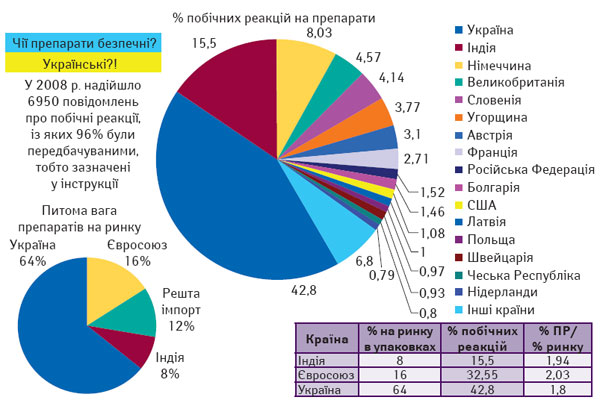
На рис. 6 наведені дані щодо питомої ваги країн, ліки яких представлені на ринку України, та відповідну питому вагу споживання цих ліків в упаковках. Поділивши відсоток побічних реакцій та відсоток ринку, отримаємо коефіцієнт безпеки лікарських засобів, який коливається у межах 2. Тобто і українські, й індійські, й ті, які надходять із країн Євросоюзу, мають однаковий коефіцієнт безпеки. Ці дані потребують більш детального аналізу, але це вже інша історія.
|
||||||
Віктор Чумак,
директор Державного фармакологічного
центру МОЗ України

 За роки незалежності України в умовах концептуальної невизначеності та протиріч між радянським світоглядом фахівців та європейськими нормами, у фармацевтичній галузі накопичилася низка проблем, які потребують першочергового вирішення. Майже щороку створюються урядові комісії, висновки яких не враховуються під час певних змін у системі регуляції обігу фармацевтичної продукції. Але проблема доступності лікарських засобів для населення, яка є основною у системі охорони здоров’я, так і залишається невирішеною. Можна впевнено констатувати, що реформування галузі, яке було розпочато наприкінці минулого року, не наблизило Україну до вирішення цих питань. Навпаки, відбулося їх критичне загострення. Чому не вдається збудувати ефективну модель державного регулювання в сфері обігу лікарських засобів, та які прогнозуються найближчі перспективи розвитку фармацевтичного ринку? З такими запитаннями кореспондент «Щотижневика АПТЕКА» звернулася до фахівця, котрий мав безпосереднє відношення до формування українського ринку лікарських засобів Віктора Чумака, директора Державного фармакологічного центру МОЗ України.
За роки незалежності України в умовах концептуальної невизначеності та протиріч між радянським світоглядом фахівців та європейськими нормами, у фармацевтичній галузі накопичилася низка проблем, які потребують першочергового вирішення. Майже щороку створюються урядові комісії, висновки яких не враховуються під час певних змін у системі регуляції обігу фармацевтичної продукції. Але проблема доступності лікарських засобів для населення, яка є основною у системі охорони здоров’я, так і залишається невирішеною. Можна впевнено констатувати, що реформування галузі, яке було розпочато наприкінці минулого року, не наблизило Україну до вирішення цих питань. Навпаки, відбулося їх критичне загострення. Чому не вдається збудувати ефективну модель державного регулювання в сфері обігу лікарських засобів, та які прогнозуються найближчі перспективи розвитку фармацевтичного ринку? З такими запитаннями кореспондент «Щотижневика АПТЕКА» звернулася до фахівця, котрий мав безпосереднє відношення до формування українського ринку лікарських засобів Віктора Чумака, директора Державного фармакологічного центру МОЗ України.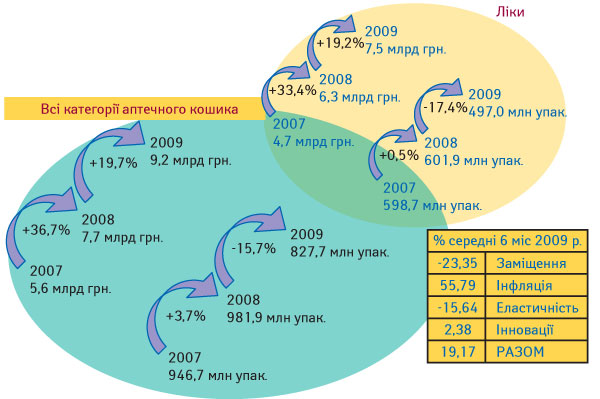
Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим