Увага: пелюшки, соски та презервативи здорожчають щонайменше на 20%!
Звертаємо увагу, що 1 серпня 2011 р. в «Офіційному віснику» опубліковано постанову КМУ від 09.06.2011 року № 785 «Про перелік виробів медичного призначення, операції з постачання яких звільняються від оподаткування податком на додану вартість». Згідно з ним, з ПДВ повинні відпускатися пелюшки, презервативи, памперси, соски та ін. Також зверніть увагу на зміну кодів товарів.
Недоступная доступность лекарств, Украина без аптечных киосков!
Сегодня самая актуальная и злободневная ситуация на отечественном фармрынке сложилась вокруг возможной ликвидации в городах Украины такого структурного подразделения, как аптечный киоск.
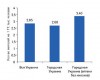
НАВСТРЕЧУ НОВЫМ РЕКОРДАМ! Аптечные продажи лекарственных средств в Украине по итогам I полугодия 2011 г.
По итогам 1 полугодия 2011 г. объем аптечных продаж лекарственных средств достиг 11 млрд грн. за 587 млн. упаковок.
Обговорення проекту Ліцензійних умов наближається до завершення
26 липня у Держлікслужбі України відбулася завершальна нарада з дистриб’юторами та представниками роздрібної ланки
Игры для взрослых: самые доходные акции фармацевтических компаний
Акции игроков Большой Фармы пользуются неизменной популярностью у инвесторов, рассматривающих подобное вложение средств как один из надежных способов получения стабильного дохода и удорожания капитала.
Опубліковано Державну програму розроблення новітніх технологій створення вітчизняних ліків
Орієнтовний обсяг фінансування Програми становить 2700 млн грн., у тому числі за рахунок державного бюджету — 1200 млн грн.
Правовий висновок щодо проекту Ліцензійних умов: відповіді на ключові запитання
Із метою пошуку відповідей на ключові питання щодо проекту Ліцензійних умов редакція «Щотижневика АПТЕКА» звернулася з інформаційним запитом до НДІ правового забезпечення інноваційного розвитку Національної академії правових наук України та отримала відповідь
У Держлікслужбі відбудуться наради з метою обговорення проекту Ліцензійних умов
19 липня - з виробниками лікарських засобів та дистриб’юторськими компаніями; 22 липня - з представниками роздрібної ланки аптечного бізнесу і громадських організацій
Обговорення проекту Ліцензійних умов: слово має роздрібна ланка
12 липня в Держлікслужбі відбулася нарада за участю представників регуляторних органів та аптечного сегменту з метою обговорення проекту Ліцензійних умов
Відбулось засідання парламентського Комітету з питань охорони здоров’я
Обговорено заходи щодо захисту вітчизняного ринку від неякісних і фальсифікованих ліків та вдосконалення цінової політики у сфері обігу лікарських засобів та виробів медичного призначення