|
Валерий Карамавров, коммерческий директор ООО «Фармацевтическая компания «Здоровье»
«Давайте будем честными перед собой: советская идеологическая концепция «дешевых лекарств» себя исчерпала. Она уничтожает отечественную промышленность, она провоцирует подделывание лекарств, она не позволяет развиваться отечественному фармбизнесу и, в итоге, вредит пациентам. Думаю, что пришло время новой идеологии: «Дешевые — плохие лекарства». Плохие — это значит неэффективные, небезопасные и некачественные»
(М. Гетьман. Большая Фарма).
Итак, сформулируем в качестве императива: вся деятельность отечественной фармации подчинена идее обеспечения пациента КАЧЕСТВЕННЫМИ медикаментами. Кроме того, вследствие отсутствия сколько-нибудь значимой системы компенсации государством стоимости медикаментов населению, лекарственные препараты также должны быть экономически доступны потребителю. В противном случае украинский пациент не всегда сможет получить адекватную медикаментозную терапию.
Будем реально оценивать собственные возможности (хотя так сложно отказываться от ощущения, что «все мы немного «Пфайзеры») и признаем, что понятие «адекватная медикаментозная терапия» редко связано с оригинальными украинскими препаратами, а базируется, в подавляющем большинстве, на воспроизведенных лекарственных средствах в популярной «доступной ценовой категории». Чаще всего подобные препараты классифицируются как генерики только на основании того, что они содержат то же действующее вещество, что и брэндовый продукт.
«То есть, если, например, «восточноевропейская» фирма (название фирмы изменено редакцией) регистрирует генерик, регистрационное досье и технологию получения которого она купила в известной фирме, то весьма велика вероятность того, что свойства препарата, произведенного «восточноевропейской» фирмой, будут такими же, как и у известной фирмы, чего не скажешь об отечественном генерике, где изменено все (не установлены критерии, влияющие на биодоступность субстанции, вспомогательные вещества, технология и оборудование производства и отсутствуют данные по биоэквивалентности )»
(К стратегии внедрения правил GMP в странах СНГ — иллюзии и реальность).
Творческий процесс разработки нового продукта, называемый по-разному: «производство препарата-генерика», «импортзамещение» — еще один замечательный по своей наивности термин, — с различной степенью успешности ведется на десятках фармацевтических заводов Украины, исправно пополняющих свои прайс-листы все новыми строками «доступных современных лекарств». При этом степень успешности разработки — далеко не риторический оборот, а совершенно четкий набор характеристик препарата: токсикологических, фармакокинетических, фармакодинамических, фармакотерапевтических, определение которых эту самую степень успешности и характеризует объективно.
Следствием подобного многофакторного анализа продукта становится стопроцентная уверенность, что пациент получает лекарственное вещество в необходимой дозировке, с заданной скоростью распределения его в организме, что дает возможность ожидать проявления терапевтического эффекта, описанного для оригинального препарата и подтвержденного многочисленными испытаниями.
Надлежащая производственная практика — идеальный рецепт решения проблемы некачественных лекарств?
Смысловая нагрузка принципа производства в соответствии с нормами GMP состоит в подтверждении достоверной воспроизводимости результатов процесса в вариабельных условиях. В целом же концепция выпуска качественных препаратов включает, в первую очередь, разработку оптимального состава (рецептуры) препарата, а также разработку технологии производства продукта. GMP при этом остается только способом гарантированного воспроизводства указанного состава с установленной технологией.
Научный базис — разработка состава препарата и технология его производства — обеспечивает эффективность и безопасность лекарственного средства, а GMP подтверждает, что эти характеристики продукта будут обязательно воспроизведены. И только оба направления вместе гарантируют достижение концепции качества, подразумевающей эффективность и безопасность медикаментов, как комплексного понятия.
Но ведь GMP не помешает?
Форсированный перевод производства на стандарты надлежащей производственной практики будет осуществляться за счет внутренних резервов предприятия. Бюджет данного процесса может достигать не одного десятка миллионов долларов. Что это означает? Завод превращается в стройплощадку, которая забирает все «кровно» заработанные предприятием деньги.
Расходы на научно-исследовательскую деятельность фирмы Teva Pharmaceutical убедительно свидетельствуют о наукоемкости процесса воспроизводства генерических препаратов, не говоря уже о разработке собственных оригинальных молекул.
|
Расходы и доходы от операций Teva Pharmaceutical Industries Ltd – производителя генериков № 1 во всем мире. |
||||||
|
? |
2001 г. |
2000 г. |
1999 г. |
|||
|
Продажи, млрд дол. США |
2,077 |
100% |
1,750 |
100% |
1,282 |
100% |
|
Расходы на R&D, млн дол. США |
169 |
8,1% |
132 |
7,5% |
92 |
7,2% |
(По данным Teva Pharmaceutical Industries Ltd, Annual Report, 2001)
Все то, что мы назвали: «разработка оптимального состава (рецептуры) препарата», изучение зависимости от данного состава токсикологических, фармакокинетических, фармакодинамических, фармакотерапевтических характеристик и весь остальной перечень работ — позволяет определить, насколько воспроизведенный препарат идентичен брэнду.
Концентрация средств только на проекте форсированного внедрения GMP означает остановку всех научных проектов, направленных как на разработку новых продуктов, так и на деятельность по улучшению характеристик препаратов, производимых в настоящее время. Другими словами, не только невозможно стать на цивилизованный путь «копировщиков» (иногда их еще называют «генерическими производителями»), но и крайне сложно продолжать даже сегодняшний творческий процесс «воспроизводства» генериков.
Помимо этого, не следует забывать и о продвижении выпускаемой продукции. Высокий уровень конкуренции в отрасли выдвигает жесткую формулировку: «Безмолвные лекарства — невостребованные лекарства». Рост рыночной доли маркетингориентированных компаний, оказывающих мощную рекламную поддержку своей продукции, — наглядное тому подтверждение:
|
Динамика роста продаж и рейтинговой позиции на украинском фармацевтическом рынке компании «Берлин-Хеми Менарини Групп»* |
|||
|
Период |
Рыночная доля |
Прирост рыночной доли |
Рейтинговая позиция |
|
I кв. 2003 г. |
2,34% |
? |
5 |
|
I кв. 2004 г. |
3,43% |
47% |
1 |
Базируясь на имеющихся данных и анализируя их, можно с уверенностью утверждать, что фокусирование финансовых усилий украинского производителя на крайне важном, но далеко не единственном аспекте обеспечения качества выпускаемых препаратов — GMP может означать потерю темпа развития в угоду формальному подходу к системе качества.
«Лес рубят — щепки летят»: немного о щепках.
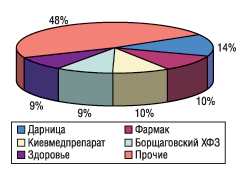
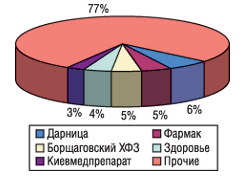
Необходимо учитывать, что если для ведущих отечественных производителей форсированное внедрение GMP означает форс-мажорную ситуацию, то для подавляющего большинства предприятий менее масштабных и располагающих меньшими ресурсами для переоснащения производства в соответствии с европейскими стандартами ситуация может стать просто критичной и привести к закрытию предприятий, не успевших полностью внедрить GMP к требуемым срокам. Что это означает для потребителей и отечественной фармацевтической промышленности — несложно представить, если проанализировать данные о рыночной доле первой, или «большой», пятерки лидеров украинской фарминдустрии (см. рис. 1–2).
|
|
Да, почти 52% объема аптечных продаж приходится на долю тех, кто, по-видимому, сможет изыскать средства для переоснащения предприятия в соответствии со стандартами GMP. Однако не следует забывать и о тех, кто производит еще 48% отечественных медикаментов. Настойчиво предлагаемый в настоящее время сценарий развития событий интересен, в первую очередь, производителям, которые значительно продвинулись на пути сертификации отдельных участков своих производств. Уже сегодня эти предприятия прилагают определенные усилия к форсированному введению GMP. Целью этих действий является устранение конкурентов из числа заводов, не имеющих сертификатов GMP. Подобная попытка государственного регулирования рыночных отношений, на наш взгляд, отражает лишь недееспособность маркетинговой политики предприятия, не позволяющей ей выделить свою продукцию из зоны конкуренции исключительно по ценовому параметру. Как пример регламентации рыночных отношений под прикрытием лозунгов о «качественных лекарствах для народа» достаточно вспомнить так называемые цефалоспориновые войны, в которых по разные стороны баррикад оказались как предприятия, имеющие сертификаты GMP, так и не имеющие оных. Несмотря на декларируемые концептуальные различия в качестве выпускаемых антибактериальных препаратов, «оружием» и у тех, и у других производителей по-прежнему остается готовность к снижению цены на продукт.
«Интересы пациента и передовых предприятий отрасли»: удивительное рядом!
«Игнорирование субъектами хозяйствования законодательства Украины не может быть поводом для очередного изменения сроков относительно реформирования социально важной сферы здравоохранения вопреки интересам пациента и передовых предприятий отрасли».
(В.Чумак. Сроки введения GMP и реформы отечественной системы здравоохранения. По ком или по чем льем слезы?
«Еженедельник АПТЕКА», № 28 (449))
На самом деле, удивительного очень много, причем удивительно много печального. Засилье «заводиков с дымящейся трубой» (здесь и далее приведены цитаты и стилистика статьи), которые на «приспособленном оборудовании» производят «поделки», которые затем совершенно непостижимым образом попадают к пациенту при совершенно непонятном попустительстве контролирующих органов, один из представителей которых печально сетует на «формальность требований фармстатей», не позволяющих стать фильтром для данных «поделок». «Убогие предприятия» (одно их извиняет: «очень стараются» удовлетворить хотя бы формальные требования фармстатьи) штампуют «лекарства сомнительного качества» и, что особенно возмутительно, позволяют себе дублировать продукцию «передовых предприятий отрасли».
В связи с этим, повторимся, позиция ведущих предприятий отрасли кристально прозрачна и вполне логична. В сложившейся ситуации непонятно только одно: почему проблема GMP так остро волнует «передовые предприятия»? Ведь в понятие «передовой», по-видимому, вкладывается не только готовность к валидации производства. Это комплексное понятие, отражающее всю успешность деятельности в отношении продуктов, маркетинга, рекламы, дистрибьюции и пр. И если это так, то зачем необходимо государственное регулирование процесса, в котором часть предприятий просто «обречена» на успех, благодаря наличию сертификата GMP? Именно саморегулирующийся, эволюционный, а — самое главное — рыночный процесс развития отечественных производителей является залогом того, что все больше пациентов будут получать эффективную медикаментозную терапию, в которой не будет места низкокачественной продукции заводов, которые в статье В. Чумака метко определены как обладатели «дымящейся трубы». Единственное, что вызывает недоумение, так это объединение в указанной статье интересов пациента и «передовых предприятий». Отрадно, что интересы пациента оказались, по крайней мере, на первом месте.
Настойчиво избегая аналогий…
« — К тому же, — продолжал начальник, — у нас еще не выработана система обучения, а старая, конечно, никуда не годится. Пока что мы реквизировали 600 роялей. Ведь ребенок должен засыпать и просыпаться под музыку…!
— Им бы носовых платков, Адольф Иваныч. Сколько раз я Вам доклад писала: дети прямо в стены сморкаются.
— Ах, товарищ! Разве в этом дело, — задергался вдруг начальник. — Теперь, когда мы вырабатываем систему, детали только сбивают с толку!»
(Н. Тэффи. Дети)
Однозначная оценка любого процесса всегда вредит пониманию. В данной статье мы предлагаем свое, возможно, спорное, видение обсуждаемой проблемы. Ускоренное государственным регулированием внедрение GMP — это форс-мажорная ситуация для очень многих предприятий отрасли, которую можно назвать «бегом марафонской дистанции в темпе стометровки». Проблема, на наш взгляд, заключается в том, что, даже пережив все это, мы, в конечном итоге, можем все равно не достичь главного результата: обеспечения населения Украины высококачественными отечественными препаратами, не уступающими по эффективности и безопасности импортным аналогам. А не сможем потому, что «качественное лекарство» — это, образно говоря, функция не одной переменной (стандартов надлежащей производственной практики), а еще и многих других, например, научно-исследовательской работы, которая также требует значительных расходов. Увы, внедрение GMP и работа по освоению новых лекарственных средств для многих предприятий могут стать взаимоисключающими.
В то же время плановый переход на работу в соответствии со стандартами GMP, подразумевающий сертификацию ВСЕХ производственных участков в соответствии со сроками собственных инвестиционных проектов предприятий, учитывающих развитие всех трех стратегических направлений деятельности — научных разработок, качества производства, маркетинга — и является, на наш взгляд, реализацией комплексной программы системного развития украинской фармации, позволяющей эволюционировать отрасли в соответствии с принципами свободной конкуренции.?o
Валерий Карамавров, коммерческий директор ООО «Фармацевтическая компания «Здоровье», фото предоставлено компанией
|


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим