Сегодня в Украине проходит обсуждение новой редакции закона «О лекарственных средствах», в том числе рассматриваются вопросы структуры и функционирования контролирующих органов.
Читатели «Еженедельника Аптека» знакомы с системой лицензирования и другими видами контроля за обращением лекарственных средств в Европейском Союзе (ЕС), в состав которого планирует войти и Украина. Однако ЕС является надгосударственной структурой, которой делегирована только часть полномочий государств-членов, необходимая для решения проблем, выходящих за рамки национальных. Соответственно и все законодательные, административные положения ЕС, а также органы, осуществляющие контроль за обращением лекарственных средств, лишены национальных особенностей.
В этой связи вызывает интерес национальная система контроля за обращением лекарственных средств одной из стран — членов ЕС. Несмотря на то, что Великобритания присоединилась к ЕС только в 1973 г., спустя 16 лет после его образования, британские эксперты внесли весомый вклад в разработку и усовершенствование европейского законодательства о лекарственных средствах. Национальное законодательство Великобритании приведено в соответствие с законодательством ЕС. Тем не менее, система контроля за лекарственными средствами в стране, которая всегда свято хранила свои традиции, имеет определенные особенности.
КРАТКИЕ ИСТОРИЧЕСКИЕ СВЕДЕНИЯ
Британский исследователь Р. Пенн в статье «Государственный контроль за лекарственными средствами: первые 3000 лет» (1979) отмечает, что уже в Древней Греции и Египте, в I тысячелетии до нашей эры, обращение лекарственных средств контролировали официальные лица [6]. Что касается Великобритании, то начало государственному контролю за лекарственными средствами в стране было положено значительно позже, во времена правления Генриха VIII (1491–1547). Контроль состоял в том, что Королевский медицинский колледж в Лондоне получил право назначать четырех членов совета колледжа в качестве инспекторов для проверки аптекарских товаров в пределах Лондона и его предместий с правом уничтожения дефектной продукции [2]. В Шотландии указом короля Якова VI (1599 г.), сына Марии Стюарт, аналогичное право осуществлять контроль за поступающими в продажу лекарственными средствами было предоставлено Факультету терапевтов и хирургов в г. Глазго.
Начиная с XVII в. в Великобритании ввели новую форму контроля за качеством лекарственных веществ — фармакопеи — официально утвержденные перечни лекарственных веществ с инструкциями о том, как их следует приготавливать. Были опубликованы: Лондонская (1618 г.), Эдинбургская (1699 г.) и Дублинская Фармакопеи (1807 г.). Наконец, была разработана Британская Фармакопея (1864 г.), которую можно считать первой удачной попыткой международной гармонизации стандартов, предъявляемых к качеству лекарственных средств. Недаром во вступлении к первому изданию Британской Фармакопеи было отмечено, что перед фармакопейными «комитетами Лондона, Эдинбурга и Дублина стояла трудная задача, попытки решения которой ранее заканчивались неудачей, — привести к единому стандарту процессы и спецификации трех различных фармакопей и, что представляло значительно большую трудность, согласовать различное применение (лекарственных средств) в аптеках и назначение их людьми трех стран, которые до сих пор в этом отношении были обособленными и независимыми» [5].
|
В конце XIX в. было создано Фармацевтическое общество Великобритании и принято законодательство, обеспечивающее контроль за приготовлением медицинских ядов и розничной торговлей ими, а в 1925 г. был издан закон «О терапевтических субстанциях», обеспечивающий контроль за беспримесностью биологических препаратов (1925 г.). Этим законом была введена система лицензирования производителей с предварительной инспекцией предприятий, проверкой квалификации их персонала и ведением документации. Кроме того, были приняты первые требования к маркировке: следовало указывать производителя и номер каждой производственной партии препарата.
После создания Национальной службы здравоохранения в 1948 г. был организован Комитет по классификации патентованных лекарственных средств, более известный как «Комитет Коэна» (его первым председателем был лорд Коэн). Однако в функции Комитета входил только контроль за целесообразностью назначения тех лекарственных средств, которые уже находились в продаже, и самой «суровой» санкцией Комитета было отнесение препарата к таким средствам, в отношении которых «терапевтический эффект не доказан». В те годы ни один государственный орган Великобритании не был наделен полномочиями воспрепятствовать, в случае необходимости, внедрению на рынок нового лекарственного препарата.
В 1963 г. (после трагедии, вызванной применением талидомида) был организован Комитет по безопасности лекарств (Committee on Safety of Drugs). Он состоял из группы экспертов в области медицины, фармации, фармакологии, токсикологии и статистики. Фармацевтические компании дали согласие предоставлять Комитету информацию о своей продукции и действовать в соответствии с его рекомендациями. Однако, как следует из названия Комитета, в его функции входило преимущественно изучение безопасности лекарственных средств, хотя члены Комитета и указывали на то, что безопасность препарата неразрывно связана с другими базовыми характеристиками — эффективностью и качеством.
ЗАКОН «О ЛЕКАРСТВЕННЫХ СРЕДСТВАХ»
В основе современной системы контроля за обращением лекарственных средств в Великобритании лежит закон «О лекарственных средствах» (Medicines Act, 1968). Он был принят парламентом и подписан королевой (после получения королевской санкции законопроект приобретает статус закона) в октябре 1968 г., а вступил в силу только через 3 года — в сентябре 1971 г. В законе не только были сведены воедино все ранее разработанные законодательные положения о лекарственных средствах, но и включен целый ряд принципиально новых.
Теперь законодательно подкрепленное проведение контроля за лекарственными средствами в Великобритании (как и в других странах ЕС со времени принятия первой директивы — 65/65/ЕЕС) стало базироваться только на трех критериях оценки лекарственных средств — безопасности, эффективности и качества (БЭК). Согласно закону была введена всеобъемлющая система лицензирования, которая позволяла осуществлять контроль за производством, снабжением, продажей и импортом лекарственных препаратов. Занятие любым из этих видов деятельности без соответствующей лицензии или сертификата стало незаконным. Однако был предусмотрен специальный переходный период (1 год со дня вступления закона в силу), в течение которого производителям и дистрибьюторам лекарственных средств в качестве исключения из установленных законом правил разрешалось продолжать свою деятельность, не имея торговой лицензии на препарат, уже размещенный на рынке.
МЕХАНИЗМЫ, ОБЕСПЕЧИВАЮЩИЕ ИСПОЛНЕНИЕ ЗАКОНА
«Лицензирование по праву»
К окончанию переходного периода (сентябрь 1972 г.) Управление по лицензированию должно было выдать лицензию на каждый такой препарат. Однако в Великобритании число препаратов, поступивших в обращение задолго до принятия закона 1968 г., составляло несколько десятков тысяч. Было очевидно, что выдать за такой срок лицензии на основе проведения полноценной оценки их БЭК невозможно. Поэтому, чтобы закон формально «заработал», лицензии выдавали на все препараты, и процесс их выдачи по сути был не лицензированием, а простым актом регистрации. Эти лицензии получили название «лицензия на препарат, полагающаяся по праву» (то есть выдаваемая автоматически) — «product licence as of right» (PLR). Естественно, что такой подход требовал проведения в ближайшем будущем полноценной ревизии препаратов на основе оценки БЭК. Тем более, что к этому обязывали и директивы ЕС, согласно которым переоценку лекарственных препаратов в соответствии с новыми требованиями следовало закончить к маю 1990 г. Согласно статье 4 закона «О лекарственных средствах», эта работа была поручена специальному Комитету по пересмотру лекарственных средств (Committee on the Review of Medicines — CRM), который был создан в 1975 г., а после выполнения поставленной перед ним задачи прекратил свою деятельность (весной 1991 г.). Этот комитет относился к консультативным органам, поэтому давал рекомендацию Управлению по лицензированию о том, какое решение следует принять в отношении лицензирования того или иного лекарственного препарата.
Когда CRM приступил к работе, в Великобритании насчитывалось 39 тыс. препаратов, на которые были выданы PLR. Многие препараты производили в небольшом количестве, часто на заказ (например, для аптек местных лечебных учреждений). В это число входило и около 6 тыс. препаратов с PLR, пересмотр которых директивы ЕС не обязывали закончить к 1990 г.: гомеопатические средства, препараты крови, иммунологические и радиофармацевтические препараты. Их переоценку проводили позже, в соответствии с положениями специальных директив ЕС, разработанных для этих средств, а также с учетом некоторых особенностей их лицензирования (например, согласно Директиве 92/73/EEC гомеопатические средства регистрируют по упрощенной процедуре, при этом лицу, подающему заявку, необходимо привести только доказательства безопасности и качества препарата, но не его эффективности).
За период 1975–1990 гг. CRM провел переоценку и выдал новые лицензии на 5300 лекарственных препаратов (из 33 000!). Лицензии PLR на все остальные препараты были либо аннулированы Управлением по лицензированию по рекомендации CRM, либо их владельцы сами отказались от последующего лицензирования. Однако параллельно с проведением переоценки давно применяемых лекарственных препаратов уже начала функционировать новая система лицензирования, при этом для получения лицензии на препарат, впервые поступающий в обращение, требовалось представить все данные, подтверждающие его БЭК.
Создание независимых консультативных органов
В соответствии с законом 1968 г. работа системы лицензирования Великобритании была коренным образом перестроена. Был создан целый ряд новых учреждений, а многие государственные органы были реформированы и переименованы.
В связи с введением жесткого контроля за лекарственными средствами и с тем, что решение уполномоченного органа (Управления по лицензированию) могло существенно влиять на состояние дел фармацевтических компаний и других заинтересованных сторон, в законе большое внимание уделено созданию ряда независимых консультативных органов. Эти органы не наделялись правом принимать какое-либо решение, однако их обязательное (согласно закону) создание и функционирование обеспечивало беспристрастность и взвешенность принимаемого решения. Создание таких органов (комитетов) предусмотрено статьей 4 закона «О лекарственных средствах», поэтому все консультативные комитеты, которые впоследствии были образованы на основании данной статьи, даже те, которые созданы в последние годы, известны в Великобритании под названием «комитеты 4-й статьи» или «комитеты S4» («S4 Committees»)». Количество комитетов S4 не является постоянным и зависит от насущных потребностей системы контроля за лекарственными средствами, поэтому со временем одни комитеты создаются, а другие — распускаются.
Можно выделить ряд общих свойств, характерных для комитетов S4, что обусловлено их независимым статусом:
-
члены комитетов назначаются министрами здравоохранения;
-
члены комитетов назначаются сроком на 3 года, но могут назначаться неоднократно;
-
почти все члены комитетов являются специалистами высочайшей квалификации, однако в состав комитетов могут входить несколько представителей общественности;
-
комитеты обычно имеют соответствующие экспертные подкомитеты, специалисты которых не являются штатными сотрудниками Агентства по контролю лекарственных средств и могут проводить независимый анализ БЭК;
-
комитеты дают только рекомендации, а окончательное решение принимает Управление по лицензированию.
Кроме того, следует отметить еще один существенный момент: во избежание конфликта интересов члены комитетов и подкомитетов обязаны регулярно подавать и затем публиковать, не указывая конкретные суммы, декларации о личной и неличной заинтересованности в отношении конкретных фармацевтических компаний (например, получение грантов, финансовой помощи для участия в конференциях, их проведении, оплачиваемые консультации, владение акциями компаний, проведение клинических испытаний и др.). Если у одного из членов комитета существует конфликт интересов, он не имеет права участвовать в заседании, на котором решается соответствующий вопрос.
Такие декларации обязаны составлять и служащие Агентства по контролю лекарственных средств, а также служащие практически всех государственных учреждений, чтобы гарантировать объективность при решении вопросов.
Однако сначала была создана Комиссия по лекарственным средствам (1968 г.). Именно на нее, наряду с другими консультативными функциями, законом (ст. 4) была возложена особая задача: вносить рекомендации о необходимости создания того или иного комитета S4 с определением его обязанностей.
В 1971 г. был создан один из важнейших независимых консультативных органов — Комитет по безопасности лекарственных средств (Committee on Safety of Medicines) — путем реформирования прежнего Комитета по безопасности лекарств (Committee on Safety of Drugs). Комитет дает рекомендации Управлению по лицензированию по вопросам государственной политики в сфере лекарственных средств, проводит независимую оценку БЭК лекарственных препаратов, содержащих новые активные субстанции, участвует в мониторинге безопасности лекарственных препаратов, поступивших на рынок, а также в рассмотрении апелляций по поводу неблагоприятного для заявителя предварительного решения Управления по лицензированию.
Также были созданы: Комитет по стоматологическим и хирургическим материалам, Комитет по ветеринарным препаратам и уже упоминавшийся Комитет по пересмотру лекарственных средств. Значительно позже на основании ст. 4 был образован Консультативный совет по регистрации гомеопатических препаратов (1994 г.).
В 1970 г. был создан еще один консультативный орган — Комиссия по Британской Фармакопее, которая заменила ранее действующую комиссию, назначаемую Главным медицинским советом Великобритании. (Ранее действующая комиссия была создана в XIX в., после принятия в 1858 г. закона «О медицине», согласно которому она отвечала за разработку первой Британской Фармакопеи). В настоящее время кроме ответственности за издание Британской Фармакопеи, в функции Комиссии входит присвоение национальных Британских общепринятых названий (BAN) активным фармацевтическим субстанциям и международное сотрудничество в рамках Европейской фармакопейной комиссии. Фармакопея является важным, установленным законом, компонентом системы контроля за обращением лекарственных средств. Закон Великобритании, как и других стран, обязывает соблюдать фармакопейные стандарты при производстве лекарственных веществ. Поэтому работа, выполняемая Комиссией по Британской Фармакопее, дополняет деятельность Агентства в области лицензирования лекарственных препаратов и инспектирования фармацевтических предприятий.
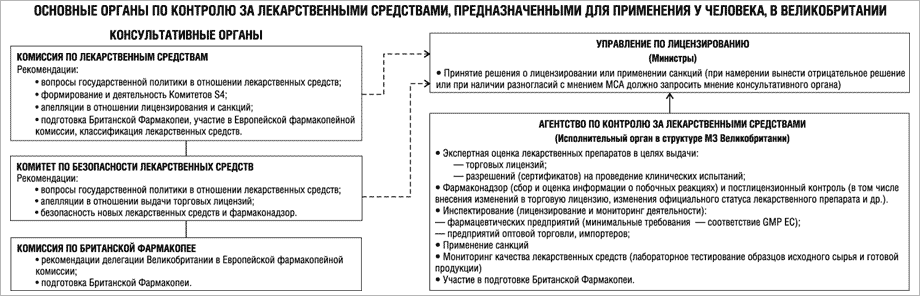
Основной исполнительный орган в его современном виде — Агентство по контролю за лекарственными средствами (the United Kingdom Medicines Kontrol Agency — MCA) был создан в 1989 г. путем реорганизации Отдела по лекарственным средствам МЗ Великобритании (этот отдел осуществлял контроль за лицензированием лекарственных средств с 1972 г.).
Однако если иметь в виду процесс принятия решения о лицензировании, то MCA является не исполнительным, а консультативным экспертным органом, поскольку право принимать решение имеет только Управление по лицензированию, которому MCA предоставляет тщательно обоснованные рекомендации. На практике Управление по лицензированию крайне редко принимает решения, идущие вразрез с рекомендациями MCA.
Аналогичная система разделения полномочий между органом, проводящим оценку лекарственных средств (Агентством по контролю за лекарственными средствами), и органом, наделенным правом принимать решение о лицензировании, существует во всех странах ЕС (за исключением Нидерландов, где экспертный и исполнительный орган представлены одним учреждением), а также и на общесоюзном уровне. Например, Европейское агентство по контролю за лекарственными средствами силами Комитета по патентованным лекарственным препаратам проводит оценку и составляет свое заключение — мнение (аналогичное рекомендации в Великобритании), которое направляет в Комиссию ЕС, принимающую решение о предоставлении лицензии, а в конфликтных ситуациях такое решение может принимать только Совет ЕС, а именно: Совет министров (аналогично коллективному решению министров в составе Управления по лицензированию Великобритании).
При вступлении Великобритании в ЕС (1973 г.) положения закона «О лекарственных средствах» с последующими поправками к нему, постановлениями, директивами и указами (подчиненное законодательство) были приведены в соответствие с положениями соответствующих директив и постановлений ЕС.
ОРГАНЫ ЛИЦЕНЗИРОВАНИЯ И КОНТРОЛЯ
Управление по лицензирование (Licensing Authority — LA)
Контроль за лекарственными средствами в Великобритании в первую очередь осуществляется посредством системы лицензирования. Управление — единственный орган, уполномоченный принимать решения по вопросам лицензирования лекарственных средств в Великобритании (естественно, если не принимать во внимание централизованную процедуру лицензирования ЕС).
Управление отчитывается перед парламентом по вопросам контроля за лекарственными препаратами для применения у человека.
Состав
Управление по лицензированию — орган министров. В него входит группа министров здравоохранения и группа министров сельского хозяйства, которые принимают коллективное решение по вопросам предоставления лицензий на лекарственные препараты.
Управление возглавляет государственный секретарь здравоохранения (the Secretary of State for Health), он же возглавляет и МЗ Великобритании (Department of Health). Государственный секретарь считается «главным» министром здравоохранения и обычно, когда речь идет о «министре здравоохранения» без точного указания должности, имеют в виду именно государственного секретаря (во избежание путаницы, мы будем придерживаться этого названия должности). Его основная функция — исполнительная. Он также отвечает за материально-финансовое и стратегическое информационное обеспечение как Национальной службы здравоохранения в целом, так и Управления по лицензированию, а также неразрывно связанного с управлением Агентства по контролю лекарственных средств. (Интересно, что буквально на днях институт государственных секретарей ввели в Украине. Вопрос в том, будет ли он настолько же эффективен, как, например, в Великобритании или США). В настоящий момент должность государственного секретаря занимает А. Милберн, член парламента, который имеет экономическое образование.
В Великобритании, как и в других промышленно развитых странах, министерства в основном выполняют политические функции. Поэтому все министры здравоохранения назначаются правительством Великобритании и являются либо членами парламента (MP), избранными народом, — то есть членами палаты общин, либо членами палаты лордов. В связи с характером выполняемых функций министры здравоохранения, как правило, не имеют медицинского образования.
Например, к рангу министров здравоохранения Великобритании относятся:
-
министр здравоохранения (Minister of State for Health), MP, основные функции — общие вопросы Национальной службы здравоохранения и предоставления медицинской помощи;
-
министр в палате общин (Minister of State in the Commons), MP, основные функции — предоставление медицинской помощи различным социальным группам населения;
-
парламентский заместитель государственного секретаря от палаты лордов (Parliamentary Under Secretary of State, Lords), член палаты лордов, основные функции — вопросы предоставления качественной медицинской помощи, а также качество медикаментов, медицинских приборов и изделий медицинского назначения;
-
парламентский заместитель государственного секретаря по вопросам общественного здравоохранения (Parliamentary Under Secretary of State for Public Health), MP;
-
парламентский заместитель государственного секретаря по вопросам неотложной помощи и привлечения к сотрудничеству общественности и пациентов (Parliamentary Under Secretary of State), MP;
-
министры здравоохранения Шотландии и Северной Ирландии.
Аналогичный состав и министров, относящихся к системе Министерства сельского хозяйства, рыболовства и продовольствия (Ministry of Agriculture, Fisheries and Food).
Основная функция Управления по лицензированию — принятие решения о выдаче лицензии или сертификата на основании оценки БЭК, проведенной Агентством по контролю за лекарственными средствами.
Управление выдает основные типы лицензий: торговые, на параллельный импорт, на производство, на оптовую торговлю. Кроме того, Управление либо выдает сертификат на проведение клинического испытания нового или импортируемого лекарственного средства, либо освобождает от его проведения (что в последние 20 лет управление осуществляет чаще в рамках так называемой льготной схемы клинических испытаний — clinical trial exemption scheme). Срок действия всех лицензий составляет 5 лет, а сертификата на клинические испытания или на освобождение от него — 3 года.
Экспертную оценку предоставляет Агентство по контролю за лекарственными препаратами в Великобритании. Приблизительно 90% всех заявок на получение торговой лицензии Управление рассматривает только на основании оценки, проведенной Агентством, и его рекомендаций, не обращаясь за помощью консультативных органов. Управление обязано принимать решение (положительное или отрицательное) только на основании данных, имеющих отношение к БЭК.
Управление не имеет права отказать в выдаче, аннулировать, приостановить действие торговой лицензии или обязать владельца внести в нее изменения без предварительной консультации с соответствующим независимым органом (за исключением неотложных случаев, представляющих непосредственную угрозу здоровью населения). В таких случаях Управление перед принятием решения запрашивает мнение экспертов независимых консультативных органов (но только по вопросам, имеющим отношение к БЭК лекарственного препарата): Комиссии по лекарственным средствам или соответствующего комитета S4, чаще Комитета по безопасности лекарственных средств. Агентство предоставляет этим органам материалы, содержащие критическую оценку фармацевтических, медицинских и научных данных, сопровождающих заявку на получение лицензии.
Агентство по контролю за лекарственными средствами
(The United Kingdom Medicines Control Agency — MCA)
Агентство — основной орган, отвечающий за проведение оценки и лицензирование всех лекарственных препаратов для применения у человека, поступающих в обращение в Великобритании. Оно является исполнительным государственным органом и относится к структуре МЗ Великобритании. Осуществляет повседневный контроль за лекарственными средствами в стране. MCA подотчетно Управлению по лицензированию. В рамках процесса принятия решения о лицензировании Агентство является консультативным экспертным органом и фактически готовит проект решения, которое принимает Управление по лицензированию.
Основная функция MCA — охрана здоровья населения посредством обеспечения безопасности, эффективности и качества лекарственных средств, которые находятся в обращении, а также своевременное предоставление высококвалифицированных и экономически эффективных услуг, способствующих развитию британской фармацевтической промышленности [1, 3, 4].
Руководство MCA
Государственный секретарь здравоохранения определяет стратегические задачи деятельности Агентства и систему его финансирования, а непосредственное руководство работой Агентства осуществляет исполнительный директор, который подотчетен государственному секретарю здравоохранения Великобритании.
Парламентский заместитель государственного секретаря от палаты лордов наряду с ответственностью за деятельность Национальной службы здравоохранения несет особую ответственность за деятельность Агентства.
Государственный секретарь здравоохранения может консультироваться с Наблюдательным советом МЗ (контрольным органом) в отношении планирования и оценки деятельности MCA.
Функции основных отделов MCA
В штате МСА более 500 сотрудников, которые являются государственными служащими, в основном — это эксперты разных специальностей, которые объединены в функциональные рабочие группы. Агентство имеет 7 отделов.
Отдел лицензирования
Отвечает за проведение оценки всех лекарственных средств для человека перед выдачей торговой лицензии для их размещения на рынке Великобритании. Сюда поступают все материалы досье, которое сопровождает заявку на получение торговой лицензии. (В последние годы подача 1 заявки на новый лекарственный препарат сопровождается в среднем 170 томами данных, каждый из которых равен по объему телефонному справочнику).
Проводит оценку и контролирует проведение всех клинических испытаний в Великобритании.
Отвечает за подготовку Британской Фармакопеи, за присвоение новым активным лекарственным субстанциям Британских общепринятых названий (British Approved Names — BAN) и за участие делегации Великобритании в Европейской фармакопейной комиссии.
Проводит оценку для выдачи лицензий на параллельный импорт препаратов из других государств ЕС (при условии, что торговая лицензия на препарат выдана и в этом государстве и в Великобритании, что препараты терапевтически эквивалентны и есть маркировка на английском языке, отвечающая национальным требованиям).
Постлицензионный отдел
Отвечает за осуществление фармаконадзора. Собирает и оценивает информацию о побочных реакциях. Проверяет соответствие лицензионной информации о свойствах лекарственного препарата приобретенному опыту его клинического применения. Проверяет правильность клинического применения лекарственного препарата. (Особенно интенсивный фармаконадзор осуществляет в первые 2 года после поступления нового лекарственного препарата на рынок).
Осуществляет постлицензионный контроль за внесением изменений в лицензии, продлением срока их действия, изменением официального статуса лекарственного препарата (например, переводит препарат из рецептурной категории в безрецептурную), предоставлением информации о лекарственном препарате и рекламированием. (Ежегодно рассматривает около 10 тыс. заявок только на внесение изменений в лицензии).
Отдел инспекций и санкций
Отдел отвечает за то, что все лекарственные препараты с действительной торговой лицензией производятся, реализуются и импортируются в соответствии с требованиями фармацевтического производства (GMP ЕС) и оптовой торговли (GDP ЕС), а также в соответствии со стандартами качества, которые установлены при рассмотрении заявки на торговую лицензию, в том числе фармакопейными стандартами Британской и Европейской Фармакопей. Все производства лекарственных средств в Великобритании, предприятия оптовой торговли и импортеры должны быть лицензированы. Для выполнения этой задачи отдел:
• проводит не реже 1 раза в год инспектирование всех предприятий по производству фармацевтической продукции в Великобритании (около 500 предприятий), не реже 1 раза в 5 лет — предприятий оптовой торговли и не реже 1 раза в 2 года — импортеров. Отдел имеет штат инспекторов и, кроме штаб-квартиры в Лондоне, 4 региональных отдела для проведения регулярных инспекций;
• проводит инспекции зарубежных фармацевтических предприятий. Такую проверку осуществляют либо инспекторы MCA, либо от его имени инспекторы той страны, где расположено производство;
• проводит инспекции в тех случаях, когда внесение изменений в лицензию требует изменения процесса производства лекарственного препарата, а также при изменении или создании нового места производства, внедрении нового производственного процесса, производстве новой лекарственной формы и др. (инспектируемые предприятия оплачивают проведение инспекции);
-
проводит тестирование (в рамках системы мониторинга качества) исходного сырья и отобранных образцов серий готовой продукции в собственной лаборатории или заключает контракты на проведение таких исследований от имени Агентства с другими лабораториями (в частности, с лабораторией Королевского фармацевтического общества Великобритании в Эдинбурге, которая ежегодно тестирует для MCA более 2000 проб в год);
-
обеспечивает проведение независимой лабораторией тестирования новых методик для стандартных фармакопейных статей, проверку соответствия аналитических методов предполагаемой цели исследования и определение их воспроизводимости;
-
выдает экспортные сертификаты (по требованию), которые удостоверяют, что предприятие, производящее лекарственный препарат, лицензировано, производство отвечает стандартам GMP ЕС и регулярно инспектируется, а также указывает лицензионный статус препарата. Такой сертификат отвечает требованиям системы сертификации качества лекарственных препаратов ВОЗ. (Ежегодно отдел выдает около 7 тыс. сертификатов). Следует отметить, что Великобритания является страной-участницей (представленной Управлением по лицензированию как компетентным уполномоченным органом) Конвенции по фармацевтическим инспекциям (Конвенции о взаимном признании инспекций в отношении производства фармацевтических препаратов). Это позволяет не проводить инспекцию производства импортируемых лекарственных препаратов в странах-участницах;
-
проводит расследование при подозрении на незаконную деятельность и отвечает за применение необходимых санкций;
-
сотрудничает с Комиссией по Британской Фармакопее.
КОНСУЛЬТАТИВНЫЕ ОРГАНЫ
Комиссия по лекарственным средствам
(Medicines Commission — MC)
В составе Комиссии 22 члена — эксперты в области медицины и фармакологии (назначаются министрами сроком на 4 года после проведения широких консультаций с рядом организаций, представляющих интересы различных сторон, в том числе интересы фармацевтических компаний). Комиссия проводит 5 совещаний в год.
Функции:
1) консультативная помощь министрам здравоохранения и сельского хозяйства по вопросам государственной политики в области лекарственных средств и исполнения закона «О лекарственных средствах»;
2) специфические функции, возложенные законом 1968 г.:
а) рекомендации министрам по созданию специализированных Комитетов S4 с определением их функций;
б) рекомендация министрам кандидатов (высококвалифицированных специалистов) на членство в Комитетах 4S;
в) периодическая оценка деятельности Комитетов 4S и рекомендации по изменению их числа или выполняемых функций;
г) выполнение функций, специфичных для определенного Комитета 4S, если необходимый комитет еще не создан;
3) рассмотрение апелляций в отношении лицензий или сертификатов на проведение клинических испытаний (в тех случаях, когда Управление по лицензированию, исходя из рекомендации одного из Комитетов 4S, намерено: отказать в выдаче лицензии, внести в нее изменения, приостановить действие или аннулировать лицензию или сертификат), с проведением слушаний, а затем направление апелляции в Управление по лицензированию вместе с докладом, рекомендациями и их обоснованием;
4) осуществление функций, относящихся к публикации Британской Фармакопеи, других компендиумов, перечней названий лекарственных веществ и др.
КОМИТЕТЫ 4S
1. Комитет по безопасности лекарственных средств (Committee on Safety of Medicines — CSM)
В составе CSM 34 члена (назначаются министрами здравоохранения сроком на 3 года). Из них 32 — эксперты в области фармакологии, фармации, токсикологии, практической и экспериментальной медицины, а 2 — представители общественности. CSM проводит заседания 2 раза в месяц (средней продолжительностью 5–6 ч).
Комитету оказывают помощь 3 специализированных подкомитета:
-
подкомитет по химии, фармации и стандартам (Chemistry, Pharmacy and Standards Subcommittee — CPS);
-
подкомитет по биологическим препаратам (Biologicals Subcommittee);
-
подкомитет по фармаконадзору (Pharmacovigilance Subcommittee — SCOP).
Кроме того, CSM и MCA создали группу внешних экспертов-консультантов, к которым обращаются за помощью по тем вопросам, решение которых требует специальной квалификации, отсутствующей у членов Комитета или Агентства.
При необходимости CSM и MCA создают совместные рабочие группы по специальным вопросам, имеющим отношение к БЭК лекарственных средств, но не отдельных препаратов, а определенных групп.
Основные функции CSM:
-
рекомендации министрам в отношении государственной политики в области лекарственных средств;
-
рекомендации Управлению по лицензированию в отношении целесообразности выдачи торговой лицензии на лекарственный препарат, содержащий новую активную субстанцию (на основании проведенной им оценки данных о БЭК);
-
мониторинг безопасности лекарственных препаратов, поступивших в обращение (в тесном сотрудничестве с отделом MCA по постлицензионному контролю);
-
участие в рассмотрении апелляций (изучает материалы проведенной MCA оценки БЭК, после чего дает рекомендации Управлению по лицензированию по окончательному решению).
2. Консультативный совет по регистрации гомеопатических средств (Advisory Board on the Registration of Homoeopathic Products)
Создан в 1994 г. согласно указу ST 1994/102 на основании ст. 4 закона «О лекарственных средствах». Как следует из названия, выполняет консультативную функцию в отношении гомеопатических препаратов.
3. Комитет по ветеринарным препаратам (Veterinary Products Committee — VPC)
4. Комиссия по Британской Фармакопее (British Pharmacopoeia Commission — BPC)
Национальный уполномоченный фармакопейный орган.
В составе комиссии 14 экспертов в области фармации и медицины (назначаются сроком на 3 года).
Секретариат комиссии формируется из специалистов MCA.
Комиссия имеет ряд вспомогательных специализированных комитетов (по химическим веществам, несколько комитетов по лекарственным химическим веществам, антибиотикам, галеновым, иммунологическим препаратам, биологическим материалам, микробиологии, номенклатуре и фармации), а также 2 консультативные группы (по хирургическим и радиоактивным материалам).
Основные функции комиссии и секретариата:
-
подготовка к публикации новых изданий Британской Фармакопеи и Британской Фармакопеи (Ветеринария);
-
предоставление консультативной помощи делегации Великобритании в Европейской фармакопейной комиссии;
-
выбор и присвоение активным лекарственным субстанциям британских общепринятых названий (British Approved Names — BAN).
Комитеты 4S, завершившие свою работу:
1. Комитет по пересмотру лекарственных средств (Committee on the Review of Medicines — CRM)
С 1975 по 1991 г. провел переоценку всех старых лекарственных средств на рынке Великобритании.
2. Комитет по стоматологическим и хирургическим материалам (Committee on Dental and Surgical Materials, CDSM)
Проводил оценку (аналогичную выполняемой CSM в отношении новых лекарственных препаратов) изделий медицинского назначения. В настоящее время эту функцию выполняет Агентство по медицинским приборам (Medical Device Agency, MDA).
Андрей Спасокукоцкий


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим